Abilify Maintena 400 Mg Uzun Salımlı İm Enjeksiyonluk Flakon Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIABILIFY MAINTENA 400 mg uzun salımlı IM enjeksiyon için süspansiyon içeren flakon Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir enjektabl toz içeren flakon etkin madde olarak 400 mg aripiprazol içerir. Yardımcı madde(ler):Karboksimetil selüloz sodyum 19,76 mg/flakon Sodyum fosfat monobazik monohidrat 1,76 mg/flakon Sodyum hidroksitpH 7,0 için Yardımcı maddeler için 6.1' e bakınız. 3. FARMASÖTİK FORMSteril uzatılmış salımlı enjektabl süspansiyon Beyazımsı kimyasal kektir, sulandırıldığında beyazımsı akışkan süspansiyon elde edilir. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarABILIFY MAINTENA, erişkinlerde şizofreni tedavisinde endikedir. ABILIFY MAINTENA® erişkinlerde bipolar I bozukluğun idame tedavisinde monoterapi olarak endikedir. 4.2 Pozoloji ve uygulama şekliPozoloji:YetişkinlerDaha önce aripiprazol almamış hastalar için, ABILIFY MAINTENA'yı başlatmadan önce oral aripiprazol ile tolerabilite belirlenmiş olmalıdır. ABILIFY MAINTENA dozunun titrasyonu gerekli değildir. Başlangıç dozu, iki rejimden biri izlenerek uygulanabilir. Bu iki rejim arasında etkililik bakımından bir fark yoktur. Bu iki rejim arasındaki tercihte hastanın oral aripiprazol kullanımıylailişkili tutumu yol gösterici olabilir: Bir enjeksiyon başlangıcı: Başlama gününde, bir 400 mg ABILIFY MAINTENA enjeksiyonuuygulayın ve tedavinin başlangıcında terapötik aripiprazol konsantrasyonlarını korumak için artarda 14 gün boyunca günde 10 mg ila 20 mg oral aripiprazol ile tedaviye devam edin. İki enjeksiyon başlangıcı: Başlama gününde, bir 20 mg oral aripiprazol dozu ile birlikte ayrıenjeksiyon bölgelerine iki ayrı 400 mg ABILIFY MAINTENA enjeksiyonu yapın (uygulamayöntemine bakın). 1 Enjeksiyon başlangıcından sonra, önerilen ABILIFY MAINTENA idame dozu 400 mg'dır. ABILIFY MAINTENA ayda bir kez tek enjeksiyon olarak uygulanmalıdır (iki enjeksiyon arasısüre 26 günden daha kısa olmamalıdır). Eğer 400 mg dozda advers reaksiyonlar gözleniyorsa 300 mg'lık doza indirmeyi düşünebilirsiniz. Unutulan dozlar için dozaj ayarlanması gerekir. Eğer ikinci ya da üçüncü doz unutulursa: Son enjeksiyonun üzerinden en az 4, en fazla 5 hafta geçtiyse enjeksiyonu en kısa süredeyapınız Eğer son enjeksiyonun üzerinden 5 haftadan daha uzun süre geçtiyse sıradaki enjeksiyonlabirlikte 14 gün süreyle oral aripiprazole tekrar başlayınız veya bir 20 mg oral aripiprazol dozuile birlikte 2 ayrı enjeksiyon bir seferde yapınız. Bu uygulamadan sonra aylık enjeksiyonplanlamasını devam ettiriniz. Eğer dördüncü ya da sonraki dozlar unutulursa: Son enjeksiyonun üzerinden en az 4, en fazla 6 hafta geçtiyse enjeksiyonu en kısa süredeyapınız Eğer son enjeksiyonun üzerinden 6 haftadan daha uzun süre geçtiyse sıradaki enjeksiyonlabirlikte 14 gün süreyle oral aripiprazole tekrar başlayınız veya bir 20 mg oral aripiprazol dozuile birlikte 2 ayrı enjeksiyon bir seferde yapınız. Bu uygulamadan sonra aylık enjeksiyonplanlamasını devam ettiriniz. Uygulama şekli:Sadece bir sağlık çalışanı tarafından gluteal veya deltoid kasa intramusküler enjeksiyonla uygulanır. Gluteal veya deltoid kasa tek bir enjeksiyon gibi yavaşça uygulanmalıdır. Dozları bölmeyiniz. Damar içine uygulanmasından kaçınılmalıdır. Enjeksiyon her iki gluteal veya deltoid kasadönüşümlü olarak yapılmalıdır. Gluteal kas uygulaması için obez olmayan hastalarda önerilen enjektör iğnesi 1,5 inç (38 mm), 22-gauge; obez hastalar için (vücut kitle indeksi >28 kg/m2) 2 inç (51 mm), 21-gauge enjektöriğnesi kullanılmalıdır. Deltoid kas uygulaması için obez olmayan hastalarda önerilen enjektör iğnesi 1 inç (25 mm), 23-gauge; obez hastalar için 1,5 inç (38 mm), 22-gauge enjektör iğnesi kullanılmalıdır. Her iki uygulama yeri için de flakon hazırlandıktan hemen sonra enjeksiyon yapılamadıysa flakon 25°C (77°F) altında 4 saate kadar bekletilebilir. Bekletme sonrası uygulamadan önce enaz 60 saniye boyunca flakon güçlü bir şekilde karıştırılmalıdır. ABILIFY MAINTENA daki flakon ve enjeksiyonluk steril su sadece tek kullanımlıktır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Şiddetli böbrek yetmezliği olan hastalarda (kreatinin klirensi <30 ml/dak), oral aripiprazol (15 mg oral tek doz olarak verilen) ve dehidro-aripiprazolün Cmaks değeri sırasıyla%36 ve %53 arttı; ancak, EAA değeri aripiprazol için %15 daha düşük ve dehidro-aripiprazoliçin %7 daha yüksekti. Değişmemiş aripiprazol ve dehidro-aripiprazolün her ikisinin renal atılımıdozun %1'inden azdır.Böbrek yetmezliği olan kişilerde ABILIFY MAINTENA için bir doz ayarlaması yapılmasına gerek yoktur. Karaciğer yetmezliği:Hafif ve orta derecede karaciğer yetmezliğinde doz ayarlamasına gerek yoktur. Ciddi karaciğer yetmezliği olan hastalarda yeterli veri bulunmamaktadır. Bu hastalardadoz dikkatli bir şekilde ayarlanmalıdır. Bu tip hastalarda eğer sürekli kullanım gerekiyorsa oralformu tercih edilmelidir.Pediyatrik popülasyon:ABILIFY MAINTENA'nın 18 yaşın altındaki hastalarda güvenliliği ve etkililiği değerlendirilmemiştir. Bu sebeple 18 yaş altındaki hastalarda kullanılmasıönerilmemektedir.Geriyatrik popülasyon:ABILIFY MAINTENA'nın 65 yaşın üzerindeki hastalarda güvenliliği ve etkililiği değerlendirilmemiştir.Oral, tek-doz farmakokinetik çalışmalarda (15 mg oral tek doz olarak verilen aripiprazol ile), aripiprazol klirensi yaşlı kişilerde (>65 yaş) genç erişkinlere (18-64 yaş arası) oranla %20 dahadüşüktü. Bununla birlikte, şizofrenili hastalarda oral aripiprazolün popülasyon farmakokinetikanalizinde saptanabilir bir yaş etkisi yoktu. Ayrıca, yaşlı hastalarda çoklu dozlardan sonra oralaripiprazolün farmakokinetiği genç, sağlıklı kişilerdekine benzer göründü. Yaşlı hastalar için ABILIFY MAINTENA dozunda bir ayarlama yapılması önerilmemektedir. Cinsiyet:Aripiprazol ve aktif metaboliti olan dehidro-aripiprazolün Cmaks ve EAA değerleri kadınlarda erkeklerdekinden %30 ile %40 daha yüksektir ve buna uygun olarak aripiprazolüngörünür oral klirensi kadınlarda daha düşüktür. Bununla birlikte bu farklılıklar kadınlar veerkeklerin vücut ağırlıkları arasındaki farkla (%25) büyük ölçüde açıklanır.Cinsiyet nedeniyle ABILIFY MAINTENA için bir doz ayarlaması yapılmasına gerek yoktur. CYP2D6 yavaş metabolize ediciler: Bir enjeksiyon başlangıcı: Başlangıç dozu 300 mg ABILIFY MAINTENA olmalı ve tedaviyeart arda 14 gün boyunca günde reçete edilen oral aripiprazol dozu ile devam edilmelidir. İki enjeksiyon başlangıcı: Başlangıç dozu, daha önce reçete edilen oral aripiprazol dozunun tekbir dozu ile birlikte 2 ayrı 300 mg ABILIFY MAINTENA enjeksiyonu (uygulama yönteminebakınız) olmalıdır. CYP2D6 yavaş metabolize ediciler ve CYP3A4 inhibitörleri ile birlikte kullanım: Tek enjeksiyon başlangıcı: Başlangıç dozu 200 mg'a düşürülmeli ve tedaviye art arda 14 günboyunca günde önerilen oral aripiprazol dozu ile devam edilmelidir. CYP2D6'yı yavaş metabolize eden ve aynı zamanda güçlü bir CYP3A4 inhibitörü kullananhastalarda iki enjeksiyonlu başlatma kullanılmamalıdır. Enjeksiyon başladıktan sonra ABILIFY MAINTENA önerilen idame dozunun ayarlanması için Tablo 1'e bakınız. ABILIFY MAINTENA ayda bir kez tek enjeksiyon olarak uygulanmalıdır(önceki enjeksiyondan en geç 26 gün sonra). CYP2D6 ve/veya CYP3A4 inhibitörleri ve/veya CYP3A4 indükleyicileri ile birlikte kullanım:Güçlü CYP3A4 inhibitörleri veya güçlü CYP2D6 inhibitörlerinin 14 günden uzun süreli 3 / 31 kullanımında doz ayarlaması önerilmektedir (Tablo 1'e bakınız). CYP3A4 inhibitörü veya CYP2D6 inhibitörü kesilirse, dozajın önceki doza yükseltilmesi gerekebilir (bkz. bölüm 4.5).ABILIFY MAINTENA'nın doz ayarlamalarına rağmen advers reaksiyonlar olması durumunda,CYP2D6 veya CYP3A4 inhibitörünün eşzamanlı kullanımının gerekliliği yenidendeğerlendirilmelidir (bkz. bölüm 4.5). CYP3A4 indükleyicilerinin ABILIFY MAINTENA ile birlikte 14 günden fazla kullanımından kaçınılmalıdır. Çünkü aripiprazolün kan seviyeleri düşer ve etkili seviyelerin altında olabilir.(bkz. bölüm 4.5)
Tablo 1: CYP2D6 yavaş metabolize edici olduğu bilinen ve 14 günden uzun süreli CYP2D6 inhibitörleri, CYP3A4 inhibitörleri ve/veya CYP3A4 indükleyicileri kullanan hastalardaABI LIFY MAINTENA doz ayarlaması4.3 KontrendikasyonlarAripiprazole veya diğer yardımcı maddelere karşı bilinen aşırı duyarlılığı olanlarda kontrendikedir. 4.4 Özel kullanım uyarıları ve önlemleriAntipsikotik tedavi sırasında, hastanın klinik durumunun düzelmesi birkaç günden birkaç haftaya kadar sürebilir. Bu dönem boyunca hastalar yakından gözlenmelidir. Aripiprazol doğrudan antidepresan tedavi amaçlı kullanılmamalıdır. Konvansiyonel ve atipik antipsikotik ilaçlar demansa bağlı psikozu olan yaşlı hastaların tedavisinde kullanıldığında ölüm riskinde artışa nedenolmaktadır. Ani kaygı veya şiddetli psikotik durum yaşayan hastalarda kullanım:Acil semptom kontolü gerekliliğinde, ani kaygı veya şiddetli psikotik durum yönetiminde ABILIFY MAINTENA kullanılmamalıdır. İntihar:İntihar davranışı psikotik hastalıkların doğasında var olan bir durumdur. ABILIFY MAINTENA başlandıktan sonra hemen sonra ya da diğer antipsikotiklerden ABILIFY MAINTENA'yageçişte intihar vakaları bildirilmiştir (bkz. bölüm 4.8). İntihar açısından yüksek riskli vakalardaantipsikotik tedavi ile yakın gözetim birlikte sürdürülmelidir. 4 / 31 Kardiyovasküler hastalıklar:Bilinen bir kardiyovasküler hastalığı (miyokard infarktüsü veya iskemik kalp hastalığı öyküsü, kalp yetmezliği veya ileti anormalliği), serebrovasküler hastalığı olanlarda, hızlandırılmış ya dakötü huylu durumların da dahil olduğu, hastayı hipotansiyona (dehidratasyon, hipovolemi veantihipertansif ilaçlarla tedavi) veya hipertansiyona eğilimli hale getiren durumlarda ABILIFYMAINTENA dikkatli kullanılmalıdır. Antipsikotik ilaçlara bağlı venöz tromboemboli (VTE) vakaları raporlanmıştır. Antipsikotiklerle tedavi olan hastalarda sıklıkla VTE risk faktörleri bulunduğu için ABILIFY MAINTENAtedavisine başlamadan önce ve tedavi sırasında tüm olası risk faktörleri tanımlanmalı vekoruyucu önlemler alınmalıdır (bkz. bölüm 4.8). QT Uzaması:Oral aripiprazol ile yapılan klinik çalışmalarda QT uzaması sıklığı plasebo ile benzer çıkmıştır. QT uzaması açısından aile öyküsü bulunanlarda aripiprazol dikkatli kullanılmalıdır. Tardif diskinezi:Antipsikotiklerle tedavi edilen hastalarda potansiyel olarak geri dönüşümü olmayan, istemsiz, diskinetik hareketlere ait bir sendrom gelişebilir. Bu sendrom prevalansının en yüksek olarakyaşlılar arasında olduğu, özellikle de yaşlı kadınlarda görülmesine rağmen, hangi hastada busendromun gelişme olasılığının yüksek olduğunu ön görmek mümkün değildir. Antipsikotikilaçların tardif diskineziye neden olma potansiyellerindeki farklılıklar bilinmemektedir. Hastaya uygulanan tedavi süresi ve toplam kümülatif antipsikotik ilaç dozu arttıkça geri dönüşümsüz hale gelebilecek tardif diskinezi gelişme riski ve olasılığının artacağınainanılmaktadır. Ancak, düşük dozlarda nispeten kısa tedavi dönemlerinden sonra bile çok dahaaz yaygın olmakla birlikte bu sendrom gelişebilmektedir. Antipsikotik tedavi kesilirse bu sendrom kısmen veya tamamen gerileyebilmesine rağmen, yerleşmiş tardif diskinezi için bilinen bir tedavi bulunmamaktadır. Ancak antipsikotik tedavininkendisi, bu sendromun bulgu ve semptomlarını baskılayabilir (ya da kısmen baskılayabilir) vedolayısıyla altta yatan nedeni maskeleyebilir. Bu sendromun uzun süreli gidişatı üzerinesemptomatik baskılamanın etkisi bilinmemektedir. Bu düşünceler göz önüne alındığında ABILIFY MAINTENA, tardif diskinezi oluşumunu en aza indirecek mümkün olan en olası durumda reçete edilmelidir. Kronik antipsikotik tedavi, genelolarak 1) antipsikotik ilaçlara yanıt verdiği bilinen kronik hastalık şikayeti olan hastalar için ve2) alternatif, eşit etkili, fakat potansiyel olarak daha az zararlı tedaviler bulunmadığı veya uygunolmadıkları durumlar için saklanmalıdır. Kronik tedavi gerektiren hastalarda memnun edici birklinik yanıt oluşturan en küçük doz ve en kısa tedavi süresi aranmalıdır. Sürekli tedavi ihtiyacıperiyodik olarak yeniden değerlendirilmelidir. Bir yıl veya daha kısa süreli klinik çalışmalarda, aripiprazol tedavisi sırasında yaygın olmayan acil tedavi diskinezi raporlanmıştır. Tardif diskinezi bulgu ve semptomları ABILIFYMAINTENA ile tedavi edilen bir hastada görülürse, doz azaltılması veya ilacın kesilmesidüşünülmelidir (bkz. bölüm 4.8). Bu semptomlar geçici olarak kötüleşebilir veya tedavininkesilmesinden sonra ortaya çıkabilir. Ancak bazı hastalar bu sendromun varlığına rağmenABILIFY MAINTENA ile tedavi gerektirebilir. 5 / 31 Nöroleptik malign sendrom:Bazen nöroleptik malign sendrom (NMS) olarak adlandırılan potansiyel olarak ölümcül semptom kompleksi ABILIFY MAINTENA dahil antipsikotik ilaç uygulamasıyla ortaya çıkabilmektedir.Tüm dünyadaki klinik veri tabanında aripiprazol tedavisi sırasında seyrek olarak NMS vakalarımeydana gelmiştir. NMS'nin klinik bulguları, hiperpireksi, kas katılığı, mental durum değişikliği ve otonomik kararsızlık bulgularıdır (düzensiz nabız veya kan basıncı, taşikardi, diaforezis ve kardiyakdisritmi). Bunlara ek bulgular, yükselmiş kreatin fosfokinaz, miyoglobinüri (rabdomiyoliz) veakut böbrek yetmezliğini içerebilir. Bununla birlikte, zorunlu olarak NMS ile ilişkili olmayanyüksek kreatinin fosfokinaz ve rabdomiyoliz de rapor edilmiştir. Bu sendroma sahip hastaların tanısal değerlendirmesi karmaşıktır. Hem ciddi tıbbi hastalıklar (ör., pnömoni, sistemik enfeksiyon) hem de tedavi edilmemiş ya da yeterince tedavi edilmemişekstrapiramidal bulgu ve semptomları (EPS) içeren klinik görünüme ait olguların dışlanmasıtanıya ulaşmada önemlidir. Ayırıcı tanıda diğer önemli noktalar santral antikolineıjik toksisite,sıcak çarpması, ilaç ateşi ve primer santral sinir sistemi patolojisini içermektedir. NMS yönetimi şunları kapsamalıdır: 1) devam eden tedavide elzem olmayan antipsikotik ilaçların ve diğer ilaçların derhal kesilmesi; 2) yoğun semptomatik ve tıbbi izleme; ve 3) spesifiktedavisi bulunan eşlik eden herhangi bir ciddi tıbbi sorunun tedavisi. Komplike olmayan NMSiçin spesifik farmakolojik tedavi rejimi ile ilgili hiçbir genel kabul bulunmamaktadır. Eğer bir hasta NMS'den iyileştikten sonra antipsikotik ilaç tedavisine ihtiyaç duyarsa, ilaç tedavisinin yeniden başlanması dikkatli bir şekilde gözden geçirilmelidir. NMS tekrarlamalarıbildirildiğinden hasta tedavideyken dikkatli bir şekilde takip edilmelidir. Nöbet:Klinik çalışmalarda, aripiprazol tedavisi sırasında nadir görülen nöbet vakaları bildirilmiştir. Diğer antipsikotik ilaçlarla olduğu gibi, nöbet öyküsü olan veya nöbet eşiğini düşüren durumlarasahip hastada ABILIFY MAINTENA dikkatli bir şekilde kullanılmalıdır. Nöbet eşiğini düşürendurumlar, 65 yaş ve yukarısındaki yaşlı popülasyonda daha sık olabilir. Demansla-ilişkili psikozu olan yaşlı hastalarda:Artan MortaliteAlzheimer Hastalığı'na bağlı psikozu olan yaşlı hastalarla yürütülen 3 plasebo kontrollü klinik çalışmada oral aripiprazol ile tedavi edilen hastalarda (n= 938, ortalama yaş: 82,4; yaş aralığı:56-99 yıl) ölüm riski plasebo grubuna göre daha yüksek bulunmuştur. Aripiprazolle tedavi edilenhastalarda ölüm riski %3,5 iken plasebo grubunda bu risk %1,7 olarak tespit edilmiştir. Ölümnedenleri farklı olmakla birlikte çoğunun ya kardiyovasküler (ör., kalp yetmezliği, ani ölüm) yada enfeksiyöz (ör., pnömoni) nedenli olduğu görünmektedir (bkz. bölüm 4.8). Serebrovasküler Advers ReaksiyonlarOral aripiprazolle yürütülen bu çalışmalarda, ölüme de neden olan serebrovasküler advers reaksiyonların (ör., inme, geçici iskemik atak) sıklığında bir artış görülmüştür (ortalama yaş: 84,yaş aralığı: 78-88). Genel olarak bu çalışmalarda aripiprazol grubundaki hastaların %1,3'ündeserebrovasküler reaksiyonlar görülürken plasebo grubundaki hastalarda bu oran %0,6'ydı. Bufark istatistiksel olarak anlamlı değildir. Bununla birlikte tek bir sabit doz çalışmasında oralaripiprazol ile tedavi edilen hastalarda serebrovasküler advers reaksiyonlar için istatistikselolarak anlamlı bir doz yanıt ilişkisi ortaya çıkmıştır (bkz. bölüm 4.8). 6 / 31 ABILIFY MAINTENA, demansla-ilişkili psikozlu hastaların tedavisinde onaylı değildir. Aşırı Duyarlılık:Alerjik reaksiyon olarak karakterize edilen aşırı duyarlılık reaksiyonları aripiprazol ile gözlenebilir (bkz. bölüm 4.8). Disfaji:ABILIFY MAINTENA dahil antipsikotik ilaç kullanımı özofagus dismotilitesi ve aspirasyon ile ilişkilendirilmiştir. Aspirasyon pnömonisi riski olan hastalarda ABILIFY MAINTENA ve diğerantipsikotik ilaçlar dikkatli kullanılmalıdır. Patolojik Kumar ve Diğer Dürtü Kontrol Bozuklukları:Aripiprazol reçete edilen hastalar arasında, daha önceden kumar oynama öykülerine sahip olup olmadıklarına bakılmaksızın, pazarlama sonrası raporlarda patolojik kumar oynamabildirilmiştir. Daha önceden patolojik kumar oynama öyküsüne sahip hastalar artmış risk altındaolabilirler ve daha dikkatli izlenmelidirler (bkz. bölüm 4.8). Pazarlama sonrası vaka raporlarında hastaların kumar oynama için yoğun arzu yaşantıladıkları ve aripiprazol kullanırken bu arzuyu kontrol edemedikleri öne sürülmüştür. Daha az bildirilendiğer kompulsif davranışlar; cinsel arzular, alışveriş, yemek yeme/ tıkınarak yeme ve diğerdürtüsel ya da kompulsif davranışlardır. Hastalar bu davranışları anormal olaraktanımlamadıklarından aripiprazol reçete eden hekimlerin hastalarına/hasta yakınlarına yenibaşlayan ya da yoğun olan, kumar oynama isteği, kompulsif cinsel dürtüler, kompulsif alışveriş,tıkınarak ya da kompulsif yemek yeme vb. kompulsif arzularla ilgili sorular sormaları önemlidir.Dürtü kontrol belirtilerinin altta yatan bozuklukla da ilişkili olabileceği göz önündebulundurulmalıdır. Hepsinde olmasa da bazı vakalarda, doz azaltımı ya da tedavi kesilmesisonrası dürtüsellikte azalma bildirilmiştir. Kompulsif davranışlar eğer fark edilmezlerse hastanınkendisine ya da başkalarına zarar vermesi ile sonuçlanabilir. Hastada bu tarz dürtüler farkedildiğinde doz azaltılması ya da tedavinin kesilmesi düşünülebilir (bkz. bölüm 4.8). Düşmeler:Aripiprazol somnolans, postural hipotansiyon, motor ve duyusal dengesizliğe neden olarak düşmelere neden olabilir. Daha yüksek risk altındaki hastaları tedavi ederken dikkatli olunmalıve daha düşük bir başlangıç dozu düşünülmelidir (örn., yaşlılar veya güçten düşmüş hastalar;bkz. bölüm 4.2). Metabolik değişiklikler:Atipik antipsikotik ilaçlar hiperglisemi/diabetes mellitus, dislipidemi ve kilo almayı içeren metabolik değişikliklerle ilişkilidir. Bu sınıftaki tüm ilaçların bazı metabolik değişiklikleroluşturdukları gösterilmekle birlikte her bir ilacın kendi özgün risk profili bulunmaktadır.Aşağıdaki metabolik verilerin aripiprazol oral formülasyonlarıyla tedavi edilen hastalardan eldeedilmiş olmasına rağmen bu bulgular ABILIFY MAINTENA alan hastalar içinde uygundur. Hiperglisemi ve diabetes mellitus:Atipik antipsikotiklerle tedavi edilen bazı hastalarda aşırı hiperglisemi gözlenmiş ve diyabetik ketoasidoz, hiperosmolar koma veya ölümle ilişkilendirilmiştir. Aripiprazol ile tedavi edilenhastalarda hiperglisemi raporları olmuştur. Atipik antipsikotik kullanımı ile glukozanormallikleri arasındaki ilişkinin değerlendirilmesi, şizofrenili hastalarda artmış diabetesmellitus riski olasılığı ve genel popülasyonda gittikçe artan diabetes mellitus sıklığı ilekarmaşıktır. Bu karmaşıklıklarla atipik antipsikotik kullanımı ile hiperglisemiye bağlı advers 7 / 31 reaksiyonlar arasındaki ilişki tam olarak anlaşılamamaktadır. Ancak, epidemiyolojik çalışmalar atipik antipsikotiklerle tedavi edilen hastalarda hiperglisemiye bağlı advers reaksiyon riskininarttığını göstermektedir. Aripiprazol bu çalışmalar yapıldığında pazarda bulunmadığındanaripiprazolün bu risk artışı ile ilişkili olup olmadığı bilinmemektedir. Atipik antipsikotiklerletedavi edilen hastalarda hiperglisemiye bağlı advers reaksiyonlara ait kesin risk tahminibulunmamaktadır. Atipik antipsikotik tedavisine başlanmış kesin tanılı diabetes mellitusu olanhastalar glukoz kontrolünde kötüleşme yönünden düzenli olarak izlenmelidir. Diabetes mellitusrisk faktörlerine sahip hastalarda (ör., obezite, ailede diyabet öyküsü) atipik antipsikotiklerletedaviye başlarken, tedavinin başlangıcında ve tedavi sırasında periyodik olarak açlık kan şekeritesti yapılmalıdır. Atipik antipsikotiklerle tedavi edilen her bir hasta polidipsi, poliüri, polifaji vezayıflama gibi hiperglisemi semptomları yönünden izlenmelidir. Atipik antipsikotiklerle tedavisırasında hiperglisemi semptomları gelişen hastalar açlık kan şekeri testi yaptırmalıdır. Bazıolgularda, atipik antipsikotikler kesildiğinde hiperglisemi çözülmüştür; ancak bazı hastalardaatipik antipsikotik kesilmesine rağmen antidiyabetik tedavinin sürdürülmesi gerekmiştir. Erişkin şizofreni hastalarıyla yürütülen kısa dönem, plasebo-kontrollü, randomize bir çalışmada, ABILIFY MAINTENA ile tedavi edilen hastalarda ortalama açlık kan şekeri değişimi +9,8mg/dL (N=88) bulunurken, plasebo grubunda bu değişim +0,7 mg/dL (N=59) olarak tespitedilmiştir. Tablo 2'de ABILIFY MAINTENA ile tedavi edilen, başlangıç açlık kan şekeridüzeyleri normal ve sınırda olan hastaların oranı ve bu hastaların açlık kan şekeri düzeylerindekideğişim görülmektedir.
52 haftalık açık etiketli bipolar I çalışmasında ABILIFY MAINTENA® tedavisi başlanan hastalardan %1,1'inin başlangıç açlık kan şekeri normal değerlerdeyken çalışma sonunda yüksekdeğerlere doğru kayma görülmüş, sınır açlık kan şekeri değeri ölçülen %9,8 hastanın da kanşekeri değerlerinde yüksek değerlere kayma gözlenmiştir. Birleştirilmiş analizde normal ya dasınırda açlık kan şekeri değerleri olan %2,9 hastada yüksek açlık kan şekeri değerlerine kaymagözlenmiştir. Dislipidemi:Atipik antipsikotiklerle tedavi edilen hastalarda lipidlerde istenmeyen değişiklikler gözlenmiştir. Tablo 4'de ABILIFY MAINTENA kullanan erişkin şizofreni hastalarının dahil edildiği bir kısa dönem plasebo kontrollü randomize çalışma sonucunda total kolesterol, açlık trigliseridleri, açlıkLDL kolesterolü ve HDL kolesterolünde değişiklik olan hasta oranları görülmektedir. 8 / 31
52 haftalık açık etiketli bipolar I çalışmasında ABILIFY MAINTENA® tedavisi başlanan hastalardan başlangıç açlık kolesterol düzeylerinde değişim olan hastaların %2,1'inde totalkolesterolde, %2,2'sinde LDL kolesterolde normal-yüksek değerlere ve %8,5'inde HDLbaşlangıç değerlerinden normal düşük düzeylere kayma gözlenmiştir. Normal başlangıçtrigliserit değeri olan hastaların %3,6'sında değerlerde yükseğe doğru kayma ve %0,0'ında çokyükseğe doğru kayma saptanmıştır. Birleştirilmiş analizde normal ya da sınırda açlık kantrigliserid değerleri olan hastaların %1,0'inde bu çalışmada çok yüksek açlık kan şekerideğerlerine kayma olmuştur. 9 / 31 Kilo alma:Şizofreni hastalarında atipik antipsikotik kullanımıyla kilo alımı ve eşlik eden hastalıklar, kötü yönetilen yaşam tarzı ve ciddi komplikasyonlar yaygın olarak gözlenmiştir. Oral aripiprazolreçete edilen hastalarda pazarlama sonrası kilo alımı raporlanmıştır. Genellikle diyabet geçmişi,tiroid bozuklukluğu veya hipofiz bezi adenomu gibi önemli risk faktörleri olan kişilerdegözlenmektedir. Klinik çalışmalarda aripiprazolün klinik olarak anlamlı kilo alımını indüklediğigösterilmemiştir (bkz. bölüm 4.8). Vücut ağırlığının klinik olarak izlenmesi önerilmektedir. Kısa süreli bir plasebo kontrollü çalışmada 12. haftada ortalama kilo değişimi ABILIFY MAINTENA ile tedavi edilen erişkin şizofreni hastalarında +3,5 kg (N=99), plasebo verilenhastalarda ise +0,8 kg (N=66) bulunmuştur. Tablo 3'de ABILIFY MAINTENA ile yapılanplasebo kontrollü, kısa süreli çalışmada vücut ağırlığında >%7 oranında artış olan erişkinşizofreni hastalarının yüzdesi görülmektedir.
52 haftalık açık etiketli bipolar I çalışmasında ABILIFY MAINTENA® tedavisi başlanan hastaların %1,8'i kilo artışı nedeniyle çalışmayı bırakmıştır. ABILIFY MAINTENA ile 52.haftanın sonunda başlangıçtan itibaren ortalama 1 kg artış görülmüştür. Bu çalışmada hastaların%21,4'ünde vücut ağırlığında >%7 oranında artış görülürken %15,4'ünde vücut ağırlığındakiartış <%7 olarak tespit edilmiştir. Ortostatik hipotansiyon:Aripiprazol, belki a1-adreneıjik reseptör antagonist etkisi nedeniyle ortostatik hipotansiyona neden olabilir. Erişkin şizofreni hastalarıyla yürütülen kısa dönem randomize plasebo kontrollüçalışmada ABILFY MAINTENA ile tedavi edilen hastaların 1/167'sinde (%0,6) advers olayolarak presenkop tanımlanırken, plasebo ile tedavi edilen hastaların 1/172'sinde (%0,6) ortostatikhipotansiyon ve senkop bildirilmiştir. Randomize sürdürüm çalışmasının stabilizasyon fazısırasında ABILIFY MAINTENA ile tedavi edilen erişkin şizofreni hastalarının 4/576'sında(%0,7) anormal ortostatik kan basıncını (1/576, %0,2), postural baş dönmesini (1/576, %0,2),presenkobu (1/576, %0,2) ve ortostatik hipotansiyonu (1/576, %0,2) da içeren ortostazla ilişkiliadvers olaylar görülmüştür. Kısa dönem plasebo kontrollü çalışmanın sonucunda her iki tedavi grubundaki hastalarda kan basıncında anlamlı ortostatik değişiklik (yatar durumdaki değerlerle ayakta durumdaki değerlerkarşılaştırıldığında kalp hızında >25'lik bir artışın eşlik ettiği sistolik kan basıncında >20mmHg'lık bir azalma olarak tanımlanan) saptanmamıştır. Erişkin şizofreni hastaları ile yapılanrandomize sürdürüm çalışmasının stabilizasyon fazında kan basıncındaki belirgin ortostatikdeğişiklik insidansı %0,2 (1/575) bulunmuştur. Lökopeni, nötropeni ve agranülositoz: Sınıf Etkisi:Klinik çalışmalarda ve pazarlama sonrası deneyimlerde oral aripiprazol dahil antipsikotik ajanlarla ilişkili, geçici lökopeni ve nötropeni bildirilmiştir. Ayrıca agranülositoz dabildirilmiştir. 3 Lökopeni/nötropeni için olası risk faktörleri önceden mevcut olan düşük lökosit sayısı ve ilaca bağlı lökopeni/nötropeni öyküsüdür. Klinik olarak önemli düşük lökosit sayısı veya ilaca bağlılökopeni/nötropeni öyküsü olan hastalarda tedavinin ilk birkaç ayı içerisinde sık olarak tam kansayımı yapılmalıdır. Böyle bir hastada, diğer nedensel faktörlerin olmadığı durumda lökositsayısında klinik olarak önemli azalmaya ait ilk bulguda ABILIFY MAINTENA'nın kesilmesidüşünülmelidir. Klinik olarak önemli nötropenili hastalar ateş veya enfeksiyonun diğer bulgularıyönünden izlenmeli ve böyle semptom ve bulgular ortaya çıkarsa vakit geçirmeden tedaviedilmelidir. Ciddi nötropenili (mutlak nötrofil sayısı <1000/mm3) hastalarda ABILIFYMAINTENA kesilir ve düzelinceye kadar lökosit sayıları takip edilir. Kognitif/Bilişsel ve motor bozukluk potansiyeli:Diğer antipsikotikler gibi ABILIFY MAINTENA, karar verme, düşünme veya motor becerileri olumsuz etkileyebilir. ABILIFY MAINTENA'nın kendilerini olumsuz etkilemediğinden eminolana kadar hastalar otomobil dâhil tehlikeli makineleri kullanmamaları konusundauyarılmalıdırlar. Vücut ısısı düzenlemesi:Antipsikotik ajanların vücudun kendi iç ısısını düşürme yeteneğini bozdukları düşünülmektedir. Vücudun kendi iç sıcaklığında yükselmeye katkıda bulunabilecek durumları (ör., yoğun egzersiz,aşırı sıcağa maruz kalma, antikolinerjik aktivitesi olan ilaçlarla birlikte alımı ya dadehidratasyona maruz kalma) yaşayacak hastalarda ABILIFY MAINTENA reçete edilirken özengösterilmelidir. Uyku apnesi sendromu:ABILIFY MAINTENA kullanan hastalarda uyku apnesi sendromu rapor edilmiştir. Eş zamanlı olarak santral sinir sistemi depresanı kullanan hastalar ile uyku apnesi öyküsü olan ya da uykuapnesi riski taşıyan (örn; aşırı kilolu/obezler veya erkekler) hastalarda ABILIFY MAINTENAkullanılırken dikkatli olunmalıdır. Bu tıbbi ürün her bir enjektabl toz içeren flakonunda 19,76 mg karboksimetil selüloz sodyum, 1,76 mg sodyum fosfat monobazik monohidrat ve pH ayarı için kafi miktarda sodyum hidroksitiçermektedir. Bu tıbbi ürün her dozunda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yaniaslında sodyum içermez. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriABILIFY MAINTENA ile etkileşim çalışmaları yapılmamıştır. Aşağıdaki bilgiler oral aripiprazol ile yapılan çalışmalarda gözlenen bilgilerdir. Alfal-adrenerjik reseptör antagonist etkisi nedeniyle, aripiprazol antihipertansif ilaçların etkisini arttırma potansiyeli taşır. Aripiprazolün MSS (Merkezi Sinir Sistemine) primer etkilerindendolayı, aripiprazolün alkol veya sedasyon gibi advers reaksiyon ile örtüşen diğer MSS ilaçları ilekombine uygulamasında dikkat edilmesi gerekir (bkz. bölüm 4.8). Eğer aripiprazol, QT uzamasıveya elektrolit dengesizliğine sebep olan ilaçlarla birlikte uygulanacaksa dikkat edilmesi gerekir. Başka ilaçların aripiprazol üzerindeki etkisi: Aripiprazol, CYP2D6 ve CYP3A4 enzimleri ile birçok yoldan metabolize olur. Kinidin ve diğer güçlü CYP2D6 inhibitörleriSağlıklı gönüllülerde oral aripiprazol klinik denemelerinde, CYP2D6 güçlü inhibitörü (kinidin) Cmaks'ı değiştirmeksizin aripiprazolün EAA'nı, %107 artırdı. Aktif metabolit dehidro- 4aripiprazolün EAA ve Cmaks'ı, sırasıyla %32 ve %47 olarak düştü. Fluoksetin ve paroksetin gibiCYP2D6'nın diğer güçlü inhibitörleri ile benzer etkiler beklendiğinden, benzer doz azaltılmasıuygulanmalıdır (bkz. bölüm 4.2). Ketokonazol ve diğer güçlü CYP3A4 inhibitörleriSağlıklı gönüllülerde oral aripiprazol klinik denemelerinde, CYP3A4 güçlü inhibitörü (ketokonazol) aripiprazolün EAA'nı ve Cmaks'ını sırasıyla %63 ve %37 olarak arttırdı. Aktifmetabolit dehidro-aripiprazolün EAA ve Cmaks'ı, sırasıyla %77 ve %43 olarak arttırdı. CYP2D6yavaş metabolizatörler de, hızlı metabolizatörlerle kıyaslandığında CYP3A4 güçlü inhibitörleriile birlikte kullanımı yüksek aripiprazol plazma konsantrasyonu ile sonuçlanır (bkz. bölüm 4.2).Ketokonazol veya diğer potent CYP3A4 inhibitörleri ile aripiprazol kullanımında potansiyelyararlar-potansiyel risklere ağır basmalıdır. Diğer güçlü CYP3A4 inhibitörleriyle, itrakonazol veHIV proteaz inhibitörleri gibi, kullanımda da benzer etkiler ve benzer doz azaltılması beklenir(bkz. bölüm 4.2). CYP2D6 veya CYP3A4 inhibitörleri kesilecekse, aripiprazol dozu bu ilçalarlaek tedaviye başlanmadan önceki doza çıkarılmalıdır. Zayıf CYP3A4 (ör., diltiazem) veyaCYP2D6 (ör., essitalopram) inhibitörleri ile birlikte kullanımında, aripiprazol plazmakonsantrasyonunda az bir artış beklenir. Karbamazepin ve diğer CYP3A4 indükleyicilerOral aripiprazolün (30 mg) yalnız uygulamasına kıyasla karbamazepin gibi güçlü bir CYP3A4 indükleyicisiyle kullanımı aripiprazol Cmaks ve EAA geometrik ortalamalarını sırasıyla %68 ve%73 azaltır. Karbamazepin uygulamasından sonra dehidro-aripiprazol Cmaks ve EAA geometrikortalamaları oral aripiprazolün yalnız kullanımına kıyasla sırasıyla %69 ve %71 azalır. ABILIFYMAINTENA'nın diğer CYP3A4 indükleyiciler (rifampisin, rifabutin, fenitoin, fenobarbital,primidon, efavirenz, nevirapin ve St. John's Wort gibi) ile birlikte kullanımında benzer etkilerbeklenir. Aripiprazol kan değerlerinin düşmesi ve etki seviyelerinin altında olması sebebiyleCYP3A4 indükleyiciler ile birlikte ABILIFY MAINTENA kullanımından sakınılmalıdır. Valporat ve lityumValporat veya lityum, aripiprazol ile birlikte kullanıldığında aripiprazol konsantrasyonlarında belirgin bir değişiklik gözlenmez, bu sebeple valproat veya lityumun, ABILIFY MAINTENA ilebirlikte kullanılması durumunda doz ayarlaması yapmak gerekmez. Aripiprazolün başka ilaçlar üzerindeki etkisi:Klinik çalışmalarda 10-30 mg/gün oral dozundaki aripiprazolün, CYP2D6 substratları (dekstrometorfan/3-metoksimorfinan oranı), CYP2C9 (varfarin), CYP2C19 (omeprazol) veCYP3A4 (dekstrometorfan) metabolizması üzerinde bir etkisi yoktur. İlaveten aripiprazol vedehidro-aripiprazol, in-vitro CYP1A2 metabolizmasını değiştirme potansiyeli göstermez. Busebeple, ABILIFY MAINTENA'nın bu enzimlerin aracılık ettiği herhangi bir ilaç etkileşiminderol alması beklenmez. Aripiprazol, lamotrijin, dekstrometorfan, varfarin, omeprazol, essitalopram veya venlafaksin ile birlikte kullanıldığında, ilaç konsantrasyonlarında önemli bir değişiklik yoktur. Bu sebeple,ABILIFY MAINTENA ile birlikte kullanımda doz ayarlaması yapılması gerekmez. Aripiprazolün santral sinir sistemi depresan etkileri göz önüne alındığında, ABILIFY MAINTENA nın diğer santral-etkili ilaçlar veya alkol ile kombine kullanılışı sırasında dikkatliolunması gerekir. 5 Alfa adrenerjik antagonizma özelliği nedeniyle, aripiprazolün bazı antihipertansif ajanların etkisini artırma potansiyeli vardır. Eğer aripiprazol QT uzaması yaptığı bilinen veya elektrolit dengesizliği yapan ilaçlarla birlikte kullanılırsa dikkatli olunmalıdır. Serotonin sendromu: Aripiprazol alan hastalarda serotonin sendromu vakaları raporlanmıştır. Bu durumda oluşabilecek olası belirti ve bulgular özellikle SSRI/SNRI grubu ilaçlarla veyaaripiprazol konsantrasyonunu artıran ilaçlarla birlikte kullanımda gözlenmektedirler. 4.6 Gebelik ve laktasyonGenel tavsiye:Gebelik Kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Hastalar aripiprazol tedavisi sırasında hamile kalırlarsa ya da hamile kalmayı planlıyorlarsa doktorlarına haber vermelidirler. Gebelik dönemiAripiprazol ile gebe kadınlarda yeterli ve iyi kontrollü klinik çalışmalar yapılmamıştır. Bazı konjenital anomaliler tanımlanmışsa da aripiprazolle direkt nedensel ilişki kurulamamıştır.Hayvan çalışmaları potansiyel gelişimsel toksisiteyi dışlayamamıştır. Reçete edilirken ABILIFYMAINTENA'nın uzun etkili özellikleri göz önünde bulundurulmalıdır. Gebeliğin üçüncü trimesterinde antipsikotik ajanlara (ABILIFY MAINTENA dahil) maruz kalmış yeni doğanlar doğumdan sonra ekstrapiramidal ve/veya kesilme sendromu semptomlarıyönünden risk altındadır. Bu semptomlar; ajitasyon, hipertoni, hipotoni, tremor, somnolans,respiratuar distres veya beslenme bozukluklarıdır. Sonuç olarak yeni doğanlar dikkatlicemonitorize edilmelidir. Hayvanlar üzerinde yapılan çalışmalarda, gebelik / ve-veya / embriyonal / fetal gelişim / ve-veya / doğum / ve-veya / doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz; bölüm5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. İnsanlarda yetersiz güvenlilik verileri ve hayvan üreme çalışmalarında ortaya çıkan sonuçlar nedeniyle ABILIFY MAINTENA gebelikte yalnızca potansiyel yararı fetüs üzerine taşıdığıpotansiyel riske ağır basıyorsa kullanılmalıdır. Laktasyon dönemiAripiprazol insan sütüne geçmektedir. İlacın anne için önemi veya emzirmenin bebek için önemi dikkate alınarak emzirmenin veya ilacın kesilmesi yönünde bir karar verilmelidir. Üreme yeteneği / FertiliteÜreme toksisitesi çalışmaları verilerine göre aripiprazol fertiliteyi azaltmamıştır. 4.7 Araç ve makine kullanımı üzerindeki etkilerAripiprazol santral sinir sistemi ve görme yetisi üzerine etkileri nedeniyle araç kullanma yetisi üzerinde minör ya da orta düzeyde bozulmalara neden olabilir. Bu etkiler sedasyon, sersemlik,senkop, görme bulanıklığı ve çift görmeyi içerir. Bu nedenle hastalar bu ilaca hassasiyetlerianlaşılmadan araç kullanmamaları yönünde uyarılmalıdır. 6 4.8 İstenmeyen etkilerİki tane çift-kör, kontrollü klinik çalışmada erişkin şizofreni hastalarındaki ABILIFY MAINTENA ile ilgili en sık gözlenen advers ilaç reaksiyonu (>%5), kilo artışı (%9,0), akatizi(%7,9), uykusuzluk (%5,8) ve enjeksiyon yerinde ağrıydı (%5,1). Bipolar I bozukluğu bulunan erişkin hastalarda yürütülen iki tane çift-kör, plasebo kontrollü, randomize (idame) çalışmada ABILIFY MAINTENA® ile ilgili en sık gözlenen advers ilaçreaksiyonu >%5'dir ve plasebodan fazladır, kilo artışı (%22,7) ve akatizi (%20,5). Advers Reaksiyon TablosuAripiprazol tedavisi sırasında gözlenen istenmeyen etkiler aşağıda listelenmiştir. Tablo klinik çalışmalar ve pazarlama sonrası kullanım sırasında raporlanan istenmeyen etkileredayanmaktadır. Tüm istenmeyen olaylar sistem, organ sınıfı ve sıklık durumuna göre listelenmiştir; Çok yaygın (> 1/10); yaygın (> 1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahminedilemiyor). Her sıklık grubunda istenmeyen etkiler daha ciddi istenmeyen etkilerle başlanıpistenmeyen olayın ciddiyeti azalacak şekilde devam edilmiştir. Pazarlama sonrası raporlanan istenmeyen etkilerin sıklığı spontan raporlama ile gerçekleştiği için mümkün olamamaktadır. Bu nedenle pazarlama sonrası raporlanan istenmeyen etkilerin sıklığıbilinmiyor olarak sınıflanmaktadır.
14 / 31
15 / 31
16 / 31
Enjeksiyon bölgesi reaksiyonları Şizofreni hastalarında iki denemenin çift-kör, kontrollü evreleri süresince, enjeksiyon bölgesi reaksiyonları gözlendi; görülenler genelde hafif-orta şiddette idi ve zamanla düzeldi. Enjeksiyonbölgesinde ağrı (insidans %5,1) enjeksiyondan sonra ortanca (medyan) 2 günde başladı ve 4 günsürdü. ABILIFY MAINTENA'nın gluteal ve deltoid uygulama sonrası biyoyararlanımını karşılaştıran açık etiketli bir çalışmada deltoid uygulamada enjeksiyon bölgesi reaksiyonları glutealuygulamaya göre hafifçe daha fazla görülmüştür. ABILIFY MAINTENA'nın gluteal bölgeyeuygulandığı çalışmalarla karşılaştırıldığında deltoid bölge uygulamasında tekrarlayan enjeksiyonbölgesi ağrısı daha fazla tespit edilmiştir. Lökopeni Nötropeni, ABILIFY MAINTENA ile klinik programda bildirilen ve genellikle ilk enjeksiyondan sonraki 16.gün civarında başladı ve ortalama 18 gün sürdü. Ekstrapiramidal Semptomlar (EPS) Stabil şizofreni hastalarında yapılan denemelerde, ABILIFY MAINTENA (%18,4) oral aripiprazol (%11,7) tedavisine kıyasla daha yüksek EPS semptom sıklığı ile ilişkiliydi. Akatizien sık (%8,2) gözlenen semptomdu ve tipik olarak ilk enjeksiyondan sonra 10. gün civarındabaşladı ve ortanca 56 gün sürdü. Akatizili hastalar tipik olarak antikolinerjik tedavi aldılar. Aldıkları tedavi esas olarak benzatropin mesilat ve triheksifenidil idi. Propranolol ve benzodiazepinler (klonazepam vediazepam) gibi daha az kullanılan maddeler akatizi kontrolü için uygulandı. 18 / 31 Parkinsonizm olayları sıklık bakımından takip etti (ABILIFY MAINTENA %6,9; oral aripiprazol %4,15 10-30 mg tablet grupları ve plasebo %3,0). Distoni Sınıf etkisi: Distoni semptomları, uzamış anormal kas grubu kasılmaları, duyarlı bireylerde tedavinin ilk birkaç gününde görülebilir. Distonik semptomlar arasında boyun kaslarında spazm,boğazda sıkışmaya doğru ilerleme, yutma güçlüğü, nefes alma güçlüğü, dilin öne doğru çıkmasısayılabilir. Bu semptomlar düşük dozlarda görülebilirken, birinci jenerasyon antipsikotik tıbbiürünlerin yüksek dozlarında daha şiddetli ve daha kuvvetli ve daha sık görülürler. Akut distoniriskinde artış erkeklerde ve daha genç yaş gruplarında görülür. Kilo Şizofreni hastalarında denemenin 38-haftalık çift-kör, aktif-kontrollü evresi süresince başlangıca göre %7 ve üzerinde kilo artış insidansı ABILIFY MAINTENA grubu için %9,5 ve oralaripiprazol tablet (10-30 mg) grubu için %11,7 idi. Başlangıca göre %7 ve üzerinde kilo kaybıinsidansı son vizitte ABILIFY MAINTENA için %10,2 ve oral aripiprazol tablet (10-30 mg) için%4,5 idi. Şizofreni hastalarında 52-haftalık çift-kör, plasebo kontrollü evre süresince başlangıca göre %7 ve üzerinde kilo artış insidansı son vizitte ABILIFY MAINTENA grubu için %6,4 ve plasebogrubu için %5,2 idi. Başlangıca göre %7 ve üzerinde kilo kaybı insidansı son vizitte ABILIFYMAINTENA için %6,4 ve plasebo için %6,7 idi. Çift-kör tedavi süresince, başlangıca göre sonvizitte ortalama kilo değişimi ABILIFY MAINTENA için -0,2 kg ve plasebo için -0,4 kg idi (p=0,812). Prolaktin Onaylı endikasyon(lar)da yürütülen klinik çalışmalarda ve pazarlama sonrasında tedavi başlangıcı ile kıyaslandığında aripiprazol kullananlarda serum prolaktin düzeylerinde artış veazalmalar (bkz. bölüm 5.1) gözlendi. Patolojik Kumar ve Diğer Dürtü Kontrol Bozuklukları Aripiprazol ile tedavi edilen hastalarda patolojik kumar oynama, hiperseksüalite, kompulsif alışveriş ve aşırı veya kompulsif yemek yeme meydana gelebilir (bkz. bölüm 4.4). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonların raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜF'AM)'ne bildirmeleri gerekmektedir (www.titck.gov.trposta:[email protected]; tel:04.9 Doz aşımı ve tedavisiABILIFY MAINTENA'yla yürütülen klinik çalışmalarda advers olaylarla bağlantılı hiçbir doz aşımı bildirilmemiştir. Bu tıbbi ürünün kazara damar içine enjekte edilmemesi konusunda dikkatedilmesi gerekmektedir. Kazara bir doz aşımı/ damar içi enjeksiyon durumu olmuşsa ve/veyaböyle bir durumla ilgili şüphe mevcut ise hasta yakın gözlem altında tutulmalıdır. Herhangi birciddi tıbbi bulgu ya da belirti ortaya çıkarsa kesintisiz elektrokardiyografik izlemi de içerenmonitorizasyon başlatılmalıdır. Medikal gözetim ve monitorizasyon hasta iyileşene kadar devametmelidir. 19 / 31 Doz yüklemesi simülasyonunda öngörülen medyan aripiprazol konsantrasyonunun 4500 ng/ml'ye ya da üst terapötik sınırın 9 katına çıktığı gözlenmiştir. Olası bir doz yüklemesidurumunda aripiprazol konsantrasyonunun yaklaşık 3 gün içinde hızlıca terapötik pencerenin üstsınırına düşeceği öngörülmektedir. 7. günde medyan aripiprazol konsantrasyonları daha dadüşerek doz yüklemesinin yapılmadığı IM depo doz uygulaması sonrası ulaşılan düzeyeinmektedir. Doz aşımı parenteral ürünlerle oral ürünlere göre daha az ortaya çıkmaktadır. Oralaripiprazol ile doz aşımı referans bilgisi aşağıda sunulmuştur. Belirti ve bulgular Klinik çalışmalar ve pazarlama sonrası deneyimde erişkinlerde kazara ya da bilerek alınan en yüksek akut doz tahminen 1260 mg kadar (önerilen günlük aripiprazol dozunun 41 katı) olmuşve ölüm gözlenmemiştir. Gözlemlenen önemli tıbbi belirti ve bulgular; letarji, artmış kan basıncı,uyku hali, taşikardi, bulantı, kusma ve ishaldir. Ek olarak çocuklarda kazara gerçekleşen yüksekdoz alımı (195 mg'a kadar) ölümle sonuçlanmamıştır. Bildirilen önemli tıbbi belirti ve bulgularsomnolans, geçici bilinç kaybı ve ekstrapiramidal belirtileridir. Doz aşımının tedavisi: Doz aşımı tedavisi destekleyici tedavi üzerinde yoğunlaşmalıdır; havayolu, oksijenasyon ve ventilasyon sağlanmalı ve belirtiler tedavi edilmelidir. Çoklu ilaç alımı ihtimali göz önünde bulundurulmalıdır. Dolayısıyla kardiyovasküler izleme hemen başlatılmalı ve muhtemel aritmileri tespit etmek için kesintisiz elektrokardiyografikmonitorizasyon yapılmalıdır. Kesinleşmiş ya da şüpheli herhangi bir aripiprazol doz aşımısonrası, yakın tıbbi gözetim ve izleme hasta iyileşene kadar devam etmelidir. Hemodiyaliz Her ne kadar aripiprazol doz aşımının tedavisinde hemodiyalizin etkisi hakkında hiçbir bilgi yoksa da, aripiprazolün plazma proteinlerine yüksek oranda bağlanması nedeniyle hemodiyalizinyarar sağlaması olası değildir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Psikoleptikler, diğer antipsikotikler, ATC kodu: N05AX12 Etki mekanizması:Aripiprazolün şizofreni ve bipolar I bozukluğu tedavisindeki etki mekanizması bilinmemektedir. Bununla birlikte etki, dopamin D2 ve serotonin 5-HTia reseptörler üzerindeki parsiyel agonist aktivite ve 5-HT2a reseptörler üzerindeki antagonist aktivitenin kombinasyonuna bağlı olabilir.D2 , 5-HTIA VE 5-HT2A RESEPTÖRLER DıŞıNDAKI RESEPTÖRLERE ETKILERI ARIPIPRAZOLÜN DIĞER ADVERSREAKSIYONLARıNıN BAZıLARıNı AÇıKLAYABILIR (ÖRNEĞIN, ARIPIPRAZOL ILE GÖZLENEN ORTOSTATIK HIPOTANSIYONALFAı ADRENERJIK RESEPTÖRLER ÜZERINDEKI ANTAGONIST AKTIVITESI ILE AÇıKLANABILIR).Farmakodinamik etkiler:Aripiprazole dopamin D2 ve D3, serotonin 5-HTia ve 5-HT2a reseptörlerine yüksek afinite (Ki değerleri sırasıyla 0,34 nM, 0,8 nM, 1,7 nM, ve 3,4 nM), dopamin D4, serotonin 5-HT2c ve 5-HT7, alfaı-adrenerjik ve histamin Hı reseptörlere orta dereceli afinite (Ki değerleri sırasıyla 44nM, 15 nM, 39 nM, 57 nM ve 61 nM) ve serotonin reuptake bölgesine orta dereceli afinite (Ki= 20 / 31 98 nM) gösterir. Aripiprazol kolinerjik muskarinik reseptörler üzerine fark edilebilir bir afiniteye sahip değildir (IC50>1000 nM). Aripiprazol dopamin D2 ve serotonin 5-HTia reseptörler üzerinebir parsiyel agonist olarak, serotonin 5-HT2a reseptörü üzerine de bir antagonist olarak etki eder(örneğin; aripiprazolle gözlenen ortostatik hipotansiyon, adrenerjik alfaı reseptörleri üzerindeantagonist aktivitesi ile açıklanabilir.). Alkol Etanol ile birlikte oral aripiprazol ve plasebo ile birlikte oral aripiprazol alan sağlıklı bireylerde uyarı yanıt veya kaba motor beceri performansında anlamlı bir fark yoktu. Çoğu psikoaktif ilaçtaolduğu gibi, hastaların ABILIFY MAINTENA almakta iken alkol kullanmaktan sakınmalarıtavsiye edilmelidir. Klinik Çalışma Bilgisi ŞizofreniABILIFY MAINTENA'nın şizofreni tedavisindeki etkililiğini çeşitli klinik çalışmalarda ortaya konmuştur: Çalışma 1: Akut olarak relaps olmuş hastalarda kısa dönem (12-haftalık), randomize, çiftkör, plasebo kontrollü çalışma Çalışma 2: Erişkin hastalarda uzun dönem, randomize, çift kör, plasebo kontrollü,sürdürüm tedavisi çalışması Kısa dönem etkililikAkut olarak relaps olmuş hastalarda kısa dönem (12-haftalık), randomize, çift kör, plasebo kontrollü çalışmada, psikiyatrik belirti ve bulguları değerlendirmek amacıyla kullanılan birincilölçüm aracı Pozitif ve Negatif Sendrom Ölçeğidir (PNSÖ). PNSÖ her maddede 1'den 7'ye kadarpuanlamayla şizofreninin pozitif belirtilerini (7 madde), negatif belirtilerini (7 madde) ve genelpsikopatolojiyi (16 madde) değerlendiren 30 maddelik bir ölçektir. PNSÖ toplam skorları 30'la210 arsında değişir. Bu çalışmadaki birincil sonlanım noktası başlangıçtan 10. haftaya kadarPNSÖ total skorlarındaki değişim olarak kabul edilmiştir. Bu kısa dönem çalışmaya dahil edilme kriterleri; -DSM-IV-TR tanı kriterlerine göre şizofreni tanısı konmuş erişkin hastalar. Buna ek olarak PNSÖ total skorunun >80 ve kavramsal disorganizasyon, şüphecilik, halüsinasyon ve tuhafdüşünce içeriği gibi spesifik PNSÖ maddelerinin her birinde <4'lük bir skor olması şeklindetanımlanan akut bir psikotik atağı olan hastalar. İkincil sonlanım ölçütü Klinik Global İzlenim-Şiddet (KGİ-Ş) başlangıçtan 10. haftaya kadar olan değişimdi. KGİ-Ş, şizofreni hastalarının tedavisinde değerlendirmeyi yapan kişinin toplamklinik deneyimine dayalı olarak mental hastalığın şiddetini 1 (normal) ile 7 (en uç noktada hasta)puan arasında bir ölçekte derecelendirir. Çalışma başlangıcında çalışmaya dahil edilen hastalarınortalama PNSÖ toplam skoru 103 (82-144 arası) ve KGİ-Ş skoru 5,2'ydi (oldukça hasta). ABILIFY MAINTENA'nın (n=167) etkililik açısından plaseboyla (n=172) karşılaştırıldığı bu 12 haftalık çalışmada (n=339) hastalara 0, 28, ve 56. günlerde 400 mg ABILIFY MAINTENA yada plasebo verilmiştir. Tolerabiliteye göre ABİLİFY MAİNTENA dozunun bir kerelik olmaküzere 300 mg'a düşülmesine izin verilmiştir. Çalışma sonunda 10. haftada ABILIFY MAINTENA'nın PNSÖ skorlarını düşürmede plaseboya göre daha etkin olduğu görülmüştür. 21 / 31 Şizofreni Kısa Dönem Çalışması
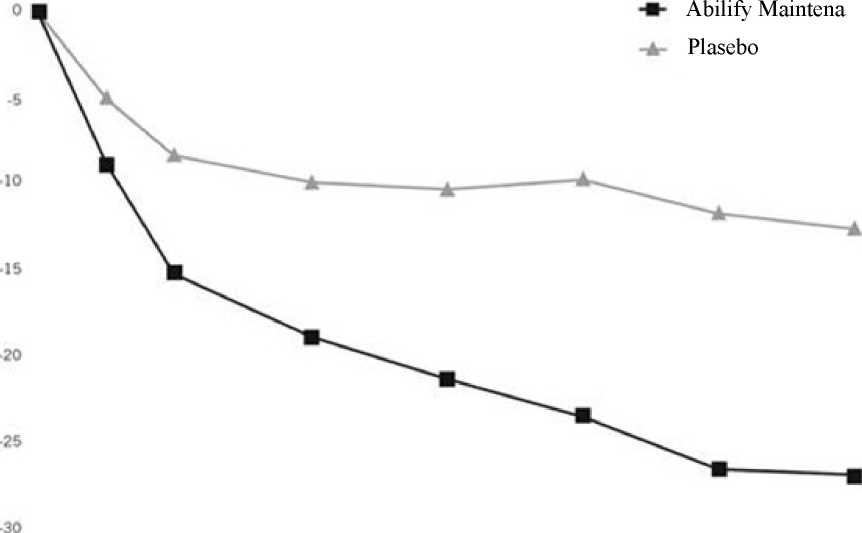
ABILIFY MAINTENA ile çalışma başlangıcından 10. hafta sonuna kadar ortalama KGİ-Ş skorlarında da anlamlı azalma görülmüştür. Uzun Dönem Etkililik:ABILIFY MAINTENA'nın şizofreni hastalarının idame tedavisindeki etkililiği, iki randomize, çift kör, uzun süreli çalışmada belirlendi. Temel çalışma, idame tedavisi olarak günde bir kez 10-30 mg oral aripiprazol tabletlere kıyasla aylık enjeksiyonlar halinde uygulanan bu tıbbi ürünün yetişkin şizofreni hastalarında etkililiğini,güvenliliğini ve tolere edilebilirliğini belirlemek üzere tasarlanmış 38 haftalık, randomize, çiftkör, aktif kontrollü bir çalışmadır. Bu deneme, bir tarama aşaması ve 3 tedavi aşamasındanoluşuyordu: Dönüşüm Aşaması, Oral Stabilizasyon Aşaması ve Çift-kör, Aktif Kontrollü Aşama. 22 / 31 38 haftalık Çift Kör, Aktif Kontrollü Faz için uygun altı yüz altmış iki hasta, rastgele 2:2:1 oranında çift kör tedaviye 3 tedavi grubundan birine atandı: 1) ABILIFY MAINTENA 2) oralaripiprazol 10-30 mg stabilizasyon dozu veya 3) aripiprazol Uzun Etkili Enjekte Edilebilir 50mg/25 mg. Aripiprazol Uzun Etkili Enjekte Edilebilir 50 mg/25 mg dozu, aşağı olmayan tasarımiçin test duyarlılığını test etmek için düşük doz aripiprazol olarak dahil edilmiştir. Çift-kör, Aktif Kontrollü Fazın 26. haftasının sonuna kadar nüks yaşayan hastaların tahmini oranı olan birincil etkililik son noktası analizinin sonuçları, ABILIFY MAINTENA 400 mg/300 mg'ınoral aripiprazol 10-30 mg tabletlerden daha düşük olmadığını göstermiştir. 26. haftanın sonunda tahmini nüks oranı, ABILIFY MAINTENA için %7,12 ve 10-30 mg oral aripiprazol tabletleri için %7,76, yani %-0,64'lük bir farktır. 26. haftanın sonuna kadar yaklaşan relaps yaşayan hastaların tahmini oranındaki fark için %95 GA (-5.26, 3.99), önceden tanımlanmış aşağı olmama marjını, yani %11,5'i hariç tuttu. Bunedenle, ABILIFY MAINTENA, 10-30 mg aripiprazol oral tabletlerinden aşağı değildir. ABILIFY MAINTENA için 26. haftanın sonunda yaklaşan relaps yaşayan hastaların tahmini oranı %7,12 idi ve bu, aripiprazol Uzun Etkili Enjekte Edilebilir 50 mg/25 mg'dan istatistikselolarak anlamlı derecede düşüktü (%21,80; p = 0.0006). Böylece, Abilify Maintena'nın aripiprazolUzun Etkili Enjekte Edilebilir 50 mg/25 mg'a üstünlüğü belirlendi ve deneme tasarımınıngeçerliliği doğrulandı. 38 haftalık, çift-kör, aktif kontrollü ABILIFY MAINTENA aşaması, oral aripiprazol 10-30 mg ve aripiprazol Uzun Etkili Enjekte Edilebilir 50 mg/25 mg sırasında randomizasyondan yaklaşannükse kadar geçen sürenin Kaplan-Meier eğrileri: Şekil 2'de gösterilmiştir. Şekil 2 Psikotik Semptomların Alevlenmesine / Yaklaşan Nüksetmeye Kadar Geçen Süre İçin Kaplan-Meier Ürün Sınır Grafiği
ı.o 0.80.6 0.4 0.20.0İMD 400/ 300 mgARIP 10-30 mgİMD 50/25 mgAyrıca, ABILIFY MAINTENA'nın 10-30 mg oral aripiprazol ile karşılaştırıldığında aşağı olmadığı, Pozitif ve Negatif Sendrom Ölçeği puanının (PANSS) analizinin sonuçlarıyladesteklenir. 23 / 31
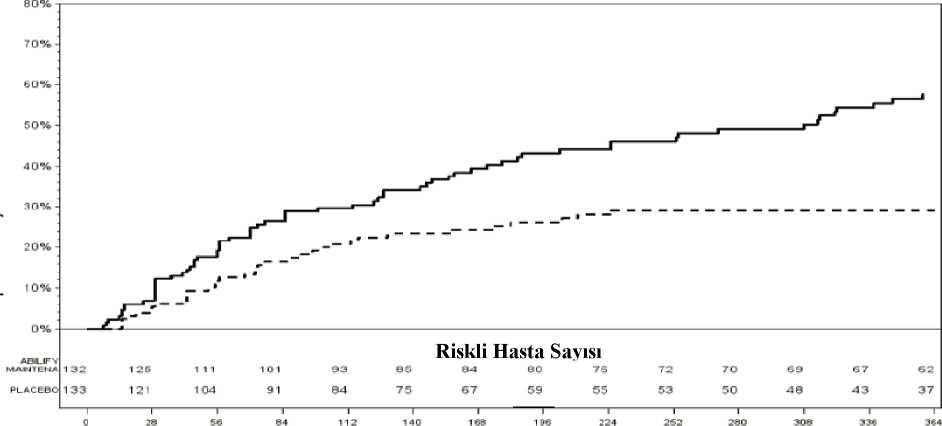
İkinci çalışma, mevcut şizofreni tanısı olan ABD'li yetişkin hastalarda yürütülen 52 haftalık, randomize, geri çekmeli, çift kör bir denemeydi. Bu çalışma, bir tarama aşaması ve 4 tedaviaşamasından oluşuyordu: Dönüşüm, Oral Stabilizasyon, ABILIFY MAINTENA Stabilizasyonuve çift-kör plasebo kontrollü. Oral Stabilizasyon Aşamasında oral stabilizasyon şartını yerinegetiren hastalar, tek kör bir şekilde ABILIFY MAINTENA'yı almak üzere atanmış ve minimum12 hafta ve maksimum 36 haftalık bir ABILIFY MAINTENA Stabilizasyon Aşamasınabaşlamıştır. Çift-kör, plasebo kontrollü faz için uygun hastalar, sırasıyla ABILIFY MAINTENAveya plasebo ile çift kör tedaviye 2:1 oranında rastgele atanmıştır. Nihai etkililik analizi, 403 randomize hastayı ve psikotik semptomların/yaklaşan nüksetme olaylarının 80 alevlenmesini içermiştir. Plasebo grubunda hastaların %39,6'sı yaklaşan relapsailerlerken, ABILIFY MAINTENA grubunda hastaların %10'unda yaklaşan relaps meydanageldi; bu nedenle, plasebo grubundaki hastaların, yaklaşan nüksetme yaşama riski 5,03 kat dahafazlaydı. ProlaktinTüm klinik çalışmalarda aripiprazolün tüm dozları için prolaktin seviyeleri değerlendirilmiştir (n= 28.242). Aripiprazol ile tedavi edilen hastalarda; hiperprolaktinemi veya yüksek serumprolakttin prevelansı (%0,3), plasebo (%0,2) ile benzerdir. Aripiprazol alan hastalar içinbaşlangıca göre medyan zamanı 42 gündür ve medyan süresi 34 gündür. Aripiprazol tedavisi alan hastalarda hiperprolaktinemi veya azalmış serum prolaktin prevelansı %0,4 iken plasebo tedavisindeki hastalarda %0,02'dir. Aripiprazol alan hastalar için başlangıcagöre medyan zamanı 30 gündür ve medyan süresi 194 gündür. 38-haftalık çalışmanın çift-kör aktif-kontrol fazında başlangıçtan son kontrole kadar, ABILIFY MAINTENA (-0,33 ng/mL) için prolaktin seviyelerinde oluşan ortalama azalma, 10-30 mg (0,79ng/mL; p<0,01) oral aripiprazol tabletlerindeki ortalama artışla karşılaştırılmıştır. ABILIFY MAINTENA alan hastalarda, prolaktin seviyelerinin insidansı, her değerlendirmede normal aralığın üst limiti (ULN) >1 olduğu aralıkta %5,4 iken; 10-30 mg oral aripiprazoltabletleri kullanan hastalarda bu değer %3,5'tir. Her tedavi grubunda erkek hastalar, genelliklekadın hastalara göre daha yüksek insidansa sahiptirler. 24 / 31 52-haftalık çalışmanın çift-kör, plasebo kontrollü fazında, başlangıçtan son kontrole kadar, ABILIFY MAINTENA (-0,38 ng/mL) için prolaktin seviyelerinde oluşan ortalama azalma,plasebodaki (1,67 ng/mL) prolaktin seviyelerindeki ortalama artış ile karşılaştırmıştır.ABILIFY MAINTENA alan hastalarda, prolaktin seviyelerinin insidansı, normal aralığın üstlimiti (ULN) >1 olduğu aralıkta %1,9 iken, plasebo hastalarında bu değer %7,1 idi. Bipolar I Bozukluk-Idame MonoterapiABILIFY MAINTENA®'nın bipolar I bozukluk idame tedavisindeki etkililiği 52 haftalık, çift-kör, plasebo kontrollü, randomize çalışmada değerlendirilmiştir. Çalışmaya dahil edilen hastalar bipolar bozukluk I için DSM-IV tanı kriterlerini karşılayan, çalışma başlangıcında manikdönemde olan ve daha önce hastaneye yatış ve/veya bir duygu durum düzenleyici ile tedavive/veya bir antipsikotik ile tedavi gerektiren manik belirtilerin görüldüğü en az bir manik ya dakarışık epizod geçirmiş erişkin hastalar dahil edilmiştir. Çalışma süresince klinik değerlendirmeler: Young Mani Derecelendirme Ölçeği (YMDÖ): manik semptomların şiddetini ölçmekiçin geliştirilmiş, 0 puanın hastanın semptomsuz olduğunu, 60 puanın en şiddetlisemptomlu hastalığı tanımladığı, klinisyen tarafından doldurulan, 11 maddelik ölçek Montgomery-Asberg Depresyon Derecelendirme Ölçeği (MADDÖ): depresifsemptomların şiddetini ölçmek için geliştirilmiş, 1 puanın hastanın semptomsuzolduğunu, 60 puanın en şiddetli semptomlu hastalığı tanımladığı, klinisyen tarafındandoldurulan, 10 maddelik ölçek Klinik Global İzlenim Hastalık Şiddeti Bipolar Versiyon (KGİ-BP-Ş): Mani,depresyon ve genel bipolar hastalık şiddetini 1'den (hasta değil) 7'ye (çok şiddetlihasta) kadar skorlamayla değerlendiren ölçek Çalışmaya dahil olanlar: Bipolar I bozukluk için aripiprazolden harici tedavi altında olan hastaların dahil edildiği4-6 haftalık, açık etiketli oral tedavi değişim fazı. Bu faza toplam 466 hasta dahiledilmiştir. 2-8 haftalık, açık etiketli, oral aripiprazol stabilizasyon fazı (hedef günde tek doz 15 ila30 mg). Bu faza toplam 632 hasta dahil edilmiştir. Hastalar 18-65 yaş arası (ortalamayaş 40,7) %60'ı kadın olan hastalardı. Ortalama başlangıç skorları: YMDÖ total, 16,9;MADDÖ total, 5,7 ve KGİ-BP-Ş genel 3,4 (hafif-orta düzeyde hasta) olarak tespitedilmiştir. Diğer çalışma fazına geçilmeden önce klinik stabilizasyon kriterlerininkarşılanması gerekiyordu. Stabilizasyon 2 haftada bir yapılan vizitede aşağıdakilerintümünün olması şeklinde tanımlanmıştır: - Ayaktan tedavi edilen hasta, YMRS total skoru <12, MADRS total skoru <12, aktif intihar eğilimi yok; aktif intihar eğilimi MADDÖ 10. maddesinde skorun 4 ya dadaha fazla olması ya da Kolombiya İntihar Şiddeti Derecelendirme Ölçeği (K-İŞDÖ)4. ya da 5. sorulara cevabın EVET olması olarak tanımlanmıştır. Minimum 12 haftalık, kontrolsüz, tek kör ABİLİFY MAİNTENA stabilizasyon fazı(aylık 400 mg ABİLİFY MAİNTENA enjeksiyonu- ilk 2 hafta 10-20 mg ek oralaripiprazol uygulanmıştır). Advers olaylar söz konusu olduğunda bir defaya mahsusolmak üzere 300 mg'a doz düşüşüne izin verilmiştir. Bu faza 425 hasta dahil edilmiştir.Ortalama başlangıç skorları: YMDÖ total, 5,8; MADDÖ total, 3,7 ve KGİ-BP-Ş genel 2,1 (hafif düzeyde hasta) olarak tespit edilmiştir. Diğer çalışma fazına geçilmeden önce 6. haftadan itibaren 8 ardışık hafta boyunca klinik stabilizasyon kriterlerinin(stabilizasyon kriterleri için yukarı bakınız) karşılanması gerekiyordu. 25 / 31 Bir duygu durum epizodu yinelemesinin olup olmadığının gözlemlendiği 52 haftalık randomize, çift kör, plasebo kontrollü, geri çekilme fazı. Toplam 266 hasta stabilizasyonfazının sonunda aldıkları dozda ABİLİFY MAİNTENA'ya (4 haftada bir 400 mg ya da300 mg) ve plaseboya randomize edilmiştir. Ortalama başlangıç skorları: YMDÖ total,2,8; MADDÖ total, 2,7 ve KGİ-BP-Ş genel 1,7 (hafif düzeyde hasta) olarak tespitedilmiştir. Tolerabilite için bir defaya mahsus olmak üzere 300 mg'a doz düşüşüne izinverilmiştir. Primer Etkililik Ölçütü randomizasyondan herhangi bir duygu durum atağı yinelemesine kadar geçen süre olarak belirlenmişti. Yineleme aşağıdaki kriterlerden bir ya da daha fazlasının ilk ortaya çıkışı olarak tanımlanmıştır: 1) Herhangi bir duygu durum atağı için hastaneye yatırılma YA DA 2) Aşağıdakilerden herhangi biri: a. YMDÖ total skoru >15 b. MADDÖ total skoru >15 c. KGİ-BP-Ş genel skoru >4 YA DA 3) Hastalığın kötüleşmesine neden olan ciddi advers olay (CAO) YA DA 4) Etkisizliğe ya da herhangi bir advers olaya (AO) bağlı tedavi bırakma YA DA 5) Tedaviye bir duygu durum düzenleyici, antidepresan, antipsikotik ya da çalışmaprotokolünde tanımlanandan daha yüksek doz benzodiyazepin eklenmesini gerektirecekdüzeyde duygu durum belirtilerinde bozulma YA DA 6) Aktif intihar eğilimi; MADDÖ 10. maddesinde skorun 4 ya da daha fazla olması ya daKolombiya İntihar Şiddeti Derecelendirme Ölçeği (K-İŞDÖ) 4. ya da 5. sorulara cevabınEVET olması olarak tanımlanmıştır. Analizlerde gösterilmiştir ki ABİLİFY MAİNTENA grubundaki hastalarda herhangi bir duygu durum atağının ortaya çıkmasına kadar geçen süre plasebo grubuna göre anlamlı olarak dahauzundur. ABİLİFY MAİNTENA ve plasebo grupları için çift kör fazda herhangi bir duygudurum atağına kadar geçen sürenin Kaplan Maier eğrileri aşağıdaki şekilde gösterilmektedir. 26 / 31
Duygu durum yinelemesinin alt-tipine göre yapılan analizde; ABİLİFY MAİNTENA grubundaki hastalarda hem manik hem de karışık atak yinelemesine kadar geçen süre plasebogrubuna göre anlamlı olarak uzun bulunmuştur. Depresif atakların yinelemesine kadar geçen süreaçısından gruplar arasında fark tespit edilmemiştir. Cinsiyet, ırk ve yaş açısından bakıldığında alt-grup analizinde yanıt açısından farklılık saptanmamıştır. 5.2 Farmakokinetik özelliklerGenel özelliklerABILIFY MAİNTENA aktivitesi muhtemelen primer olarak ana ilaca, yani aripiprazole, daha az derecede de onun majör metaboliti olan, plazmadaki ana ilaç maruziyetinin %29'una karşılıkgelen ve D 2reseptörler üzerine afinitesinin ana ilaca benzer olduğu gösterilmiş olan ve dehidro-aripiprazole bağlıdır.Emilim:Aripiprazol partiküllerinin çözünürlüğünün düşük olması nedeniyle intramusküler enjeksiyondan sonra sistemik dolaşıma aripiprazol absorpsiyonu yavaş ve uzamıştır. Ortalamaemilim yarı ömrü 28 gündür. IM depo formülasyonundaki aripiprazol emilimi IM standart (hızlı-salınım) formülasyonundaki ile tamamen bağıldır. Depo formülasyonu için doz ayarlanmış Cmaksdeğerleri, IM standart formülasyonu Cmaks değerinin yaklaşık %5'idir. Deltoid ve gluteal kastantek bir doz uygulama sonrasında emilim uzunluğu (EAA) her iki enjeksiyon bölgesi için debenzerdir, ancak deltoid kas uygulamasından sonra emilim oranı (Cmaks) daha nyüksektir. Çokluintramusküler enjeksiyon sonrasında, aripiprazol plazma konsantrasyonları kademeli olarakartar, medyan 5-7 gün gibi bir Tmaks süresinde maksimum plazma konsantrasyonuna erişilir. Heriki uygulama yeri için de kararlı durum konsantrasyonları dördüncü doz ile sağlanmıştır.ABILIFY MAİNTENA 300 mg ve 400 mg enjeksiyonu sonrası aripiprazol ve dehidroaripiprazolkonsantrasyonlarında ve AUC parametrelerinde doz orantılıdan bir miktar daha az konsantrasyonartışı görülür. 27 / 31 Dağılım:Aripiprazol oral uygulaması ile yapılan klinik araştırmalar, aripiprazolün 4,9 l/kg'lık bir hacim dağılımıyla vücutta yaygın olarak dağıldığını ortaya koymaktadır ki bu yoğun bir ekstra vasküleryayılımı göstermektedir. Terapötik konsantrasyonlarda aripiprazol ve dehidro-aripiprazol,primer olarak albümin olmak üzere serum proteinlerine %99'dan daha fazla bağlanır. Biyotransformasyon:Aripiprazol öncelikle karaciğerde üç biyotransformasyon yolu ile metabolize olur: dehidrojenasyon, hidroksilasyon, N-dealkilasyon. In-vitro çalışmalara göre CYP3A4 veCYP2D6 enzimleri aripiprazolün dehidrojenasyonu ve hidroksilasyonundan sorumludur, N-dealkilasyon ise CYP3A4 ile katalize olur. Aripiprazol sistemik dolaşımda baskın bir ilaçtır.Çoklu doz uygulamasından sonra aktif metaboliti olan dehidroaripiprazol EAA'nı plazmadakiaripiprazol EAA'nın yaklaşık %29,1 - 32,5'unu oluşturur. Eliminasyon:Her 4 haftada bir yapılan 300 mg ve 400 mg ABILIFY MAINTENA enjeksiyonlarından sonra ortalama aripiprazol terminal eliminasyon yarılanma-ömrü sırasıyla 29,9 gün ve 46,5 gündü[14C]-etiketli aripiprazol tek doz uygulamasından sonra, uygulanan radyoaktivitenin yaklaşık%27'si idrarda ve yaklaşık %60'ı feçeste geri kazanıldı. Değişmemiş aripiprazolün %1'inden azıidrardan atıldı ve yaklaşık %18'i feçeste geri kazanıldı. Doğrusallık/doğrusal olmayan durum:Aylık ABILIFY MAINTENA 300 mg'dan 400 mg'a enjeksiyonu sonrasında aripiprazol, dehidro-aripiprazol konsantrasyonları ve EAA parametrelerinde doz orantısından az artışgözlemlendi. Hastalardaki karakteristik özelliklerYaslılarda:Sağlıklı yaşlılar ve genç yetişkin gönüllülerde aripiprazolün farmakokinetiği açısından ne bir fark vardır ne de şizofrenik hastaların farmakokinetik analizinin üzerinde, popülasyonun yaşınınölçülebilir bir etkisi tespit edilmiştir. Cinsiyet:Sağlıklı erkek ve kadın gönüllülerde aripiprazolün farmakokinetiği açısından bir fark yoktur. Şizofrenisi olan hastalarda popülasyon farmakokinetik analizinde cinsiyetin ölçülebilir bir etkisiyoktur. Irk:Popülasyon farmakokinetik değerlendirmesinde, ırkla ilişkili anlamlı farklılıkların aripiprazol farmakokinetiği üzerinde klinik bakımdan anlamlı etkilere sebep olduğuna dair bir kanıtlakarşılaşılmamıştır. Sigara kullanımı:Popülasyon farmakokinetik değerlendirmesinde, sigara kullanma durumunun aripiprazol farmakokinetiği üzerinde klinik bakımdan anlamlı etkilere sebep olduğuna dair bir kanıtlakarşılaşılmamıştır. Böbrek yetmezliği:Oral aripiprazol uygulamasıyla gerçekleştirilen bir tek-doz çalışmasında genç sağlıklı deneklerle karşılaştırıldığında şiddetli böbrek hastalığı olan hastalarda aripiprazol ve dehidro-aripiprazolün 28 / 31 farmakokinetik özellikleri benzer bulunmuştur.Karaciğer yetmezliği:Değişik seviyelerde karaciğer sirozu olan gönüllülerdeki (Child-Pugh Kategorileri A, B ve C) tek doz çalışmaları (15 mg oral aripiprazol) karaciğer bozukluğunun aripiprazol ve dehidro-aripiprazolün farmakokinetiği üzerinde önemli bir etkisi olmadığını göstermiştir fakat sadeceKategori C karaciğer sirozu olan 3 hasta ile yapılan bu çalışma hastaların metabolik kapasiteleriile ilgili değerlendirme yapmak için yetersizdir.CYP2D6 zayıf metabolize ediciler:ABILIFY MAINTENA'nın popülasyon farmakokinetik değerlendirmesine göre aripiprazolün toplam vücut klerensi CYP2D6 uzatılmış metabolize edicilerinde 3,71 L/saattir ve CYP2D6 zayıfmetabolize edicilerinde yaklaşık 1,88 L/saattir (yaklaşık %50 az) (doz önerisi için bkz. bölüm4.2).5.3 Klinik öncesi güvenlilik verileriİntramuskuler AripiprazolDeney hayvanlarına intramuskuler yolla uygulanan aripiprazolün toksikolojik profili oral yoldan uygulama ile ilacın benzer plazma kan düzeylerinde genel olarak benzer düzeydedir. Bununlabirlikte intramuskuler enjeksiyonda lokal inflamasyon, şişme, kabuklanma, verilen ilaca bağlıyabancı madde reaksiyonları gibi enjeksiyon yeri bulguları gözlenmiştir.Klinik öncesi güvenlilik verileri, geleneksel güvenlilik farmakolojisi, tekrarlayan doz toksisitesi, genotoksisite, karsinojenik potansiyel ve üreme ve gelişim toksisitesi çalışmalarına dayalı olarakinsanlara yönelik özel bir tehlike ortaya koymamaktadır.26 haftalık tedavi sonrası erkek sıçanlarda advers etki gözlenmeyen düzey 50 mg/kg, dişi sıçanlarda ise 100 mg/kg oldu. Bu dozlar insanda önerilen maksimum doz olan mg/m2vücutyüzeyi başına 400 mg aripiprazol uzatılmış salınım enjeksiyonluk solüsyonu uygulamasınınsırasıyla 1 veya 2 katıdır.Sıçanlarda advers etki gözlenmeyen düzeyde, eğri altındaki alan (EAA7d) değerleri erkek sıçanlarda 14,4 mcg-h/mL ve dişi sıçanlarda ise 104,1 mcg-h/mL olarak tespit edildi. Köpeklerde52 haftalık tedavi sonrası advers etki gözlenmeyen düzey olan 40 mg/kg, insanda önerilenmaksimum doz olan mg/m2vücut yüzeyi başına 400 mg aripiprazol uzatılmış salınımenjeksiyonluk solüsyonu uygulamasının 3 katı ve eğri altındaki alan (EAA7d) değerleri erkeksıçanlarda 59 mcg-h/mL ve dişi sıçanlarda ise 163 mcg-h/mL oldu. Hastalarda, insanda önerilenmaksimum doz olan 400 mg uygulamasında, 0-28 günler arasında EAA değeri 163 mcg-h/mLolarak tespit edildi. Bunu insan EAA'sı ile karşılaştırmak için hayvan EAÂ7ddeğerlerini EAA28ddeğerini tahmin etmede kullandığınızda EAA28ddeğerleri erkek ve dişi sıçanlar için sırasıyla 58ve 416 mcg-h/mL, erkek ve dişi köpekler için sırasıyla 236 ve 175 mcg-h/mL olarak tespit edildi.Oral AripiprazolAripiprazolün toksikolojik profili hayvan toksisite çalışmalarında oral uygulama ile araştırılmıştır. Belirgin toksikolojik etkiler ancak maksimum insan dozu aşıldığında gözlenmişve bu da bu etkilerin sınırlı veya klinik olarak bir anlamı olmadığını göstermiştir. Bu etkiler:sıçanlarda 104 haftalık oral uygulamada, maksimum önerilen insan dozundaki kararlı durumEAA'sının yaklaşık olarak 3 ila 10 katı uygulamada doza bağlı gözlene adrenokortikal toksisiteve artmış adrenokortikal karsinom ve dişi sıçanlarda yaklaşık 10 kat dozda gözlenen artmış29 / 31adrenokortikal adenom/karsinom birlikteliği. Dişi sıçanlarda tümör oluşturmayan en yüksek doz önerilen insan dozunun 7 katıdır. Ek bir bulgu, maymunlarda tekrarlayan 25-125 mg/kg/gün oral doz uygulamasında veya mg/m2 başına önerilen maksimum insan dozunun 16-81 katı uygulandığında gözlenen aripiprazolünhidroksi metabolitinin sülfat konjugatının çökmesi sonucunda oluşan kolelitiyazisdir. Bununlabirlikte önerilen en yüksek doz olan 30 mg/gün uygulandığında bile aripiprazolün hidroksimetabolitinin sülfat konjugatının insan safrasındaki konsantrasyonu maymunlarda 39 haftalıkçalışmadaki safra konsantrasyonunun %6'sını geçmemektedir ve bu değer (%6) in vitroçözünürlüğün limitlerinin çok altındadır.Genç sıçan ve köpeklerde yapılan tekrarlanan doz çalışmalarında, aripiprazolün toksisite profili, yetişkin hayvanlarda gözlenenler ile kıyaslanabilirdir ve nörotoksisite veya gelişim üzerine yanetkiler gözlenmemiştir. Tüm standart genotoksisite deneylerine dayanılarak, aripiprazolün genotoksik olmadığı düşünülmektedir. Aripiprazol hayvanlardaki üreme toksisitesi çalışmalarında fertiliteyiazaltmamıştır. Sıçanlarda sub-terapötik ve terapötik dozlarda (EAA'ya bağlı olarak) ve önerilenen yüksek klinik dozdaki ortalama kararlı durum EAA'sının 3-11 katı maruziyete neden olandozlarda olası teratojenik etkiler dahil, gelişim toksisitesi gözlenmiştir. Gelişim toksisitesineneden olan dozlara benzer dozlarda maternal toksisite gözlenmiştir. Geleneksel farmakolojik güvenlilik çalışmaları, oral yoldan verilen aripiprazol için klinik öncesi güvenlilik verisi tekrarlayan doz toksisitesi, genotoksisite ve karsinojenik potansiyel açısındaninsanlara yönelik özel bir tehlike oluşturmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiKarboksimetilselüloz sodyum Mannitol Sodyum fosfat monobazik monohidrat Sodyum hidroksit 6.2 GeçimsizliklerGeçerli değil. 6.3 Raf ömrü36 ay Sulandırma sonrasıSulandırılmış süspansiyon, hemen kullanılmalıdır. Eğer hemen kullanılmayacaksa, sulandırıldıktan sonra 25°C'de saklanması koşuluyla 4 saat içinde kullanılmalıdır. 6.4 Saklamaya yönelik özel uyarılar30°C'nin altındaki oda sıcaklığında saklayınız. Dondurmayınız. Oda sıcaklığında sulandırılmalıdır. 30 / 31 6.5 Ambalajın niteliği ve içeriği400 mg aripiprazol içeren uzatılmış salımlı enjektabl toz içeren 1 flakon, 2 ml'lik steril enjeksiyonluk su içeren ampul ile birlikte kit içerisinde sunulur. Diğer kit bileşenleri aşağıdaki gibidir: 3 ml'lik luer kilitli enjektör ile 21 gauge, 1 1/2 " koruma kapaklı iğne ve iğne koruma kılıfı. Bir adet 3ml'lik luer kilitli ucu olan tek kullanımlık enjektör. Bir adet flakon adaptörü Obez olmayan hastalarda deltoid uygulaması için bir adet 23 gauge, 1" (25 mm) korumakapaklı iğne ve iğne koruma kılıfı Obez hastalarda deltoid uygulama veya obez olmayan hastalarda gluteal uygulama için biradet 22 gauge, 1,5" (38 mm) koruma kapaklı iğne ve iğne koruma kılıfı Obez hastalarda gluteal uygulama için bir adet 21 gauge, 2" (51 mm) koruma kapaklı iğneve iğne koruma kılıfı Kullanım Kılavuzu Kullanma Talimatı 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller 'Tıbbi Atıkların Kontrol Yönetmeliği' ve 'Ambalaj Atıklarının Kontrolü Yönetmelik' lerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİOtsuka Pharmaceutical Co., Ltd./Japonya lisansıyla Abdi İbrahim Otsuka İlaç San. ve Tic. A.Ş. Reşitpaşa Mah. Eski Büyükdere Cad. No: 4 34467 Maslak / Sarıyer /İstanbul 8. RUHSAT NUMARASI2015/555 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 15.07.2015 Ruhsat yenileme tarihi: 06.08.2021 10. KÜB'ÜN YENİLENMETARİHİ31 / 31 / 31 / 31 / 31 / 31 / 31 / 31 |
İlaç BilgileriAbilify Maintena 400 Mg Uzun Salımlı İm Enjeksiyonluk FlakonEtken Maddesi: Aripiprazol Monohidrat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.