Sunubis 12,5 Mg Sert Kapsül Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADISUNUBİS 12,5 mg sert kapsül Sitotoksik 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir sert kapsül 12,5 mg sunitinibe eşdeğer 16,705 mg sunitinib malat içerir. Yardımcı maddeler:Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMSert jelatin kapsül No:4 opak kırmızımsı turuncu, beyaz Nobel amblem baskılı kapak/opak kırmızımsı turuncu, beyaz 12,5 mg baskılı gövdeden oluşan sert jelatin kapsül içinde turuncu toz içerir. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarGastrointestinal Stromal Tümör (GİST) SUNUBİS imatinib mesilat tedavisine dirençli veya intoleran anrezektabl ve/veya metastatik gastrointestinal stromal tümörlerin (GİST) tedavisinde endikedir. Metastatik Renal Hücreli Karsinom (mRHK) SUNUBİS ilerlemiş ve/veya metastatik renal hücreli karsinom (mRHK) tedavisinde endikedir. Pankreatik Nöroendokrin Tümör (pNET) SUNUBİS, metastatik veya lokal ileri evrede olup cerrahi tedavisi mümkün olmayan, somatostatin analogları tedavisi sonu progresyon gelişen iyi differansiye pankreatiknöroendokrin tümörlerin (pNET) tedavisinde endikedir. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Tedavi kanser ilaçlarını uygulama konusunda tecrübeli bir hekim tarafından başlatılmalıdır. GİST ve mRHK için; önerilen SUNUBİS dozu 4 hafta kesintisiz günde 1 defa 50 mg ağızdan alınarak ve daha sonra 2 hafta ara vermek suretiyle 6 haftalık kürü tamamlayacak şekildedir. pNET için SUNUBİS'in önerilen dozu; planlı bir ara verme dönemi olmaksızın günde bir kez oral yolla 37,5 mg'dır. GİST ve mRHK için, 12,5 mg'lık artış veya azaltmalarla doz modifikasyonları bireysel güvenlilik ve tolerabiliteye bağlı olarak uygulanabilir. Günlük dozlar 25 mg'ın altına 1 düşmemeli ve 75 mg'ı geçmemelidir. Bireysel güvenlilik ve tolere edilebilirlik göz önüne alınarak, pNET için 12,5 mg'lık adımlarla doz ayarlaması yapılabilir. Faz III pNET çalışmasında uygulanan maksimum doz günde 50mg olmuştur. Bireysel güvenlilik ve tolerabiliteye bağlı olarak doza ara vermek gerekebilir. Rifampisin gibi kuvvetli CYP3A4 indükleyici ile birlikte SUNUBİS kullanımından sakınılmalıdır. Eğer kullanılması gerekiyorsa, kullanan hastalarda dozun 12,5 mg'lıkmiktarlarla (GİST ve mRHK için günde 87,5 mg'a kadar veya pNET için günde 62,5 mg'akadar) artırılması gerekebilir. Klinik yanıt ve tolerabilite dikkatle izlenmelidir. Ketokonazolgibi CYP3A4 inhibitörü ile birlikte SUNUBİS kullanımından sakınılmalıdır. Eğer birliktekullanılması mutlaka lazımsa kullanan hastalarda tolerabilite ve/veya klinik yanıta bağlıolarak SUNUBİS dozu 12,5 mg'lık kademelerle GİST ve mRHK için günlük minimum 37,5mg'a veya pNET için günde 25 mg'a düşürülebilir. Eşzamanlı ilaç seçiminde CYP3A4'üindükleyici veya inhibe edici potansiyeli çok düşük olan veya hiç olmayan alternatif ilaçlardüşünülmelidir (bkz. Bölüm 4.4). Uygulama şekli:SUNUBİS, aç karnına veya yemekle beraber, oral olarak alınabilir. Bir doz atlandıysa hastaya ilave doz verilmemelidir. Hasta bir sonraki gün önerilen normal doz ile devam etmelidir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Hafif (Child-Pugh Sınıf A) ve orta (Child-Pugh Sınıf B) karaciğer yetmezliği olan hastalarda başlangıç dozunun ayarlamasına gerek yoktur. Ciddi (Child-Pugh Sınıf C) karaciğeryetersizliği olan hastalarda çalışma yapılmamıştır. Bu nedenle şiddetli karaciğer yetmezliğiolan hastalarda sunitinib kullanımı ile ilgili bir öneride bulunulamamaktadır (bkz. Bölüm 5.2). Orta-ciddi böbrek yetmezliği olan hastalarda veya hemodiyalize giren son dönem böbrek yetmezliği hastalarına sunitinib verilirken başlangıç doz ayarlaması gerekli değildir. Takipeden dozlar güvenlilik ve tolerabiliteye göre ayarlanmalıdır (bkz. Bölüm 5.2). Pediyatrik popülasyon:Sunitinibin 18 yaşın altındaki hastalardaki güvenlilik ve etkililiği değerlendirilmemiştir. Şu an var olan veriler Bölüm 4.8, 5.1 ve 5.2'de anlatılmıştır, fakat popülasyonda sunitinib kullanımıönerilmemektedir. Geriyatrik popülasyon:Sunitinibe ait klinik çalışmalardaki hastaların yaklaşık %34'ünün yaşı 65 veya üzeridir. Genç ve yaşlı hastalar arasında güvenlilik ve etkililik açısından herhangi bir anlamlı farkgözlenmemiştir. 4.3. KontrendikasyonlarSunitinib malat veya SUNUBİS sert kapsüllerin bileşenlerinden herhangi birine aşırı duyarlılığı olan hastalarda kontrendikedir (bkz. Bölüm 6.1). 2 4.4. Özel kullanım uyarıları ve önlemleriPotent CYP3A4 indükleyicileri sunitinibin plazma konsantrasyonunu azaltabileceğinden birlikte kullanımından kaçınılmalıdır (bkz. Bölüm 4.2 ve 4.5). Potent CYP3A4 inhibitörleri sunitinibin plazma konsantrasyonunu arttırabileceğinden birlikte kullanımından kaçınılmalıdır (bkz. Bölüm 4.2 ve 4.5). Cilt ve doku bozuklukları Hastalar aynı zamanda SUNUBİS ile tedavi boyunca saç veya ciltte depigmentasyon olabileceği konusunda uyarılmalıdır. Ciltte kuruluk, kalınlık veya çatlama, ayak tabanları veyaavuç içlerinde nadiren kızarıklık veya kabarcıklar diğer olası dermatolojik etkiler arasındasayılabilir. Yukarıda adı geçen olaylar kümülatif (birikimli) değildir; tipik olarak reversibl olup genellikle tedaviye son vermeyi gerektirmemiştir. Piyoderma gangrenosum (genellikle sunitinibkullanımı bırakıldıktan sonra geri dönüşlü olan ağrılı deri ülseri) vakaları bildirilmiştir.Bazıları ölümle sonuçlanmış eritema multiforme (EM), Steven-Johnson sendromu (SJS) vetoksik epidermal nekroliz (TEN) dahil ciddi kutanöz reaksiyonlar bildirilmiştir. SJS, TENveya EM belirtileri veya semptomları (örn. genellikle su toplaması ve mukozal lezyonlar ileseyreden ilerlemiş deri döküntüleri) mevcutsa, sunitinib tedavisi sonlandırılmalıdır. SJS veyaTEN teşhisi doğrulanmışsa, tedaviye tekrar başlanmamalıdır. EM'den şüphelenilen bazıolgularda, reaksiyonun sona ermesinin ardından daha düşük dozda sunitinib tedavisineyeniden başlanması hastalar tarafından tolere edilmiştir. Bu hastalardan bazıları eş zamanlıolarak kortikosteroid ve antihistaminik tedavisi almıştır (bkz. Bölüm 4.8). Hemoraji ve tümörlerin kanaması Sunitinib ile yapılan klinik çalışmalarda ve pazarlama sonrası deneyimlerde, gastrointestinal sistem, solunum, üriner sistem ve beyin hemorajisi gibi bazıları ölümcül olabilecek hemorajikolaylar bildirilmiştir (bkz. Bölüm 4.8). Kanama olaylarının rutin değerlendirmesi, tam kan sayımı ve fizik muayene ile yapılmalıdır. Hemorajik olaylar yaşamış solid tümörlü hastaların, yaklaşık yarısında en çok görülen hemorajik advers olay burun kanamasıdır. Burun kanaması olaylarından bazıları ciddi olup,çok seyrek olarak ölüme yol açmıştır. Tümörlerin kanama olayları bazen tümör nekrozuna eşlik eder, bu kanamalar fatal olabilir. Tümör hemorajisi aniden oluşabilir ve akciğer tümörleri olgularında, ciddi ve hayatı tehdit edici hemoptizi veya akciğer kanaması olarak görülebilir. mRHK, akciğer kanseri ve GİSTtedavisi için sunitinib kullanan hastalarda pazarlama sonrası deneyim olarak akciğer kanaması(bazıları ölümle sonuçlanmıştır) oluşmuş ve bu durum klinik çalışmalarda da gözlemlenmiştir.Sunitinib, akciğer kanseri olan hastalarda kullanım için onaylı değildir. Eş zamanlı olarakantikoagülan (örn.; varfarin, asenokumarol) tedavisi alan hastalar tam kan sayımı(trombositler), koagülan faktörler (PT/INR) ve fiziksel muayene ile periyodik olarak kontroledilmelidir. Gastrointestinal olaylar Diyare, mide bulantısı/kusma, karın ağrısı, dispepsi ve stomatit en çok rapor edilen 3 gastrointestinal yan etkilerdir. Ayrıca özofajit de rapor edilmiştir (bkz. Bölüm 4.8). Tedavi gerektiren gastrointestinal advers olaylar için destekleyici bakım, antiemetik, antasit veyaantidiyareik ilaç tedavisi ile sağlanabilir. Sunitinib ile tedavi edilen, intra-abdominal maligniteleri olan hastalarda gastrointestinal perforasyonu kapsayabilen, ciddi ölümcül gastrointestinal komplikasyonlar oluşmuştur. Hipertansiyon Ciddi hipertansiyon (>200 mmHg sistolik veya 110 mmHg diyastolik) dahil sunitinib ile ilişkili olarak hipertansiyon bildirilmiştir. Hastalar hipertansiyon için taranmalı ve uygunoldukça kontrol edilmelidir. İlaç müdahalesiyle kontrol edilemeyen ağır hipertansiyonluhastalarda geçici olarak ilaç tedavisinin durdurulması önerilir. Hipertansiyon uygun olarakkontrol altına alındığında tedaviye yeniden başlanabilir (bkz. Bölüm 4.8). Hematolojik bozukluklar Sunitinib ile ilişkili olarak azalmış mutlak nötrofil sayıları ve azalmış trombosit sayısı bildirilmiştir (bkz. Bölüm 4.8). Yukarıda adı geçen olaylar kümülatif (birikimli) değil; tipikolarak reversibl olup genellikle tedaviye son vermeyi gerektirmemiştir. Faz III çalışmalardakibu olayların hiçbiri ölümcül olmamakla birlikte pazarlama sonrası deneyimlerdetrombositopeni ve nötropenik enfeksiyonların eşlik ettiği hemorajili durumlarda seyrek olarakölüm olguları rapor edilmiştir. Sunitinib ile tedavi esnasında erken ve geç dönemde anemi gözlenmiştir. SUNUBİS ile tedavi gören hastalarda, her tedavi kürünün başlangıcında tam kan sayımı yapılmalıdır (bkz. Bölüm 4.8). Kardiyak bozukluklar Sunitinib kullanan hastalarda bazıları ölümle sonuçlanan, kalp yetmezliği, kardiyomiyopati, sol ventrikül ejeksiyon fraksiyonunun normalin alt sınırının altına düşmesi, miyokardit vemiyokardiyal iskemi ve miyokard enfarktüsünün de dahil olduğu kardiyovasküler olaylarrapor edilmiştir. Bu veriler sunitinibin kardiyomiyopati riskini arttırdığını göstermektedir.İlaca özgü etki dışında sunitinib ile indüklenen kardiyomiyopati için tedavi gören hastalardailave risk faktörleri tespit edilmemiştir. Bu olaylar açısından risk taşıyan veya kardiyovaskülerhikayesi olan hastalarda dikkatli kullanılmalıdır (bkz. Bölüm 4.8). Sunitinib uygulamasından önce 12 ay içinde miyokard enfarktüsü (ciddi/stabil olmayan anjinayı kapsayan), koroner/periferik arter by-pass grafti, semptomatik KKY, serebrovaskülerolay veya geçici iskemik atak veya akciğer embolisi gibi kardiyak bulguları olan hastalar,sunitinib klinik çalışmalarına dahil edilmemiştir. Bunun gibi eş zamanlı rahatsızlıkları olanhastaların sunitinible ilişkili sol ventrikül işlev bozukluğu gelişimi için daha yüksek bir riskteolup olmadıkları bilinmemektedir. Doktorlara SUNUBİS'in risk/yarar oranını göz önündebulundurmaları tavsiye edilir. Kardiyak risk faktörü olan ve/veya koroner arter hastalığıhikayesi olan hastalar SUNUBİS alırken, KKY'nin klinik belirtileri ve semptomları içindikkatli olarak gözlenmelidirler. Hasta sunitinib alırken, SVEF için başlangıç ve periyodikdeğerlendirmeleri de düşünülmelidir. Kardiyak risk faktörleri olmayan hastalarda, ejeksiyonfraksiyonunun başlangıç değeri ölçülmelidir. KKY'nin klinik belirtilerinin varlığında, sunitinibin kesilmesi önerilir. Sunitinib dozu, klinik KKY bulgusu olmayan ancak, SVEF<%50 ve başlangıca göre >%20 düşüş göstermiş 4 hastalarda kesilmeli ve /veya azaltılmalıdır. QT aralığı uzaması Sunitinib'e maruz kalan hastalarda QT aralığı uzaması ve Torsade depointesTorsade de pointesde dahil olmak üzere ventriküler aritmilerde artmış birriske yol açabilir. Sunitinib; bilinen QT aralığı uzama öyküsü, antiaritmik ya da QT aralığınıuzatabilen bir ilaç alan veya daha önceden bilinen önemli kardiyak hastalığı, bradikardi veyaelektrolit bozukluğu olan hastalarda dikkatle kullanılmalıdır. Güçlü CYP3A4 inhibitörleri ileeş zamanlı tedavi, sunitinibin plazma konsantrasyonunu yükseltebileceği için, dikkatlikullanılmalıdır (bkz. Bölüm 4.2, 4.5 ve 4.8).Venöz tromboembolik olaylar Derin ven trombozu ve pulmoner emboli de dahil olmak üzere sunitinib alan hastalarda tedaviye bağlı venöz tromboembolik olaylar bildirilmiştir (bkz. Bölüm 4.8). Pazarlamasonrası deneyimlerde ölümcül sonuç veren pulmoner emboli vakaları gözlenmiştir. Arteriyel tromboembolik olaylar Sunitinib ile tedavi edilen hastalarda bazıları ölümcül olan arteriyel tromboembolik (ATE) olaylar raporlanmıştır. En sık gözlenen olaylar serebrovasküler olaylar, geçici iskemik atak veserebral enfarktüs şeklindeydi. Altta yatan malign hastalık ve yaşın 65 veya üzerinde olmasınaek olarak, hipertansiyon, diyabet ve daha önceki tromboembolik hastalık ATE ile ilişkili riskfaktörleri arasında yer alır. Anevrizmalar ve arter diseksiyonları Vasküler endotelyal büyüme faktör (VEGF) yolak inhibitörlerinin, hipertansiyonu olan veya olmayan hastalarda kullanılması, anevrizmalar ve/veya arter diseksiyonları oluşumunukolaylaştırabilir. SUNUBİS'e başlamadan önce hipertansiyon veya anevrizma öyküsü gibirisk faktörleri olan hastalarda bu risk dikkatle değerlendirilmelidir. Trombotik Mikroanjiyopati (TMA) Trombotik trombositopenik purpura (TTP) ve hemolitik uremik sendorumu (HUS) dahil olmak üzere, bazen böbrek yetmezliğine veya ölümcül bir sonuca yol açan, hemolitik anemi,trombositopeni, yorgunluk, nörolojik belirtilerde dalgalanma, böbrek yetmezliği ve ateşgörülmesi durumunda TMA tanısı düşünülmelidir. TMA gelişen hastalarda sunitinib tedavisidurdurulmalı ve acilen tedaviye başlanmalıdır. Sunitinib tedavisinin bırakılmasından sonraTMA etkilerinin düzeldiği gözlemlenmiştir (bkz. Bölüm 4.8). Tiroid disfonksiyonu Tiroid fonksiyonlarının başlangıçta laboratuvar ölçümleri tüm hastalara önerilir ve hipotiroidizmli veya hipertiroidizmli hastalar, sunitinib tedavisi başlatılmadan önce standarttıbbi uygulama ile tedavi edilmelidirler. Sunitinib tedavisi sırasında her 3 ayda bir tiroidfonksiyonları rutin olarak izlenmelidir. Ek olarak, sunitinib tedavisindeki bütün hastalar, tiroiddisfonksiyonun belirtileri ve semptomları için yakından gözlenmelidirler. Tiroiddisfonksiyonuna dair belirtileri ve/veya semptomları olan hastalarda tiroid fonksiyonununlaboratuvar takibi yapılmalı ve standart tıbbi tedavi uygulanmalıdır. Sunitinib ile tedavi edilen hastalarda erken veya geç olarak hipotirodizm gözlenmiştir (bkz. Bölüm 4.8). Pankreatit 5 Sunitinib kullanan çeşitli solid tümörlü hastalarda serum lipazı ve amilazında artışlar görülmüştür. Çeşitli solid tümörlü hastalarda lipaz seviyelerindeki artışlar geçici olmuş vegenellikle pankreatite ait semptomlar veya belirtilere eşlik etmemişlerdir (bkz. Bölüm 4.8). Bazıları ölümcül olabilen ağır pankreatit olguları bildirilmiştir. Eğer pankreatit bulguları varsa sunitinib kesilmeli ve uygun destekleyici tedavi yapılmalıdır. Hepatotoksisite Sunitinib tedavisi gören hastalarda hepatotoksisite gözlemlenmiştir. Sunitinib tedavisi gören solid tümörlü hastaların %1'inden azında, bazıları ölümle sonuçlanan, karaciğer yetmezliğiolguları görülmüştür. Tedaviye başlanmadan, her tedavi siklusunda ve klinik olarak endikeolduğu durumlarda karaciğer fonksiyon testleri (alanin transaminaz [ALT], aspartattransaminaz [AST], bilirubin seviyeleri) takip edilmelidir. Eğer karaciğer yetmezliğisemptomları veya belirtileri mevcutsa, sunitinib tedavisi durdurulmalı ve durum düzelmediysetedaviye devam edilmemeli ve uygun destekleyici tedavi yapılmalıdır (bkz. Bölüm 4.8). Böbrek fonksiyonu Böbrek bozuklukları, böbrek yetmezliği ve/veya akut böbrek yetmezliği olan hastalarda, bazıları ölümcül olan olgular bildirilmiştir (bkz. Bölüm 4.8). Sunitinib alan hastalardaki böbrek bozukluğu/yetmezliği ile ilişkili risk faktörleri arasında, altta yatan renal hücreli karsinoma ek olarak, ilerlemiş yaş, diyabet, altta yatan böbrek işlevbozukluğu, kalp yetmezliği, hipertansiyon, sepsis, dehidratasyon/hipovolemi ve rabdomiyolizyer alır. Orta ve ileri derecede proteinürisi olan hastalarda devam eden sunitinib tedavisinin güvenliliği sistematik olarak değerlendirilmemiştir. Proteinüri ve nadiren nefrotik sendrom olguları raporlanmıştır. Başlangıçta idrar tahlili yapılması önerilir ve hastalarda proteinürinin gelişimi ya da kötüleşmesi takip edilmelidir.Nefrotik sendromlu hastalarda sunitinib kesilmelidir. Fistül Eğer fistül oluşumu gözlenirse, sunitinib tedavisi hemen kesilmelidir. Fistüle sahip hastalarda sunitinib kullanımına devam edilmesi ile ilgili sınırlı bilgi mevcuttur (bkz. Bölüm 4.8). Yara iyileşmesinde gecikme Sunitinib tedavisi süresince yara iyileşmesinde gecikme olguları rapor edilmiştir. Sunitinibin yara iyileşmesi üzerindeki etkisine dair resmi klinik çalışma yapılmamıştır. Majör cerrahi girişim geçirecek olan hastalarda sunitinib tedavisine geçici olarak ara verilmesiönerilir. Majör cerrahi müdahaleden ne kadar sonra sunitinib tedavisine yeniden başlanacağıkonusunda sınırlı klinik deneyim mevcuttur. Bu nedenle, majör bir cerrahi müdahaleyi takibensunitinib tedavisine yeniden devam etme, operasyon sonrası iyileşmeye bağlı klinikdeğerlendirmeyle kararlaştırılır. Çenede osteonekroz Sunitinib ile tedavi edilen kanser hastalarında çene osteonekrozu olguları bildirilmiştir. Olguların çoğu daha önceden veya eş zamanlı olarak i.v. bifosfonat tedavisi alan hastalardabildirilmiş olup bu durum çene osteonekrozu için belirlenmiş bir risk faktörüdür. SUNUBİS 6 ve i.v. bifosfonatlar aynı anda veya ardı ardına kullanıldığında dikkatli olunmalıdır. İnvaziv dental girişimler de tanımlanmış risk faktörüdür. SUNUBİS ile tedaviye başlamadan önce dental muayene ve preventif dental işlemler üzerinde düşünülmelidir. Önceden veya halihazırda i.v. bifosfonat alan hastalarda mümkünse invaziv dental prosedürlerden kaçınılmalıdır(bkz. Bölüm 4.8). Hipersensitivite/Anjiyoödem Eğer hipersensitivite nedeniyle anjiyoödem oluşursa, sunitinib tedavisi kesilmeli ve standart tıbbi bir bakım yapılmalıdır (bkz. Bölüm 4.8). Nöbetler Sunitinib klinik çalışmalarında ve pazarlama sonrası deneyimlerde nöbetler gözlenmiştir. Hipertansiyon, baş ağrısı, uyarılabilirlikte azalma, mental fonksiyonlarda değişiklik vekortikal körlüğü kapsayan görme kaybı gibi geri dönüşlü lökoensefalopati sendromunu(RPLS) ile tutarlı nöbetleri ve bulguları/semptomları olan hastalar, hipertansiyonun kontrolaltına alınması dahil tıbbi müdahale ile kontrol edilmelidirler. Sunitinibin geçici olarakdurdurulması önerilir; düzelmeyi takiben, tedavi eden doktorun kararı ile tedavi devamettirilebilir (bkz. Bölüm 4.8). Tümör Lizis Sendromu (TLS) Bazıları ölümcül olan TLS olguları klinik çalışmalarda nadir olarak gözlenmiştir ve sunitinib kullanan hastalarda pazarlama sonrası deneyimlerde raporlanmıştır. TLS için risk faktörleriarasında yüksek tümör yükü, önceden var olan kronik böbrek yetmezliği, oligüri,dehidratasyon, hipotansiyon ve asidik idrar bulunur. Bu hastalar yakından takip edilmeli veklinik olarak belirtildiği şekilde tedavi edilmeli ve profilaktik hidrasyon göz önündetutulmalıdır. Enfeksiyonlar Nötropeni ile birlikte veya nötropeni olmaksızın bazıları ölümle sonuçlanan ciddi enfeksiyonlar bildirilmiştir. Perineum'un da dahil olduğu bazen ölümcül olabilen nekrotizanfasiitis olguları seyrek olarak rapor edilmiştir (bkz. Bölüm 4.8). Sunitinib tedavisi nekrotizan fasiitis gelişmiş hastalarda kesilmeli ve uygun tedaviye hemen başlanmalıdır. Hipoglisemi Sunitinib tedavisi sırasında bazıları klinik olarak semptomatik olan ve bilinç kaybından dolayı hastaneye kaldırılmayı gerektiren kan şekerinde düşüş bildirilmiştir. Semptomatik hipoglisemidurumunda SUNUBİS tedavisine geçici olarak ara verilmelidir. Diyabet hastalarındahipoglisemi riskini en aza indirmek için kullanılan anti-diyabetik ilaçların dozununayarlanması gerekliliğini değerlendirmek için kan glukoz seviyesi düzenli olarak kontroledilmelidir (bkz. Bölüm 4.8). 4.5. Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriEtkileşim çalışmaları sadece yetişkinlerde yapılmıştır. Sunitinib plazma konsantrasyonunu artırabilen ilaçlar: 7 CYP3A4 inhibitörlerinin etkisiSağlıklı gönüllülerde tek doz sunitinib ile potent CYP3A4 inhibitörü, ketokonazolün eş zamanlı uygulanması sunitinib+primer metabolit kompleksinin Cmaks ve EAA0-® değerlerinisırasıyla %49 ve %51 artırır. SUNUBİS'in potent CYP3A4 sınıfından diğer inhibitörler (örn. itrakonazol, ritonavir, greyfurt suyu, eritromisin, klaritromisin) ile birlikte uygulanması sunitinibkonsantrasyonlarını artırabilir. Bu nedenle, inhibitörlerle birlikte uygulamadan kaçınılmalıdırveya CYP3A4 inhibe edici potansiyeli olmayan veya en az potansiyeli olan alternatif bir eşzamanlı ilaç seçimi düşünülmelidir. Bunun mümkün olmadığı durumlarda, tolere edilebilirlikdikkatli şekilde izlenerek, SUNUBİS dozunun GİST ve mRHK için günde minimum 37,5mg'a ve pNET için 25 mg'a indirilmesi gerekebilir (bkz. Bölüm 4.2). Meme kanseri direnç proteini (BCRP) inhibitörlerinin etkisiSunitinib ile BRCP inhibitörleri arasında etkileşim ile ilgili sınırlı klinik veri bulunmaktadır ve sunitinib ile diğer BCRP inhibitörleri arasında etkileşim olasılığı göz ardı edilemez (bkz.Bölüm 5.2). Sunitinib plazma konsantrasyonunu azaltabilen ilaçlar: CYP3A4 indükleyicilerinin etkisiSağlıklı gönüllülerde tek doz sunitinibin CYP3A4 indükleyicisi, rifampisin ile eş zamanlı uygulanması sunitinib+primer metabolit kompleksinin Cmaks ve EAAo-® değerlerini sırasıyla%23 ve %46 azaltmıştır. SUNUBİS'in potent CYP3A4 indükleyicileri (örn. deksametazon, fenitoin, karbamazepin, rifampisin, fenobarbital veya sarı kantaron olarak da bilinen Hypericum perforatum/St.Özel popülasyonlara ilişkin ek bilgiler:Pediyatrik popülasyon:Bu popülasyonla ilgili herhangi bir etkileşim çalışması yapılmamıştır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: D Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlar SUNUBİS tedavisi sırasında gebe kalmama konusunda uyarılmalıdır. Tedavi süresince uygun doğum kontrol yöntemi uygulanmalı vegebe kalmaktan kaçınılmalıdır. Gebelik dönemiSunitinib malatın gebelik ve/veya fetüs/yeni doğan üzerinde zararlı farmakolojik etkileri 8 bulunmaktadır. SUNUBİS, potansiyel yararı fetüse olan potansiyel riskinden fazla olmadığı sürece, gebelik döneminde kullanılmamalıdır. Gebe kadınlar üzerinde yapılan bir çalışma yoktur. Hayvanlarda yapılan çalışmalar, fetal malformasyonlar dahil olmak üzere üreme toksisitesi göstermiştir (bkz. Bölüm 5.3). Gebelikdöneminde SUNUBİS kullanılırsa veya hasta SUNUBİS tedavisi sırasında gebe kalırsa; hasta,ilacın fetüs üzerindeki potansiyel zararlı etkisi konusunda uyarılmalıdır. Laktasyon dönemiSunitinib ve/veya metabolitleri sıçan sütüne geçmektedir. Sunitinib veya onun primer aktif metabolitinin, insan sütüne geçip geçmediği bilinmemektedir. İlaçların genelde insan sütünegeçmesi ve emzirilen bebekler üzerinde ciddi advers etki potansiyeli nedeniyle SUNUBİStedavisi sırasında emzirme durdurulmalıdır. Üreme yeteneği/FertiliteKlinik dışı bulgulara dayalı olarak, erkek ve dişi fertilitesi sunitinib tedavisinden etkilenebilir (bkz. Bölüm 5.3). 4.7. Araç ve makine kullanımı üzerindeki etkilerSUNUBİS araç ve makine kullanımı yeteneği üzerinde minör etkilere sahiptir. Hastalar SUNUBİS ile tedavi sırasında baş dönmesi olabileceği konusunda uyarılmalıdır. 4.8. İstenmeyen etkilerSunitinib ile ilişkilendirilen ve bazıları ölümcül olan en önemli ciddi advers etkiler böbrek yetmezliği, kalp yetmezliği, pulmoner emboli, gastrointestinal perforasyon ve hemorajidir(örn. solunum yolları, gastointestinal, tümör, idrar yolları ve beyin hemorajileri). Herhangi birderecedeki en yaygın advers etkiler (RHK, GİST ve pNET çalışmalarındaki hastalardagörülen) iştahta azalma, tat alma bozuklukları, hipertansiyon, bitkinlik, gastrointestinalbozukluklar (örn. diyare, bulantı, stomatit, dispepsi ve kusma), ciltte renk farklılaşması vepalmar-plantar eritrodizestezi sendromudur. Bu semptomlar tedavi devam ederkenhafifleyebilir. Hipotirodizm tedavi esnasında ortaya çıkabilir. Hematolojik rahatsızlıklar (örn.nötropeni, trombositopeni ve anemi) çok yaygın advers etkilerdendir. Bölüm 4.4 ve 4.8'de belirtilen advers etkiler dışında sunitinib tedavisi ile ilgili olması olası olan ölümcül olaylar çoklu organ yetmezliği, disemine intravasküler koagülasyon, peritonealhemoraji, adrenal yetmezlik, pnömotoraks, şok ve ani ölümdür. 7115 kişilik bir veri setinden GİST, mRHK ve pNET hastalarında bildirilen advers reaksiyonlar, sistem, organ, sınıf ve sıklık derecesine göre aşağıda listelenmiştir. Klinikçalışmalarda belirlenen pazarlama sonrası yan etkiler de yer almaktadır. Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1.000 ila<1/100), seyrek (>1/10.000 ila <1/1.000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketletahmin edilemiyor) olarak tanımlanmaktadır. Enfeksiyonlar ve enfestasyonlarYaygın: Viral enfeksiyonlar^ solunum enfeksiyonları13*, abselerc*, mantar enfeksiyonlarıd, idrar yolu enfeksiyonları, deri enfeksiyonlarıe, sepsis^ Yaygın olmayan: Nekrotizan fasiitis*, bakteriyel enfeksiyonlar® 9 Kan ve lenf sistemi hastalıklarıÇok Yaygın: Anemi, trombositopeni, nötropeni, lökopeniYaygın: Lenfopeni Yaygın olmayan: Pansitopeni Seyrek: Trombotik mikroanjiyopatih* Bağışıklık sistemi hastalıklarıYaygın olmayan: Hipersensitivite Seyrek: Anjiyoödem Endokrin hastalıklarıÇok Yaygın: Hipotiroidizm Yaygın olmayan: HipertiroidizmSeyrek: Tiroidit Metabolizma ve beslenme hastalıklarıÇok Yaygın: İştahsızlık1 Seyrek: Tümör lizis sendromu* Psikiyatrik hastalıklarÇok Yaygın: Uykusuzluk Yaygın: Depresyon Sinir sistemi hastalıklarıÇok Yaygın: Sersemlik, baş ağrısı, tat alma bozukluklar!Yaygın: Parestezi, periferal nöropati, hipoestezi, hiperestezi Yaygın olmayan: Serebral hemoraji*, serebrovasküler olay*, geçici iskemik atak Seyrek: Geri dönüşlü posterior ensefalopati sendromu* Göz hastalıklarıYaygın: Periorbital ödem, lakrimasyon artışı, göz kapağında ödem Kardiyak hastalıklarYaygın: Miyokardiyal iskemik*, ejeksiyon fraksiyonunda azalma1Yaygın olmayan: Miyokardiyal enfarktüsm*, kalp yetmezliği*, konjestif kalp yetmezliği, kardiyomiyopati*, perikard efüzyonu, elektrokardiyogramda QT uzamasıSeyrek: Sol ventriküler yetmezlik*, Torsades de pointes Vasküler hastalıklarÇok Yaygın: HipertansiyonYaygın: Derin ven trombozu, sıcak basma, yüzün kızarması Yaygın olmayan: Tümör hemoraji* Bilinmiyor: Anevrizmalar ve arter diseksiyonları* Solunum, göğüs hastalıkları ve mediastinal hastalıklarÇok Yaygın: Burun kanaması, dispne, öksürükYaygın: Pulmoner emboli*, plevral efüzyon*, hemoptizi, orofarengeal ağrın, nazal konjesyon, burunda kuruluk, efor dispnesi Yaygın olmayan: Pulmoner hemoraji*, solunum yetmezliği* 10 Gastrointestinal hastalıklarÇok Yaygın: Stomatit0, abdominal ağrıp, kusma, diyare, dispepsi, mide bulantısı, kabızlık Yaygın: Gastro-özofageal reflü hastalığı, disfaji, gastrointestinal hemoraji*, özofajit*,abdominal distansiyon, abdominal rahatsızlık, rektal hemoraji, diş eti kanaması, ağız ülseri,proktalji, keilitis, hemoroid, glossodini, oral ağrı, gaz, ağız kuruluğu, ağızda rahatsızlık hissi,geğirmeYaygın olmayan: Gastrointestinal perforasyonq*, pankreatit, anal fistül, kolitrHepato-biliyer hastalıklar Yaygın olmayan: Karaciğer yetmezliği , kolesistits , karaciğer fonksiyon anormallikleri Seyrek: Hepatit Deri ve derialtı doku hastalıklarıÇok Yaygın: Ciltte renk değişikliği1, palmar-plantar eritrodizestezi sendromu, döküntüu, saç renginde değişim, cilt kuruluğuYaygın: Ciltte soyulma, deri reaksiyonuv, egzema, su toplaması, eritem, saç dökülmesi, akne, prurit, cilt hiperpigmentasyonu, deride lezyon, hiperkeratoz, dermatit, tırnak bozukluklarıwSeyrek: Eritema multiforme*, Stevens-Johnson sendromu*, gangrenli piyodermi, toksikepidermal nekroz* Kas-iskelet hastalıkları, bağ dokusu ve kemik hastalıklarıÇok Yaygın: Ekstremitelerde ağrı, eklemlerde ağrı, sırt ağrısı Yaygın: Kas iskelet ağrısı, kas güçsüzlüğü, miyalji, kas spazmıYaygın olmayan: Çenede osteonekroz, fistül*Seyrek: Rabdomiyoliz*, miyopati Böbrek ve idrar yolu hastalıklarıYaygın: Kromatüri, böbrek yetmezliği*, akut böbrek yetmezliği*, proteinüri Yaygın olmayan: İdrar yolunda hemorajiSeyrek: Nefrotik sendrom Genel hastalıklar ve uygulama bölgesine ilişkin hastalıklarÇok Yaygın: Mukozal inflamasyon, bitkinlikx, ödemy, ateş Yaygın: Göğüs ağrısı, ağrı, grip benzeri belirtiler, ürpermeYaygın olmayan: Yara iyileşmesinde gecikme AraştırmalarYaygın: Kilo kaybı, beyaz kan hücresi sayısında azalma, lipaz artışı, trombosit sayısında azalma, hemoglobin azalması, amilaz artışı2, aspartat amino transferazda artış, alanin aminotransferaz artışı, kanda kreatinin artışı, kan basıncı artışı, kanda ürik asit artışıYaygın olmayan: Kanda kreatin fosfokinaz artışı, kanda tiroid stimülan hormon (TSH) artışı *Ölümcül olayları içermektedir Aşağıdaki terimler birleştirilmiştir:aNasofaranjit ve oral herpes bBronşit, alt solunum yolu enfeksiyonu, pnömoni ve solunum yolu enfeksiyonu cApseler, eklemli organlarda apseler, anal apseler, diş eti apseleri, karaciğer apsesi, pankreatikapseler, perineal apseler, perirektal apseler, rektal apseler, subkutan apseler ve diş apseleridÖzofaringal kandidiyaz, oral kandidiyazeSelülit, deri enfeksiyonları 11 uPsöriyaziform dermatit, eksfoliyatif döküntü, döküntü, eritrematöz döküntü, foliküler döküntü, generalize döküntü, maküler döküntü, makülo papüler döküntü, papüler döküntü,pruritik döküntü yYüz ödemi, ödem ve periferal ödem zAmilaz ve amilaz artışı Seçilmiş advers etkilerin tanımları: Enfeksiyonlar ve enfestasyonlarBazı olgularda, nötropeninin eşlik ettiği veya etmediği kimileri ölümcül olan ciddi enfeksiyonlar rapor edilmiştir. Bazen fatal olabilen, perineumunki de dahil olmak üzerenekrotizan fasiit gözlenmiştir (bkz. Bölüm 4.4). Kan ve lenf sistemi bozukluklarıGrade 3 ve 4 şiddetindeki olgularda azalmış mutlak nötrofil sayısı, faz III GİST çalışmasındaki hastaların sırasıyla %10 ve %1,7'sinde, faz III mRHK çalışmasındakihastaların %16 ve %1,6'sında ve faz III pNET çalışmasındaki hastaların %13 ve %2,4'ündebildirilmiştir. Grade 3 ve 4 şiddetindeki olgularda azalmış trombosit sayısı, faz III GİSTçalışmasındaki hastaların sırasıyla %3,7 ve %0,4'ünde, faz III mRHK çalışmasındakihastaların %8,2 ve %1,1'inde ve faz III pNET çalışmasındaki hastaların %3,7 ve %1,2'sindebildirilmiştir (bkz. Bölüm 4.4). Bir faz III GİST çalışmasında, plasebo alan hastaların %17'sine karşılık, sunitinib alan hastaların %18'inde kanama bulguları oluşmuştur. Daha önceden tedavi almamış mRHKhastalarında, interferon-a (IFN-a) alan hastaların %11'ine karşılık, sunitinib alan hastaların%39'u kanama bulguları göstermiştir. IFN-a grubundaki hastaların 5'ine (%1,7) karşı,sunitinib kullananlardan 17 (%4,5) hasta Grade 3 kanama bulgusu göstermiştir. Sitokin-refrakter mRHK için sunitinib alan hastaların %26'sında kanama gözlenmiştir. Faz III pNETçalışmasında plasebo kullanan hastaların %9,85'ine kıyasla sunitinib kullanan hastaların%21,7'sinde burun kanaması dışında kanama olayları gözlenmiştir (bkz. Bölüm 4.4). 12 Klinik araştırmalarda GİST'i olan hastaların yaklaşık %2'sinde tümör hemorajisi meydana gelmiştir. Bağışıklık sistemi bozukluklarıAnjiyoödemi de içeren aşırı duyarlılık reaksiyonları raporlanmıştır (bkz. Bölüm 4.4). Endokrin hastalıklarıDaha önceden tedavi almamış hastalarla yapılan bir mRHK çalışmasında, sunitinib kullanan hastaların 61'inde (%16) ve IFN-a kolunda 3 hastada (<%1) ve sitokine- refrakter hastalarlayapılan iki mRHK çalışmasında hastaların 7'sinde (%4) advers etki olarak hipotiroidizm raporedilmiştir. Ayrıca, sitokin-refrakter mRHK hastaların 4 (%2) tanesinde TSH yükselmeleri rapor edilmiştir. Sonuç olarak, mRHK popülasyonunun %7'sinde, tedaviyle ortaya çıkanhipotiroidizmin klinik ve laboratuvar kanıtı vardır. Gelişen hipotiroidizm sunitinib kullananGİST'i olan hastaların %6,2'sinde görülürken bu oran plasebo kullanan hastalarda %1'dir. FazIII pNET çalışmasında sunitinib alan 6 hastada (%7,2) ve plasebo alan bir hastada (%1,2)hipotiroidizm bildirilmiştir. Meme kanseri olan hastalardaki prospektif olarak yürütülen iki çalışmada tiroid fonksiyonu izlendi; sunitinibin meme kanserinde kullanımı onaylanmamıştır. Bir çalışmada, sunitinib alan15 (%13,6) hastada ve standard bakım gören 3 (%2,9) hastada hipotiroidizm raporlanmıştır.Kan TSH'sinde artış, sunitinib alan 1 (%0,9) hastada bildirilmiş ve standart bakım görenkimsede rastlanmamıştır. Hipertiroidizm, sunitinib ile tedavi edilen herhangi bir hastadaraporlanmamıştır ve standard bakım gören 1 hastada (%1,0) raporlanmıştır. Bir diğerçalışmada; hipotiroidizm, sunitinib alan toplam 31 (%13) hastada ve kapesitabin alan 2 (%0,8)hastada bildirilmiştr. Kan TSH artışı, sunitinib alan 12 (%5,0) hastada bildirilmiştir vekapesitabin alan hiçbir hastada görülmemiştir. Hipertiroidizm, sunitinib alan 4 (%1,7) hastadabildirildi ve kapesitabin alan hiçbir hastada bildirilmemiştir. Kan TSH düşüşü, sunitinib alan 3(%1,3) hastada bildirilmiştir ve kapesitabin alan hiçbir hastada bildirilmemiştir. T4 artışı,sunitinib alan 2 (%0,8) hastada bildirilmiştir ve kapesitabin alan 1 (%0,4) hastadabildirilmiştir. T3 artışı, sunitinib alan 1 (%0,8) hastada ve kapesitabin alan hiçbir hastadabildirilmemiştir. Bildirilen tüm tiroid-ilişkili olaylar Grade 1 ve 2'de olmuştur (bkz. Bölüm4.4). Metabolizma ve beslenme bozukluklarımRHK ve GİST hastaları ile karşılaştırıldığında pNET hastalarında daha fazla sıklıkta hipoglisemi olayları rapor edilmiştir. Yine de klinik çalışmalarda gözlemlenen bu yan etkilerinçoğunun çalışma tedavisi ile ilgili olduğu düşünülmemiştir (bkz. Bölüm 4.4). Sinir sistemi bozukluklarıSunitinib'in klinik çalışmalarında ve pazarlama sonrası deneyimlerinde, geri dönüşümlü posterior lökoensefalopati'nin nöbet ve radyolojik kanıtı bulunan hastalarda, kimisi ölümcülolan az sayıda (<%1) bildirim olmuştur. Beyin metastazına ait radyolojik kanıtı olan veyaolmayan hastalarda nöbet gözlemlenmiştir (bkz. Bölüm 4.4). Kardiyak bozukluklarSunitinib ile tedavi gören GİST'i olan hastaların yaklaşık %2'sinde, sitokine refrakter mRHK hastalarının %4'ünde ve plasebo ile tedavi gören hastaların %2'sinde, sol ventrikül ejeksiyonfraksiyonunda (SVEF) normalin en düşük sınırının altında ve %20'den daha fazla azalmalar 13 olmuştur. SVEF'deki bu düşüşler düzenli bir progresyon göstermeyip, sıklıkla tedavinin devamında iyileşmeyle sonuçlanmıştır. Daha önceden tedavi almamış mRHK çalışmasında,sunitinib ve IFN-a'daki hastaların sırasıyla, %27'si ve %15'i, normalin alt sınırının altında birSVEF değeri göstermiştir. Sunitinib alan iki hastada (<%1) konjestif kalp yetmezliği (KKY)teşhis edilmiştir. GİST hastalarının %1,2'sinde ve plasebo ile tedavi gören hastaların %1'inde 'kalp yetmezliği', 'konjestif kalp yetmezliği veya 'sol ventrikül yetmezliği' gibi advers olaylar bildirilmiştir.Pivotal faz III GİST çalışmasında (n=312) tedaviye bağlı ölümcül kardiyak reaksiyonlarçalışmanın her iki kolunda (sunitinib ve plasebo) %1 oranında görülmüştür. Sitokine refraktermRHK hastalarında yapılan faz II çalışmada hastalardan %0,9'unda tedaviye bağlı ölümcülmiyokard enfarktüsü görülürken daha önceden tedavi almamış mRHK hastalarında yapılanfaz III çalışmada IFN-a alan hastaların %0,6'sında ölümcül kardiyak olaylar görülmüş olupsunitinib alan hastalarda bu oran %0'dır. Faz III pNET çalışmasında, sunitinib alan bir (%1)hastada tedavi ile ilişkili fatal kalp yetmezliği meydana gelmiştir. Vasküler hastalıklarHipertansiyon: Hipertansiyon klinik çalışmalarda çok yaygın olarak bildirilmiştir. Bu hasta popülasyonunun yaklaşık %2,7'sinde sunitinib dozu azaltılmış veya geçici olarakertelenmiştir. Bu hastaların hiçbirinde sunitinib ile tedaviye son verilmemiştir. Bu hastapopülasyonunun yaklaşık %4,7'sinde ciddi hipertansiyon (>200 mmHg sistolik veya 110mmHg diyastolik) meydana gelmiştir. Hipertansiyon, daha önceden tedavi görmemiş mRHKiçin IFN-a alan hastaların %3,6'sına karşılık, sunitinib alan hastaların yaklaşık %33,9'undarapor edilmiştir. Ciddi hipertansiyon, önceden tedavi edilmemiş sunitinib hastalarının%12'sinde ve IFN-a alan hastaların %1'inden azında oluşmuştur. Faz III pNET çalışmasındahipertansiyon plasebo alan hastaların %4,9'unda raporlanmışken sunitinib alan hastalarda buoran %26,5'dir. pNET olan hastalarda şiddetli hipertansiyon, sunitinib alanların %10'unda veplasebo alanların %3'ünde meydana gelmiştir. Venöz tromboembolik olaylar: GİST ve mRHK dahil olmak üzere yapılan klinik çalışmalarda sunitinib alan solid tümörlü hastaların yaklaşık %1'inde tedaviye bağlı venöz tromboembolikolaylar raporlanmıştır. Bir faz III GİST çalışmasında plasebo alan herhangi bir hastada venöz tromboembolik olay tespit edilmemesine karşın sunitinib alan yedi hastada (%3) venöz tromboembolik olay tespitedilmiştir: bu yedi hastanın beşinde, Grade 3 derin ven trombozu (DVT) ve ikisinde Grade 1ya da 2 derin ven trombozu (DVT) gelişmiştir. Bu yedi GİST hastasının dördünde, ilk DVTincelemesini takiben tedavi kesilmiştir. Tedavi görmemiş mRHK hastalarında yapılan faz III çalışmada sunitinib alan on üç hastada (%3) ve iki sitokine refrakter mRHK çalışmasındaki dört hastada (%2) venöz trombolik olayraporlanmıştır. Bu hastaların dokuzunda pulmoner emboli mevcut olup, birinde Grade 2, diğersekiz tanesinde ise Grade 4 derecesindedir. Bu hastalardan 8'inde birinde Grade 1, ikisindeGrade 2, dördünde Grade 3 ve birinde Grade 4 derecesinde olmak üzere DVT bulunmaktadır.Sitokine refrakter mRHK çalışmasındaki pulmoner embolisi mevcut olan bir hastada dozkesilmesine gerek duyulmuştur. IFN-a alan tedavi görmemiş mRHK hastalarının altısında (%2), venöz tromboembolik olaylar gözlenmiştir; bir hastada (<%1) Grade 3 DVT ve beş hastanın (%1) hepsinde Grade 4 olanpulmoner emboli görülmüştür. 14 Faz III pNET çalışmasında sunitinib alan 1 hastada (%1,2) ve plasebo alan 5 hastada (%6,1) venöz tromboembolik olaylar bildirilmiştir. Plasebo kullanan 2 hastada biri Grade 2 biri Grade3 olmak üzere DVT bulunmaktadır. GİST, mRHK ve pNET çalışmalarının hiç birinde ölümcül bir olgu bildirilmemiştir. Ölüm ile sonuçlanan olgular pazarlama sonrası görülmüştür. Faz III çalışmalarında sunitinib alan GİST hastalarının yaklaşık %3,1'inde ve mRHK hastalarının yaklaşık %1,2'sinde pulmoner emboli olguları gözlenmiştir. Faz IIIçalışmalarında sunitinib alan pNET hastalarında pulmoner emboli görülmemiştir. Pazarlamasonrası çalışmalarda ölümle sonuçlanan seyrek olgular gözlenmiştir. Sunitinib uygulamasından önce 12 ay içinde pulmoner emboli yaşayan hastalar sunitinib klinik çalışmalarına dahil edilmemiştir. Faz III çalışmalarında sunitinib alan hastalardan, GİST hastalarının yaklaşık %17,8'inde, mRHK hastalarının yaklaşık %26,7'sinde ve pNET hastalarının %12'sinde pulmoner olaylar(dispne, plevral efüzyon, pulmoner emboli veya pulmoner ödem gibi) bildirilmiştir. Klinik çalışmalarda sunitinib alan GİST ve mRHK hastaları dahil solid tümörlü hastaların yaklaşık %22,2'sinde pulmoner olaylar gözlemlenmiştir. Gastrointestinal bozukluklarGİST veya mRHK tedavisi için sunitinib alan hastalarda nadiren (%1'inden az) pankreatit görülmüştür. Faz III pNET çalışmasında tedavi ile ilişkili pankreatit bildirilmemiştir (bkz.Bölüm 4.4). Bir faz III GİST çalışmasında plasebo alan hastaların %0,98'inde ölümcül gastrointestinal kanama görülmüştür. Hepato-biliyer bozukluklarKaraciğer fonksiyon testi anormalliklerini, hepatit veya karaciğer yetmezliğini içerebilen hepatik disfonksiyon bildirilmiştir (bkz. Bölüm 4.4). Deri ve deri altı doku hastalıklarıİlacın bırakılmasıyla geri dönüşlü olan piyoderma gangrenosum (ağrılı deri ülseri) bildirilmiştir (bkz. Bölüm 4.4). Kas-iskelet sistemi ve bağ dokusu bozukluklarıBazıları akut böbrek yetmezliği ile birlikte olan miyopati ve/veya rabdomiyoliz olguları rapor edilmiştir. Kas toksisitesinin belirtileri veya semptomları görülen hastaların bakımları standarttıbbi uygulamalar doğrultusunda yapılmalıdır (bkz. Bölüm 4.4). Bazı olgularda ölümle sonuçlanan, bazen tümör nekrozu ve regresyonu ile bazen ilişkili olan fistül oluşumu rapor edilmiştir (bkz. Bölüm 4.4). Sunitinib ile tedavi edilen kanser hastalarında çene osteonekrozu olguları bildirilmiştir; olguların çoğu daha önceden veya eş zamanlı olarak i.v. bisfosfonat tedavisi almışlardırve/veya invazif dental işlemler gerektiren dental hastalık hikayesine sahiptirler ve bu durumlarçene osteonekrozu için belirlenmiş risk faktörleridir (bkz. Bölüm 4.4). 15 AraştırmalarKlinik olmayan çalışmalardan (in vitro ve in vivo)elde edilen veriler, önerilen insan dozunun üzerindeki dozlarda sunitinibin kalp aksiyon potansiyelinin repolarizasyon sürecini inhibeettiğini yani QT uzamasına neden olduğunu ortaya koymaktadır.Solid tümörlü 450 hastanın %1,1'inde 60 msn'den fazla sürede başlangıca kıyasla değişimler ve %0,5'inde ise QTc aralığında 500 msn'yi aşan artışlar meydana gelmiştir; buparametrelerin her ikisi de potansiyel anlamlı değişiklikler olarak kabul edilmiştir. Yaklaşıkolarak terapötik konsantrasyonun iki katında sunitinibin QTkF (Frederika konsantrasyonu)aralığını uzattığı gösterilmiştir. QT aralığı uzaması, ilerlemiş maligniteli 20-87 yaşları arasında 24 hastanın katıldığı bir deney ile araştırılmıştır. Bu çalışmanın terapötik konsantrasyonlarda (3. gün) baseline correctionmetodu kullanılarak ve terapötik dozdan daha fazla (9. gün) dozda her iki başlangıç düzeltmemetodu kullanılarak elde edilen sonuçları sunitinibin QT aralığı (%90 GA, üst limit >15 msnile ortalama plasebo ayarlı değişiklik >10 msn olarak tanımlanmıştır) üzerinde etkisi olduğunugöstermiştir. Hiçbir hastanın QT aralığı >500 msn değildir. 3. günde dozdan 24 saat sonra(yani 50 mg'lik önerilen başlangıç dozundan sonra beklenen terapötik plazmakonsantrasyonunda) baseline correction metodu kullanılarak QTcF aralığı üzerinde bir etkigözlenmiş olmasına rağmen bu bulgunun klinik olarak önemi belirsizdir. Terapötik doza ya da terapötik maruz kalmadan daha büyük doza karşılık gelen zamanlarda kapsamlı bir seri EKG değerlendirmesi yapıldığında değerlendirilebilir veya tedavisiamaçlanan hasta (ITT) grubundan hiçbirinde görülen QT aralığında uzama ciddi (yani yanetkiler için ortak terminoloji kriteri (CTCAE) versiyon 3.0'a göre Grade 3'e eşit veya büyük)değildir. Tedavi edici plazma konsantrasyonlarında, başlangıca göre maksimum ortalama QTcF değişikliği 9 msn (%90 GA: 15,1 msn) olmuştur. Tedavi edici konsantrasyonların yaklaşıkolarak iki katında, başlangıca göre maksimum QTcF ortalama değişikliği 15,4 msn (%90 GA:22,4 msn) olmuştur. Bir pozitif kontrol olarak kullanılan moksifloksasin (400 mg), başlangıcagöre 5,6 msn'lik bir maksimum ortalama QTcF değişikliği göstermiştir. Herhangi bir hastadaGrade 2'den (CTCAE v.3.0) daha büyük QTc aralığı gözlenmemiştir (bkz. Bölüm 4.4). mRHK'da uzun dönem güvenlilikmRHK hastalarında sunitinibin uzun dönem güvenliliği; ilk basamak; bevasizumab-refrakter ve sitokin-refrakter tedavi rejimlerinde 5739 hastaya ait verilere dayanarak (bu hastaların807'si (%14) >2 yıldan 6 yıla kadar tedavi görmüştür) tamamlanmış 9 klinik çalışmaya dahilolan hastalar analiz edilmiştir. Uzun dönem sunitinib tedavisi alan 807 hastada; 6 yıllıkperiyod boyunca yeni vaka olarak ortaya çıkabilen ve zaman içinde artan hipotiroidi hariçolmak üzere; tedavi ile ilişkili advers olayların (TİAO) çoğu öncelikle ilk 6 ay-1 yıldaoluşmuş ve sonrasında stabil seyretmiş ya da zamanla sıklıkta azalma göstermiştir. Sunitinibile uzatılmış tedavi yeni TİAO tipleri ile ilişkili görünmemektedir. Özel popülasyonlara ilişkin ek bilgiler:Pediyatrik popülasyon:Sunitinib'in güvenlilik profili, aşağıda açıklandığı gibi bir faz I doz arttırma çalışmasından, bir faz II açık etiketli çalışmadan, bir faz 1/2 tek kollu çalışmadan ve yayınlardan eldeedilmiştir. 16 Refrakter solid tümörleri olup, büyük bölümü primer beyin tümörü tanısıyla katılan 35 hastada; 30'u pediyatrik hastalardan (3-17 yaş) ve 5'i genç erişkin hastalardan (18-21 yaş)oluşan, oral sunitinibe ilişkin bir faz I doz artış çalışması gerçekleştirilmiştir. Çalışmayakatılan herkeste yan etkiler gözlemlenmiştir; kardiyak toksisite de dahil bu yan etkilerin çoğuciddidir (toksisite grade >3). En yaygın görülen yan etkiler, gastrointestinal (GI) toksisite,nötropeni, halsizlik ve ALT yükselmesidir. Kardiyak yan etki riski daha öncedenantrasiklinlere veya kardiyak irradyasyona maruz kalmış pediyatrik hastalarda kalmamışlaraoranla daha yüksek olmuştur. Daha önceden antrasiklinlere veya kardiyak irradyasyona maruzkalmasından bağımsız olarak bu pediyatrik hastalarda maksimum tolere edilen doz (MTD)tanımlanmıştır (bkz. Bölüm 5.1). Reküran/progresif/refrakter ileri dereceli gliomu (HGG) veya epandimomu bulunan, 27'si pediyatrik (3-16 yaş) ve 2'si genç erişkin hastadan (18-19 yaş) oluşan 29 hastada, faz II açıketiketli bir çalışma gerçekleştirilmiştir. Her iki grupta da Grade 5 advers reaksiyongörülmemiştir. En yaygın (>%10) tedaviye bağlı advers reaksiyonlar nötrofil sayısınınazalması (6 [%20,7] hasta) ve intrakraniyal hemoraji (3 [%10,3] hasta) olmuştur. İleri anrezektabl GİST'i olan 6 pediyatrik hastada (13-16 yaş) Faz 1/2 tek kollu bir çalışma yapılmıştır. En sık görülen advers ilaç reaksiyonları, diyare, mide bulantısı, beyaz kan hücresisayısında azalma, nötropeni ve baş ağrısı olmuştur ve her biri 3 (%50) hastada primer olarakGrade 1 veya 2 seviyesinde görülmüştür. 6 hastadan 4'ünde (%66,7) Grade 3-4 tedaviye bağlıadvers reaksiyon (Grade 3 hipofosfatemi, nötropeni ve trombositopenin her biri 1 hastada ve 1hastada Grade 4 nötropeni) görülmüştür. Bu çalışmada ciddi advers reaksiyonlar (SAEler)veya Grade 5 advers reaksiyonlar bildirilmemiştir. Hem klinik çalışmada hem de yayınlarda,güvenlilik profili yetişkinlerde bilinen güvenlilik profili ile uyumlu olmuştur. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM) 'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99) 4.9. Doz aşımı ve tedavisiSunitinib kullanımında doz aşımının tedavisi için spesifik bir antidot yoktur ve doz aşımı tedavisi için genel destekleyici ölçümler gerekmektedir. Endike ise, emilmemiş ilacıneliminasyonu emesis ve gastrik lavaj ile yapılabilir. Doz aşımı olguları bildirilmiştir; bazıolgular sunitinibin bilinen güvenlilik profiliyle uyumlu olan advers olaylarla ilişkilidir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Antinoeplastik ilaçlar, protein kinaz inhibitörleri ATC kodu: L01EX01 Sunitinib; tümör gelişiminde, neoanjiyogenezde ve kanserin metastatik progresyonunda rol oynayan bir çok tirozin kinaz reseptörünü (TKR) inhibe eder. Sunitinib trombosit kaynaklıbüyüme faktörü reseptörleri (PDGFRa ve PDGFRP), VEGF reseptörleri (VEGFR1, VEGFR2 17 ve VEGFR3), kök hücre faktör reseptörü (KIT), Fms-tipi tirozin kinaz-3 (FLT3), koloni uyarıcı faktör reseptörü (CSF- 1R) ve glial hücre kaynaklı nörotrofik faktör reseptörünün(RET) inhibitörü olarak tanımlanmıştır. Başlıca metaboliti olan desetil sunitinibin,biyokimyasal ve hücresel testlerde sunitinibe benzer etkide olduğu gösterilmiştir. Klinik Çalışmalar Sunitinibin klinik güvenlilik ve etkililiği imatinibe toleransı olmayan veya imatinib rezistan olan (imatinib tedavisi süresince veya sonrasında hastalık progresyonu görülen) maligngastrointestinal stromal tümörlü (GİST) hastaların tedavisinde ve metastatik renal hücrekarsinomlu (mRHK) hastaların tedavisinde ve anrezektabl pNET olan hastaların tedavisindearaştırılmıştır. Etkililik; GİST'de tümör progresyonuna kadar geçen süreyi (TTP) ve sağkalımdaki artışı, tedavi uygulanmamış mRHK için progresyonsuz sağkalımı ve sitokine dirençli mRHK içinobjektif yanıt oranlarını, pNET için de progresyonsuz sağkalımı temel almıştır. Gastrointestinal Stromal Tümörler (GİST) İmatinibe (medyan maksimum günlük doz 800 mg) dirençli ve intoleransı olmasından dolayı GİST tedavisinde başarısız olunan hastalarda açık etiketli, doz ayarlama çalışmasıgerçekleştirilmiştir. Çalışmaya ilacı farklı doz ve doz şeması uygulanan sürelerde uygulayan97 adet hasta dahil edilmiştir; bunlardan 55'i ilacı önerilen tedavi süresi olan 4 hafta kullanıp,2 hafta ara vermek suretiyle (4/2 şeması) 50 mg olarak almıştır. Bu çalışmada medyan TTP34,0 haftadır (%95 GA = 22,0 hafta-46,0 hafta). İmatinibi tolere edemeyen veya imatinib (medyan maksimum günlük doz 800 mg) ile tedavi esnasında veya sonrasında hastalık progresyonu görülen GİST'i olan hastalarda randomize,çift-kör ve plasebo-kontrollü bir faz III çalışma gerçekleştirilmiştir. Bu çalışmada 312 hasta,hastalık progresyonu veya çalışmadan başka bir sebeple çekilme olmadığı sürece 50 mgsunitinib veya plaseboyu ağızdan günde bir kez ve 4/2 şemasına göre alacak şekilderandomize (2:1) edilmiştir (hastaların 207'si sunitinib, 105'i plasebo almıştır). Çalışmanınprimer etkililik sonlanım noktası, randomizasyondan objektif tümör progresyona kadar geçensüre olarak tanımlanan TTP idi. Önceden belirlenen ara dönem analizinde, sunitinib için medyan TTP (progresyona kadar geçen süre) araştırmacı değerlendirmesinde 28,9 hafta (%95 GA=21,3-34,1 hafta) ve bağımsızdeğerlendirmeye göre 27,3 hafta (%95 GA=16,0-32,1) olup, plasebo kolundaki araştırmacıdeğerlendirmesine göre 5,1 haftalık (%95 GA=4,4-10,1), bağımsız değerlendirmedeki 6,4haftalık (%95 GA=4,4-10,0) TTP'den istatistiksel anlamlı olarak daha uzun olmuştur. Genelsağkalım (OS)'deki fark istatistiksel olarak sunitinib lehinedir [HR: 0,491 (%95 GA:0,290-0,831)]. Ölüm riski sunitinib koluyla karşılaştırıldığında plasebo kolunda 2 kat fazladır. Etkililik ve güvenlilik interim analiz sonuçları sonrası çalışma körlemeden çıkarılmış ve plasebo kolundaki hastalara açık etiketli sunitinib tedavisi önerilmiştir. Başta plasebo alan 99 hastada dahil çalışmanın açık etiketli tedavi fazında toplam 255 hasta sunitinib almıştır. Çalışmanın açık etiket fazındaki primer ve sekonder sonlanım noktası analizleri zamanında elde edilen interim analiz sonuçlarını doğrulamıştır (bkz. Tablo 1). 18
ITT popülasyonundaki medyan OS sunitinib ve plasebo kollarında sırasıyla 72,7 hafta ve 64,9 haftadır (HR 0,876, %95 GA: 0,679-1,129, p = 0,306). Bu analizde plasebo kolu dahaönceden açık etiketli sunitinib tedavisi almış ve plaseboya randomize edilmiş hastalarıiçermektedir. Tedavi edilmemiş renal hücreli karsinomu (mRHK) Tedavi-edilmemiş mRHK'li hastalarda tek ajan olarak sunitinib ve IFN-a'yı karşılaştıran bir faz III randomize çalışma yapılmıştır. Yedi yüz elli (750) hasta ya sunitinib ile tekrarlayan 6haftalık siklüsler halinde 4 hafta 50 mg günlük oral doz takiben 2 hafta dinlenme (4/2 dozşeması) veya ilk hafta 3 milyon ünite (MU) ikinci hafta 6 MU ve üçüncü hafta 9 MU vebundan sonra her hafta ardışık olmayan günlerde subkütan olarak IFN-a almak üzererandomize edilmiştir (1:1). Sunitinib tedavisinin medyan süresi 11,1 ay (0,4-46,1 aralığında), IFN-a tedavisinin medyan süresi ise 4,1 aydır (0,1-45,6 aralığında). Tedavi ile alakalı ciddi yan etkiler sunitinib ve IFN-aalan hastalarda sırasıyla %23,7 ve %6,9 olarak raporlanmıştır. Bunun yanında yan etkilerdendolayı tedavinin yarım bırakılma oranı sunitinib için %20 iken IFN-a için %23'dür. Dozkesilmesi sunitinib kullanan 202 hastada (%54) görülmüşken IFN-a kullanan hastalarda busayı 141'dir (%39). Doz azaltılması ise sunitinib ve IFN-a kullanan hastaların sırasıyla 194(%52) ve 98 (%27)'inde görülmüştür. Hastalar progresyon görülene kadar ya da tedaviden 19 çıkarılana kadar tedavi edilmişlerdir. Primer etkililik sonlanım noktası progresyonsuz sağkalımdır (PFS). Planlı bir ara analiz, sunitinib için IFN-a'nın üstünde istatistiksel olarak anlamlı bir avantaj göstermiştir. Buçalışmada medyan PFS sırasıyla 47,3 ve 22,0; HR 0,415'tir. (%95 GA: 0,320-0,539, p<0,001).Diğer sonlanım noktaları objektif yanıt oranı (ORR), OS ve güvenliliktir. Primer sonlanımnoktası elde edildikten sonra çekirdek radyolojik değerlendirmeye devam edilmemiştir. Finalanalizde araştırıcının değerlendirmesi ile ORR sunitinib kolu için %46 (%95 GA: 41-51) IFN-a kolu için %12 (%95 GA: 9-16) olarak belirlenmiştir (p<0,001). IFN-a ile karşılaştırıldığında sunitinib tedavisi daha uzun sağkalım süreleriyle ilişkilendirilmiştir. Medyan OS sunitinib kolu için 114,6 hafta (%95 GA: 100,1-142,9) veIFN-a kolu için 94,9 hafta (%95 GA: 77,7-117,0) olmuştur [HR= 0,821 (%95 GA: 0,6731,001); log-rank testi ile p=0,0510.] ITT popülasyonunda gözlemlenen ve çekirdek radyolojik laboratuvar değerlendirmesine ile belirlenen genel PFS ve OS Tablo 2'de özetlenmiştir: Tablo 2 - Daha önce tedavi edilmemiş mRHK etkililik sonlanım noktası özetleri (ITT popülasyonu)
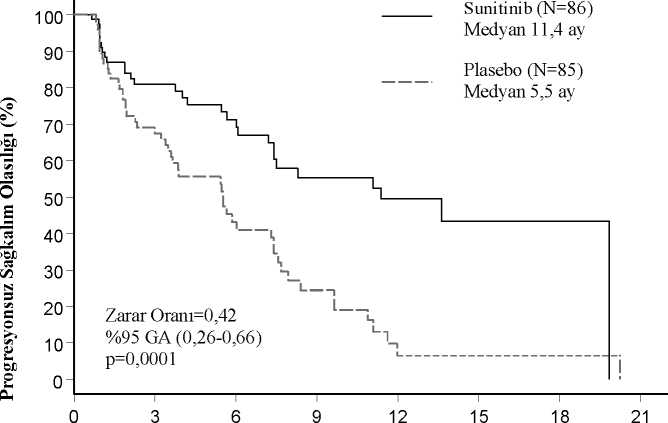
Sitokin-refrakter metastatik renal hücreli karsinom Sunitinib ile bir faz 2 çalışma gerçekleştirilmiştir. Çalışma interleukin-2 ya da IFN-a ile 20 birlikte önceki sitokin tedavisine refrakter hastaları kapsamaktadır. 63 hasta 50 mg oral sunitinib (6 haftalık tamamlanmış siklüs-4 hafta boyunca günde bir kere ve takiben 2 haftadinlenme periyodu (4/2 doz şeması)) ile başlamıştır. Primer sonlanım noktası ORR'dir.RECIST (solid tümörlerde yanıt değerlendirme kriteri) kriterlerine göre belirlenmiştir. Bu çalışmada objektif yanıt oranı %36,5'dır (%95 GA: %24,7-%49,6). Progresyona kadar geçen süre (TTP) 37,7 haftadır (%95 GA: 24,0-46,4 hafta). Açık etiketli, tek kollu, çok merkezli, doğrulayıcı bir çalışmada sunitinibin etkililik ve güvenliliği bir önceki sitokin tedavisine refrakter mRHK hastalarında değerlendirilmiştir. 106hasta 4/2 şemasına göre en az 1 doz 50 mg sunitinib almıştır. Bu çalışmanın primer sonlanım noktası ORR'dir. Sekonder sonlanım noktası TTP, yanıt süresi (DoR) ve OS'yi içermektedir. Bu çalışmada ORR %35,8 (%95 GA: %26,8-%47,5). MedyanDoR'ye ve OS'ye henüz ulaşılamamıştır. Pankreatik nöroendokrin tümörler (pNET) Destekleyici faz 2, açık etiketli, çok merkezli çalışma, rezektabl olmayan pNET'li hastalarda günde tek ajan olarak sunitinibin etkililiğini ve güvenliliğini, 4/2 şemasında [4 haftalık tedavi,2 haftalık dinlenme periyodu, günde bir kere 50 mg] değerlendirdi. 66 hastanın pankreatikadacık hücreli tümör kohortunda birincil sonlanım noktası yanıt oranı %17 idi. Unrezektabl pNET olan hastalarda tek başına sunitinib ile ilgili faz III, çok merkezli, uluslararası, randomize, çift kör plasebo kontrollü bir pivot çalışma yapılmıştır. Hastalar, RECIST'e dayalı olarak, önceki 12 ay içinde belgelenmiş progresyona ihtiyaç duydu ve planlanmış bir istirahat dönemi (n = 86) veya plasebo (n = 85) olmadan, günde bir kez 37,5mg sunitinib almak üzere randomize edildi (1: 1). Primer objektif, plasebo alan hastalara karşı sunitinib alan hastalarda PFS'yi karşılaştırmaktı. Diğer sonlanım noktaları arasında OS, ORR, Hasta Tarafından Bildirilen Sonuçlar ve güvenlikyer almaktadır. Demografik veriler, sunitinib ve plasebo grupları arasında karşılaştırılabilir düzeydeydi. Buna ek olarak, sunitinib hastalarının %49'unda plasebo hastalarının %52'sinde fonksiyonelolmayan tümörler vardı ve her iki kolun %92'sinde karaciğer metastazı vardı. Çalışmada somatostatin analoglarının kullanımına izin verildi. Sunitinib hastalarının toplam %66'sı buna karşın plasebo hastalarının %72'si daha önce sistemik tedavi aldı. Buna ek olarak, sunitinib hastalarının %24'ü plasebo hastalarının ise%22'si somatostatin analogları almıştır. Plaseboya kıyasla sunitinib için araştırmacılar tarafından değerlendirilen PFS'de klinik olarak anlamlı bir avantaj gözlenmiştir. Medyan PFS, sunitinib kolunda 11,4 ay ve plasebo kolunda5,5 ay olmuştur [risk oranı (nispi risk): 0,418 (%95 GA 0,263- 0,662), p = 0,0001]. Hastalığın progresyonunu belirlemek için RECIST'in araştırmacı tümör ölçümleri uygulanmasına dayanan türetilmiş tümör yanıt değerlendirmeleri yapıldığında benzer sonuçlargözlemlenmiştir (Tablo 3). Değerlendirilen temel özelliklerin tüm alt gruplarında, önceki 21 alınan sistemik tedavilerin sayısına göre bir analizi de içerecek şekildesunitinib lehine bir risk oranı gözlenmiştir. Sunitinib kolunda 29 hasta ve plasebo kolunda 24 hasta önceden sistemiktedavi almadı; bu hastalardan PFS için risk oranı 0,365 (%95 GA: 0,156-0,857), p = 0,0156idi. Benzer şekilde, sunitinib kolundaki 57 hastada (28'i önceden bir sistemik terapi ve 29'uönceden 2 veya daha fazla sistemik terapi almış) ve plasebo kolundaki 61 hastada (25'iönceden bir sistemik terapi ve 36'sı önceden 2 veya daha fazla sistemik terapi almış), PFS içinrisk oranı 0,456 (%95 GA: 0,264-0,787), p = 0,0036 idi. Progresyon kararının, araştırmacı tarafından bildirilen tümör ölçümlerine dayandığı, PFS olayı olarak muamele edilen çalışma sonlandırma haricindeki nedenlerle sansürlenmiş tümhastalarda PFS duyarlılık analizi yapıldı. Bu analiz, sunitinibin tedavi etkisinin konservatif birtahminini sağlamış ve 0,507 değerinde bir risk oranı (%95 GA: 0,350- 0,733), p = 0,000193ortaya koyarak birincil analizi desteklemiştir. pNET ile ilgili pivot çalışma, bağımsız bir İlaç İzleme Komitesi'nin önerisi üzerine erken sonlandırılmıştır ve birincil sonlanım noktası, her ikisi de tedavi etkisinin tahminlerinietkilemiş olan araştırmacı değerlendirmesine dayandırılmıştır. PFS'nin araştırmacı temelli değerlendirmesinde yanlılığı bertaraf edebilmek için kör bağımsız merkez incelemesi yapıldı; bu inceleme araştırmacı değerlendirmesini desteklemiştir. Tablo3'te gösterilmiştir. Tablo 3 - Faz III çalışmasından elde edilen nNET etkinliği sonuçları
22 Şekil 1 - pNET Faz 3 çalışmasında, Kaplan Meier Progresyonsuz Sağkalım Grafiği
Kısaltmalar: GA=Güven Aralığı; N=Hasta Sayısı; PFS=Progresyonsuz Sağkalım; pNET=Pankreatik Nöroendokrin TümörOS verileri, çalışma sonunda olgunlaşmamıştır. Sunitinib kolu için [20,6 ay (%95 GA 20,6, NR) verileri, plasebo kolu için NR (%95 GA 15,5, NR) verileri ile karşılaştırıldığında riskoranı: 0,409 (%95 GA: 0,187-0,894), p-değeri = 0,0204]'dır. Sunitinib kolunda 9 ve plasebokolunda 21 ölüm meydana gelmiştir. Hastalık progresyonu sırasında hastalar körleştirilmemiştir ve plasebo alan hastalara, ayrı bir uzantı çalışmasında açık etiketli sunitinibe erişim sunulmuştur. Çalışmanın erken dönemdesonlanması nedeniyle, kalan hastalar körleştirilmemiştir ve bu hastalara, ayrı bir uzantıçalışmasında açık etiketli sunitinibe erişim sağlanmıştır. Plasebo kolundaki 85 hastadan(%69,4) 59'u, hastalığın ilerlemesi veya çalışma sonlanmasındaki körleme kalktıktan sonraaçık etiketli sunitinibe geçti. Uzatma çalışmasında 5 yıllık izlem sonrasında gözlemlenen OS,0,730 (%95 GA 0,504-1,057) risk oranını gösterdi. Avrupa Kanser Araştırma ve Tedavisi Organizasyonu Yaşam Kalitesi Anketinden (EORTC QLQC-30) alınan sonuçlar; toplamda genel sağlık ile ilişkili yaşam kalitesinin ve beşfonksiyon alanının (fiziksel, rol, bilişsel, duygusal ve sosyal), sınırlı advers semptomatiketkilerle, plaseboya karşı sunitinib tedavisi alan hastalarda korunduğunu göstermiştir.Progresif, ileri/metastatik, iyi diferansiye edilmiş, rezeke edilemeyen pNET'li hastalardasunitinibin etkililiğini ve güvenilirliğini değerlendiren faz IV çok uluslu, çok merkezli, tekkollu, açık etiketli bir çalışma gerçekleştirildi. Yüz altı hasta (hiçbir tedavi almamış kohortunda 61 hasta ve sonraki basamak kohortunda 45 hasta) günde bir kez 37,5 mg oral yoldan sunitinib ile kesintisiz günlük dozlama programı iletedavi gördü. Araştırmacı tarafından değerlendirilen progresyonsuz sağkalım hem genel popülasyonda (%95 GA: 10,9-16,7) hem de hiçbir tedavi almamış kohortta (%95 GA: 7,4-16,8) 13,2 ay idi. 23 Özel popülasyonlara ilişkin ek bilgiler:Pediyatrik popülasyon:Pediyatrik hastalarda sunitinib kullanımına ilişkin deneyimler kısıtlıdır (bkz. Bölüm 4.2). Refrakter solid tümörleri olup, büyük bölümü primer beyin tümörü tanısı olan 35 hastada; 30'u pediyatrik hastalardan (3-17 yaş) ve 5'i genç erişkin hastalardan (18-21 yaş) oluşan, oralsunitinibe ilişkin, bir faz I doz artış çalışması gerçekleştirilmiştir. Çalışmanın birinci kısmındadoz kısıtlayıcı kardiyotoksisite gözlenmiş ve bu nedenle önceden potansiyel kardiyotoksiktedaviler (antrasiklinler dahil) veya kardiyak radyasyon uygulanan hastalar dışlanacak şekildedüzeltme yapılmıştır. Daha önce kanser tedavisi alan fakat kardiyak toksisite açısından riskfaktörleri bulunmayan hastaların yer aldığı çalışmanın ikinci kısmında, 4/2 şemasında günlük15 mg/m2 dozunda (MTD) sunitinib genellikle tolere edilebilir ve klinik açıdan kontrol altınaalınabilir olmuştur. Olguların hiçbirinde tam yanıt veya kısmi yanıt elde edilmemiştir. 6 hastada (%17) stabil hastalık gözlenmiştir. GİST'i olan bir hasta, 15 mg/m2 doz düzeyinde dahil edilmiş ve yarara ilişkin kanıt gözlenmemiştir. Gözlenen advers ilaç reaksiyonları genelolarak erişkinlerde görülenlere benzer bulunmuştur (bkz. Bölüm 4.8). HGG veya epandimomu bulunan, 27'si pediyatrik hastadan (3-16 yaş) ve 2'si genç erişkin hastadan (18-19 yaş) oluşan 29 hastada, faz II açık etiketli bir çalışma gerçekleştirilmiştir.Çalışma, hastalık kontrolünün olmaması nedeniyle planlı bir ara dönem analizi sırasındakapatılmıştır. Medyan PFS, HGG grubunda 2,3 ay ve epandimoma grubunda 2,7 ay olmuştur.Medyan genel OS, HGG grubunda 5,1 ay ve epandimoma grubunda 12,3 ay olmuştur. Enyaygın (>%10) tedaviye bağlı advers olayların, her iki grupta kombine olarak nötrofilsayısının azalması (6 hasta [%20,7]) ve intrakraniyal hemoraji (3 hasta [%10,3]) olduğubildirilmiştir (bkz. Bölüm 4.8). Günde 15 mg/m2 ila 30 mg/m2 arasında değişen dozlarda 4/2 şemasına göre sunitinib alan, yaşları 13-16 arasında değişen GİST'i olan 6 pediyatrik hastada oral sunitinibin bir faz 1/2çalışmasından elde edilen kanıtlar ve mevcut yayınlanmış veriler (GİST'i olan 20 pediyatrikveya genç erişkin hasta) sunitinib tedavisinin, 26 hastadan 18'inde (%69,2) hem imatinibyetersizliğinden veya intoleransından sonra (21 hastadan 16'sında stabil hastalık) hem denovo/cerrahi ameliyat sonrasında (5 hastadan 2'sinde stabil hastalık) hastalık stabilizasyonusağladığı gözlenmiştir. Faz 1/2 çalışmasında, 6 hastanın 3'ünde stabil hastalık ve 3'ündehastalık ilerlemesi gözlenmiştir (sırasıyla 1 hastaya neo adjuvan ve 1 hastaya adjuvan imatinibverilmiştir). Aynı çalışmada, 6 hastanın 4'ünde (%66,7) Grade 3-4 tedaviye bağlı adversolaylar (Grade 3 hipofosfatemi, nötropeni ve trombositopeninin her biri 1 hastada ve 1 hastadaGrade 4 nötropeni) görülmüştür. Ek olarak, yayınlar, 5 hastada gözlenen şu Grade 3 adversilaç reaksiyonları bildirmiştir: Yorgunluk (2), gastrointestinal advers ilaç reaksiyonları (diyaredahil) (2), hematolojik advers ilaç reaksiyonları (anemi dahil) (2), kolesistit (1), hipertiroidizm(1) ve mukozit (1). GİST'i olan pediyatrik hastalarda (6-17 yaş grubu) sunitinibin farmakokinetik (PK) ve kilit güvenlilik ile etkililik sonlanım noktalarının ekstrapolasyonu amacıyla, bir popülasyon PK vefarmakokinetik/farmakodinamik (PK/PD) analizi gerçekleştirilmiştir. Bu analizde GİST veyasolid tümörleri olan erişkinlerden ve solid tümörleri olan pediyatrik hastalardan toplananveriler temel alınmıştır. Modelleme analizleri doğrultusunda, küçük yaş ve düşük vücutölçümlerinin plazma ilaç maruziyetine güvenlilik ve etkililik yanıtlarını olumsuz etkilemediğibelirlenmiştir. Sunitinib yarar/riskinin, küçük yaş veya düşük vücut ölçümlerinden olumsuzetkilenmediği ve başlıca plazma ilaç maruziyetine bağlı olduğu görülmüştür. 24 Avrupa İlaç Ajansı, böbrek veya renal pelvis karsinomunun (nefroblastom, nefroblastomatoz, berrak hücreli sarkom, mezoblastik nefrom, renal medüller karsinom ve böbrek rabdoidtümörü hariç olmak üzere) tedavisinde çocuk nüfusun tüm alt gruplarında sunitinib ile yapılançalışmaların sonuçlarını sunma yükümlülüğünden feragat etti (çocuklarda kullanım hakkındabilgi için Bölüm 4.2'ye bakın). Avrupa İlaç Ajansı, gastroenteropankreatik nöroendokrin tümörlerin (nöroblastom, nöroganglioblastoma, feokromasitom hariç) tedavisinde çocuk nüfusunun tüm alt gruplarındasunitinib ile yapılan çalışmaların sonuçlarını sunma yükümlülüğünden feragat etti (bkz.çocuklarda kullanım hakkında bilgi için Bölüm 4.2). 5.2. Farmakokinetik özelliklerGenel özelliklerSunitinibin farmakokinetiği 135 sağlıklı gönüllüde ve solid tümörlü 266 hastada değerlendirilmiştir. Her iki grupta da farmakokinetik benzerdir. 25-100 mg'lık doz aralığında plazma konsantrasyon-zaman eğrisi altındaki alan (EAA) ve Cmaks dozla orantılı olarak artar. Günlük tekrarlayan uygulamalarda sunitinib miktarı 3-4katına çıkarken, primer metabolitinin miktarı 7-10 katına çıkar. Sunitinib ve primer aktifmetabolitin kararlı durum konsantrasyonlarına 10-14 gün içinde ulaşılır. 14. gün itibariylesunitinib ve aktif metabolitinin kombine plazma konsantrasyonları 62,9-101 ng/ml olup, bukonsantrasyonlar klinik verilerde öngörülen in vitroin vivoolarak tümör stazı/büyümesini azaltacak hedef konsantrasyonlardır. Primeraktif metabolit toplam maruziyetin %23-%37'sini oluşturmaktadır. Tekrarlayan günlükuygulamalarda veya test edilen doz rejimlerinin tekrarlayan kürlerinde sunitinib veya primeraktif metabolitinin farmakokinetiğinde anlamlı değişiklikler olmamıştır.Emilim:Sunitinib ağızdan uygulanmasını takiben 6-12 saat (Tmaks) içinde maksimum konsantrasyona (Cmaks) ulaşır. Yiyeceklerin sunitinibin biyoyararlanımına herhangi bir etkisi yoktur. Dağılım:Sunitinib ve primer aktif metabolitinin in vitroçalışmalarda konsantrasyondan bağımsız olarak plazma proteinine bağlanma derecesi sırasıyla %95 ve %90 olmuştur. Sunitinib içindağılım hacmi (Vd), dokulara dağılımı gösterecek şekilde, büyüktür (2230 litre).Metabolik etkileşimlerTest edilen tüm sitokrom P450 izoformları (CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A4/5, ve CYP4A9/11) için hesaplanan invitroKi değerleri; sunitinib ve primer aktif metabolitinin, bu enzimlerle metabolize olan diğeretkin maddelerin metabolizmasını indükleme ihtimalinin az olacağını göstermektedir.Biyotransformasyon:Sunitinib asıl olarak, bir sitokrom P450 enzimi olan CYP3A4 tarafından metabolize edilir. Primer aktif metaboliti desetil sunitinibtir ve bu metabolit tekrardan CYP3A4 tarafındanmetabolize edilir. Sunitinibin potent CYP3A4 indükleyicileri veya inhibitörleri ile birliktekullanımı ile sunitinibin plazma düzeyi değişebileceğinden, birlikte kullanımındankaçınılmalıdır (bkz. Bölüm 4.4 ve 4.5). 25 Eliminasyon:Atılım primer olarak feçes yoluyla (%61) gerçekleşir. Renal eliminasyon metabolitler ile birlikte uygulanan dozun %16'sıdır. Sunitinib ve primer aktif metaboliti plazmada, idrarda vefeçeste görülen ilaç bağlantılı esas bileşiklerdir ve sırasıyla %91,5, %86,4 ve %73,8 oranındagörülmektedir. Minör metabolitler idrar ve feçeste görülmüş, ancak genellikle plazmadagörülmemişlerdir. Total oral klerens (CL/F) 34-62 litre/saat olmuştur. Sağlıklı gönüllülere tekdoz oral uygulamanın ardından sunitinibin terminal yarılanma ömrü yaklaşık olarak 40-60saat iken, primer aktif desetil metabolitininki 80- 110 saat olmuştur. BCRP inhibitörü olan ilaçlarla birlikte kullanımIn vitroHastalardaki karakteristik özelliklerKaraciğer yetmezliği:Sunitinib ve aktif metaboliti esas olarak karaciğer tarafından metabolize edilir. Hafif (Child-Pugh Sınıf A) veya orta (Child-Pugh Sınıf B) karaciğer yetmezliği olan hastalarda sunitinibin tek bir dozuna sistemik maruz kalım, normal karaciğer fonksiyonu olan deneklerlekarşılaştırıldığında benzer olmuştur. Sunitinib, ciddi (Child-Pugh Sınıf C) karaciğeryetersizliği olan hastalarda çalışılmamıştır. Çalışmalara ALT veya AST değerleri >2,5xULN (normalin en üst sınırı) veya karaciğer metastazı > 5,0 x ULN olan hastalar dahil edilmemiştir. Böbrek yetmezliği:Popülasyon farmakokinetik analizleri, kreatinin klerensi 42-347 ml/dak olan hastalarda, sunitinibin klerensinin değişmediğini göstermektedir. Tek doz sunitinib uygulamasındansonra, ciddi böbrek yetmezliği (kreatinin klerensi <30 ml/dak) olan kişilerle normal renalfonksiyona (kreatinin klerensi >80 ml/dak) sahip kişilerde sistemik maruziyet aynı olmuştur.Son evre böbrek yetmezliği hastalarında sunitinib ve primer metabolitinin hemodiyalizleeliminasyonu yapılamasa da, normal böbrek fonksiyonuna sahip kişilerle karşılaştırıldığındasistemik maruziyet sunitinib için %47, primer metaboliti için %31 daha az olmuştur. Kilo ve performans durumu:Demografik verinin popülasyon farmakokinetik analizi, vücut ağırlığı veya performans durumunda, başlangıç doz ayarlamalarının gerekli olmadığını gösterir. Cinsiyet:26 Eldeki veriler kadınlarda görünür sunitinib klerensinin (CL/F) erkeklere oranla %30 daha az olduğunu göstermektedir; ancak bu fark başlangıç dozunun değiştirilmesinigerektirmemektedir. Pediyatrik popülasyon Pediyatrik hastalarda sunitinib kullanımına ilişkin deneyimler kısıtlıdır (bkz. Bölüm 4.2). GİST ve solid tümörleri olan erişkin hastaları ve solid tümörleri olan pediyatrik hastalarıiçeren toplu veritabanına ilişkin popülasyon PK analizleri tamamlanmıştır. Yaş ve vücutölçümlerinin (toplam vücut ağırlığı veya vücut yüzey alanı) yanı sıra diğer eş değişkenlerinsunitinib ve metabolitlerinin önemli PK parametreleri üzerindeki etkisini değerlendirmeküzere adımsal eş değişken modelleme analizleri yapılmıştır. Test edilen yaş ve vücut ölçümüile ilişkili eş değişkenlerden yaş, sunitinibin görünen klerensi üzerinde anlamlı bir eş değişkenolarak belirlenmiştir (pediyatrik hasta ne kadar küçükse, görünen klerens o kadar düşüktür).Benzer şekilde, vücut yüzey alanı, aktif metabolitin görünen klerensi üzerinde anlamlı bir eşdeğişken olarak belirlenmiştir (vücut yüzey alanı ne kadar düşükse, görünen klerens o kadardüşüktür). Ayrıca, 3 pediyatrik çalışmadan toplu veri setine ilişkin birleştirilmiş popülasyon PK analizine göre (2 pediyatrik solid tümör çalışması ve 1 pediyatrik GİST çalışması: 6-11 yaş ve 12-17yaş) başlangıç vücut yüzey alanı (BSA), sunitinibin ve aktif metabolitinin görünen klerensiüzerinde anlamlı bir eş değişken olarak belirlenmiştir. Bu analize dayanarak, BSA değerleri1,10 ve 1,87 m2 arasında olan pediyatrik hastalarda günlük yaklaşık 20 mg/m2'lik bir doz,sunitinib ve aktif metabolitine plazma maruziyetinin (EAA'nın %75 ila %125'i arasında),GİST'i olan yetişkinlere, 4/2 şemasına göre (EAA 1233 ng.hr/mL) günlük 50 mg sunitinibuygulaması ile gözlenen plazma maruziyetine benzer olması beklenir. Pediyatrik çalışmalarda,15 mg/m2 olan başlangıç sunitinib dozu (faz I doz-artış çalışmasında tanımlanan MTD'yegöre, bkz. Bölüm 5.1), GİST'i olan pediyatrik hastalarda 22,5 mg/m2'ye ve ardından bireyselhasta güvenliliği/tolere edilebilirliğine bağlı olarak 30 mg/m2'ye (toplam günlük 50 mg dozuaşmayacak şekilde) yükselmiştir. Ayrıca, GİST'i olan pediyatrik hastalarda yayınlanmışliteratürlere göre, 16,6 mg/m2 ila 36 mg/m2 arasında değişmekte olan hesaplanmış başlangıçdozu, toplam günlük 50 mg dozu aşmayacak şekilde 40,4 mg/m2'ye kadar yükselmiştir. 5.3. Klinik öncesi güvenlilik verileriMaymun ve sıçanlarda 9 aya kadar devam eden tekrarlayan doz toksisite çalışmalarında primer hedef organ etkileri gastrointestinal sistem (maymunlarda emezis ve diyare), adrenalbez (sıçanlarda fibrozis görülen nekrozu takiben ve maymunlarda kortikal konjesyon ve/veyahemoraji), hemolenfopoetik sistem (kemik iliği hiposelülaritesi ve timusta lenfoid dokununazalması, dalak ve lenf nodülü), ekzokrin pankreas (tek hücre nekrozuyla asinar hücredegranülasyonu), tükrük bezi (asinar hipertrofi), eklem (büyüme plağı kalınlaşması), uterus(atrofi), overler (azalmış foliküler gelişim) görülmüştür. Tüm bu bulgular klinik olarakanlamlı bir sunitinibin plazma maruziyeti seviyesinde görülmüştür. QT aralığında uzama,böbrekte mezangiyal matriks, gastrointestinal sistemde ve oral mukozada hemoraji vetestislerde (tübüler atrofi) ve anterior pitüiter hücreleri hipertrofisi diğer çalışmalarda görülenilave etkiler arasındadır. Uterustaki (endometriyal atrofi) ve kemik büyüme plağındaki (fizealkalınlaşma veya kıkırdak displazisi) değişimler sunitinibin farmakolojik etkisiyleilişkilendirilmiştir. Bu bulguların çoğu tedavi kesildiğinde 2-6 hafta içinde geri dönüşümlüolmuştur. Genotoksisite 27 Sunitinibin genotoksik potansiyeli in vitroin vivoin vitroin vitroin vivoolarak klastojenik değildi. Esas aktif metabolitgenotoksisite açısından değerlendirilmemiştir.Karsinojenite 1 aylık oral gavaj doz-aralığı belirleme çalışmasında (0, 10, 25, 75 veya 200 mg/kg/gündozlarında) devamlı günlük dozlama yapılan rasH2 transgenik farelerde test edilen en yüksekdozda (200 mg/kg/gün) dudenumun Brunner bezinin karsinoması ve hiperplazisi gözlenmiştir. RasH2 transgenik farelerde günlük dozlama ile 6 aylık bir oral gavaj karsinojenite çalışması (0, 8, 25, 75 (50'ye azaltılan) mg/kg/gün) yapılmıştır. Günlük 25 mg/kg'lık ve daha fazladozlarda 1-veya 6- aylık süreleri (günlük önerilen dozu kullanan hastaların EAA'sının 7,3 katıveya daha fazlası) takiben gastroduodenal karsinomalar, arka plan hemajiyosarkominsidansında artış ve/veya gastrik mukozal hiperplazi gözlenmiştir. 2 yıllık bir sıçan karsinojenite çalışmasında (0, 0,33, 1 veya 3 mg/kg/gün), sunitinibin 7günlük uygulamasız periyodların takip ettiği 28 günlük sikluslarla uygulanması; erkeksıçanlara 3 mg/kg/gün dozda 1 yılı aşkın uygulamayı (RDD (önerilen günlük doz) uygulananhastalarda EAA'nın 7,8 katı veya daha fazla) takiben adrenal medullada feokromositom vehiperplazi insidansında artışla sonuçlanmıştır. Dişilerde >1 mg/kg/gün ve erkeklerde 3mg/kg/gün uygulamayı takiben duodenumda Brunner bez karsinomu oluşmuştur veerkeklerde 3 mg/kg/gün uygulamayı takiben glandüler midede müköz hücre hiperplazisibelirgindir (EAA, RDD uygulanan hastaların sırasıyla >0,9, 7,8 ve 7,8 katı). Sunitinibuygulaması ile yapılan fare ve sıçan karsinojenite çalışmalarında (rasH2 transgenik) gözlenenbeoplastik bulguların insanlara etkisi belirlenmemiştir. Üreme ve Gelişim Toksisitesi Üreme toksisite çalışmalarında dişi ya da erkek fertilitesi üzerine herhangi bir etki gözlemlenmemiştir. Bununla birlikte, sıçanlarda ve maymunlarda yapılmış tekrar-doz toksisiteçalışmalarında, klinik açıdan anlamlı sistemik maruz kalım düzeylerinde, foliküler atrezi,korpora lutea dejenerasyonu, uterusta endometrial değişiklikler ve uterus ve overağırlıklarında azalma şeklinde dişi fertilitesi üzerindeki etkiler gözlenmiştir. Erkek fertilitesiüzerinde insanın sistemik olarak maruz kaldığının 25 katı plazma temas seviyelerinde,testislerde tübüler atrofi, epididimiste sperm azalması ve prostat ve seminal veziküllerdekolloid deplesyon şeklinde etkiler gözlenmiştir. Sıçanlarda, embriyo-fetal mortalite, insanın sistemik olarak maruz kaldığının 5,5 katı maruziyette; yaşayan fetüslerin sayısında azalma, rezorbsiyonların (erken ve toplam)sayısında artış, implantasyon sonrası kayıplarda artış, 28 gebeden 8'inde yavru sayısı kaybıolarak belirlendi. Tavşanlarda, insanın sistemik olarak maruz kaldığının 3 katı plazma maruzkalım düzeylerinde; rezorbsiyon sayısındaki artışa bağlı olarak uterus ağırlığında ve canlıfetüs sayısında azalma, implementasyon sonrası kayıplarda artış ve 6 gebeden 4'ünde yavrusayısı kaybı gözlendi. Sıçanlarda organogenezis sırasında >5 mg/kg/gün sunitinib ile tedavi, insanın sistemik olarak maruz kaldığının 5,5 katı plazma maruz kalım düzeylerinde ortaya çıkar ve özellikle 28 torasik/lumbar vertebrada osifikasyonda gecikmeyle karakterize fetal iskelet malformasyonları insidansında artışı içeren gelişimsel etkilerle sonuçlanır. Tavşanlarda,gelişim etkileri, klinikte gözlenene yaklaşık olarak eşit plazma seviyelerindeki artmış yarıkdudak insidansı ve insanın sistemik olarak maruz kaldığının 2,7 katı plazma maruziyetdüzeyinde artmış yarık dudak ve yarık damak insidansını kapsar. Sunitinib (0,3, 1,0, 3,0 mg/kg/gün), hamile sıçanlarda pre ve postnatal gelişim çalışmasında değerlendirilmiştir. 1 mg/kg/gün'den büyük dozlarda gebelik ve laktasyon dönemindematernal kilo alımı azalmıştır ancak 3 mg/kg/gün doza kadar (tahmini maruziyet RDDuygulanan hastalarda EAA'nın 2,3 katı veya daha fazla) herhangi bir maternal üremetoksisitesi gözlenmemiştir. 3 mg/kg/gün dozda emzirmeden kesilme öncesi ve sonrasıyavruların ağırlıklarında azalma gözlenmiştir. 1 mg/kg/gün dozda gelişim toksisitesigözlenmemiştir (yaklaşık maruziyet RDD uygulanan hastalarda EAA'nın 0,9 katı veya dahafazla). 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiKapsül içeriği: Kroskarmelloz sodyum, mannitol (E421), povidon K 25, magnezyum stearat Kapsül bileşimi: Allura red AC-FD&C Red 40, titanyum dioksit, jelatin (sığır kaynaklı) 6.2. Geçimsizlikler6.3. Raf ömrü24 ay 6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında saklanmalıdır. 6.5. Ambalajın niteliği ve içeriğiAlüminyum folyo-PVC/PE/PVDC şeffaf blister 28 sert kapsül içeren ambalajda 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİNOBEL İLAÇ SANAYİİ VE TİCARET AŞ. 29 Saray Mah. Dr. Adnan Büyükdeniz Cad. No:14 34768 Ümraniye / İSTANBULTel: (216) 633 60 00Faks: (216) 633 60 01 8. RUHSAT NUMARASI2022/467 9. İLK RUHSAT TARİHİ/ RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 23.08.2022 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ30 |
İlaç BilgileriSunubis 12,5 Mg Sert KapsülEtken Maddesi: Sunitinib Malat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.