Forziga 10 Mg Film Kaplı Tablet Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIFORZİGA 10 mg film kaplı tablet 2. KALITATIF VE KANTITATIF BILEŞIMEtkin madde:
10 mg
50 mg
Dapagliflozin (12,3 mg dapagliflozin propandiol monohidrat olarak) Yardımcı maddeler:Laktoz (sır sütünden elde edilmektedir) Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMFilm kaplı tablet Bir tarafı 10 ve diğer tarafı 1428 baskılı, sarı renkte, bikonveks, yaklaşık 1,1 x 0,8 cm boyutlarında diyagonal olarak elmas şeklinde film kaplı tablet. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarTip 2 diabetes mellitusFORZİGA erişkinlerde yetersiz kontrol edilen tip 2 diabetes mellitus tedavisi için diyet ve egzersize yardımcı olarak endikedir. - İntolerans nedeniyle metformin uygun görülmediğinde monoterapi olarak - Tip 2 diyabet tedavisi için diğer tıbbi ürünlere ek olarak. Çalışma sonuçlarına göre, FORZİGA'nın yerleşik kardiyovasküler hastalı olan veya birden fazla kardiyovasküler risk faktörü bulunan erişkin tip 2 diabetes mellituslu hastalarda kronikböbrek yetmezliğinin ilerlemesini ve/veya kalp yetersizliği nedeniyle hastaneye yatış riskiniazalttı da gösterilmiştir. Tedavilerin kombinasyonuna, glisemik kontrol, kardiyovasküler ve renal olaylara ve çalışılan popülasyonlara ilişkin çalışma sonuçları için, bkz. Bölüm 4.4, 4.5 ve 5.1. Kalp yetersizliğiFORZİGA, semptomatik kronik kalp yetersizliği bulunan erişkinlerin tedavisinde endikedir. Kronik böbrek hastalıFORZİGA erişkinlerde kronik böbrek hastalının tedavisinde aşadaki durumlar için endikedir: kronik böbrek hastalında progresyonun yavaşlatılması kalp yetersizliği için hastaneye yatış veya kardiyovasküler ölüm riskinin azaltılması  :ip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys1/43 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklı ve süresi:Tip 2 diabetes mellitusÖnerilen doz günde bir defa 10 mg dapagliflozindir. Dapagliflozin ile insülin veya sülfonilüre gibi insülin salgılatıcı bir ilaç kombinasyon halinde kullanıldında, hipoglisemi riskini azaltmak için insülinin veya insülin salgılatıcı ilacın dahadüşük bir dozu düşünülebilir (bkz. Bölüm 4.5 ve 4.8). Kalp yetersizliğiÖnerilen doz günde bir defa 10 mg dapagliflozindir. Kronik böbrek hastalıÖnerilen doz günde bir defa 10mg dapagliflozindir. Uygulama şekli:FORZİGA günün herhangi bir saatinde yemeklerle birlikte veya aç karnına günde bir defa oral yolla alınabilir. Tabletler bütün olarak yutulmalıdır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek fonksiyonuna göre herhangi bir doz ayarlaması yapılması gerekli değildir. Sınırlı deneyim nedeniyle, tüm endikasyonlarda GFR < 25 mL/dak olan hastalarda dapagliflozin tedavisine başlanması önerilmez. Diyabetli hastalarda, glomerüler filtrasyon hızı (GFR) < 45 mL/dak olduğunda dapagliflozinin glikoz düşürücü etkililiği azalır ve şiddetli böbrek yetmezliği bulunanhastalarda etkililik göstermemesi olasıdır. Bu nedenle, GFR'nin 45 mL/dak'ın altına düşmesidurumunda, diyabet hastalarında ek glikoz düşürücü tedavi düşünülmelidir (bkz. Bölüm 4.4,4.8, 5.1 ve 5.2).
2/43 Karaciğer yetmezliği:Hafif veya orta derecede karaciğer yetmezliği olan hastalar için herhangi bir doz ayarlamasına gerek duyulmamaktadır. Ar derecede karaciğer yetmezliği olan hastalarda 5 mg başlangıçdozu önerilmektedir. İyi tolere edildiği takdirde, belirtildiğinde doz 10 mg'a çıkarılabilir (bkz.Bölüm 4.4 ve 5.2). Pediyatrik popülasyon:Dapagliflozinin 18 yaş altında güvenliliği ve etkililiği belirlenmemiştir. Herhangi bir veri bulunmamaktadır. Geriyatrik popülasyon (> 65 yaş):Yaşa bağlı olarak herhangi bir doz ayarlamasının yapılması önerilmemektedir. 4.3. KontrendikasyonlarDapagliflozin etkin maddesine veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı aşırı duyarlılık durumunda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriBöbrek yetmezliğiSınırlı deneyim nedeniyle, GFR < 25 mL/dak olan hastalarda dapagliflozin tedavisine başlanması önerilmez. Dapagliflozinin glikoz düşürücü etkililiği böbrek fonksiyonuna bağlı olup, GFR <45 mL/dak olan hastalarda azalmaktadır ve ar derecede böbrek yetmezliği olan hastalarda ise etkililikgöstermemesi olasıdır (bkz. Bölüm 4.2, 5.1 ve 5.2). Orta derecede böbrek yetmezliği olan (GFR < 60 mL/dak) tip 2 diyabet hastalarında yapılan bir çalışmada, plasebo ile karşılaştırıldında, dapagliflozin ile tedavi edilen hastaların dahabüyük bir kısmında kreatinin, fosfor ve paratiroit hormonu (PTH) artışı ve hipotansiyon gibiadvers reaksiyonlar gözlenmiştir. Karaciğer yetmezliğiKaraciğer yetmezliği olan hastalarda gerçekleştirilen klinik çalışmalardan elde edilen deneyim sınırlıdır. Dapagliflozin maruziyeti, ar derecede karaciğer yetmezliği olanbireylerde artmaktadır (bkz. Bölüm 4.2 ve 5.2). Volüm deplesyonu ve/veya hipotansiyon riski olan hastalarda kullanımıDapagliflozin etki mekanizmasına bağlı olarak, diürezi arttırır ve bu da klinik çalışmalardagözlenen hafif kan basıncı düşüşüne yol açabilir (bkz. Bölüm 5.1). Bu etki, kan glukozkonsantrasyonları çok yüksek olan bireylerde daha belirgin olabilir.Anti-hipertansif tedavi almakta olup hipotansiyon öyküsü olan hastalar ya da yaşlı hastalar gibi, kan basıncında dapagliflozin kaynaklı bir düşüşün risk oluşturabileceği hastalardadikkatli olunmalıdır. Volüm deplesyonu yaratabilen eşzamanlı durumlar (örneğin gastrointestinal hastalık) mevcut olduğunda, volüm deplesyonunun (örn., fiziksel muayene, kan basıncı ölçümleri, hematokritve elektrolitleri içeren laboratuvar testleri) dikkatle izlenmesi önerilmektedir. Volüm
ıpagliflozin tedavisine geçici olarak Adres ı: https ://w w w. turkıy e. gov.tr/sagıık-tıtck-ebyslişen ha ilmektedi
u deples ara verilmesi öneri
3/43 Diyabetik ketoasidozDapagliflozin dahil olmak üzere sodyum-glukoz ko-transporter 2 (SGLT2) inhibitörleri ile tedavi edilen hastalarda yaşamı tehdit eden ya da ölümcül vakalar dahil olmak üzere nadirdiyabetik ketoasidoz (DKA) vakaları bildirilmiştir. Bazı vakalarda bu durumun ortaya çıkışbiçimi atipik olup, kan glukozu değerleri 14 mmol/L (250 mg/dL) altında olmak üzere sadeceorta düzeyde artış göstermiştir. Bulantı, kusma, anoreksi, karın ağrısı, aşırı susama, nefes alma güçlüğü, konfüzyon, alışılmadık yorgunluk ya da uyuklama gibi spesifik olmayan semptomların ortaya çıkmasıdurumunda diyabetik ketoasidoz riski dikkate alınmalıdır. Eğer bu semptomlar ortaya çıkarsa,kan glukoz düzeyinden bamsız olarak hastalar derhalketoasidozaçısından değerlendirilmelidir. Hastalarda DKA şüphesi ya da tanısı olduğunda derhal dapagliflozin tedavisi kesilmelidir. Majör cerrahi prosedürler ya da akut ciddi tıbbi hastalıklar nedeniyle hastaneye yatırılan hastalarda tedavi kesilmelidir. Bu hastalarda ketonların izlenmesi önerilir. Kan ketondüzeylerinin ölçümü idrara tercih edilir. Dapagliflozin tedavisi, keton değerleri normalolduğunda ve hastanın durumu stabilize olduğunda yeniden başlatılabilir. Dapagliflozin tedavisine başlamadan önce, hasta öyküsünde ketoasidoza yatkınlık oluşturabilecek faktörler göz önünde bulundurulmalıdır. Daha yüksek DKA riski altında olabilecek hastalar, düşük beta-hücresi fonksiyonu rezervi olan hastaları (ör. düşük C-peptid bulunan tip 2 diyabet hastaları ya da erişkinlerde latentotoimmün diyabet (LADA) ya da pankreatit öyküsü bulunan hastalar), kısıtlı gıda alımınaneden olan hastalıkları ya da ciddi dehidratasyon bulunan hastaları, insülin dozları azaltılanhastaları ve akut tıbbi hastalık, cerrahi ya da alkol kullanımına bağlı olarak insülingereksinimleri fazla olan hastaları kapsar. SGLT2 inhibitörleri bu hastalarda dikkatli şekildekullanılmalıdır. SGLT2 inhibitörü tedavisi altındayken bir DKA yaşayan hastalarda, başka bir açık hızlandırıcı faktör belirlenmedikçe ve düzeltilmedikçe yeniden SGLT2 inhibitörü tedavisinebaşlanması önerilmez. Dapagliflozin ile tip 1 diabetes mellitus çalışmalarında, DKA yaygın sıklıkta bildirilmiştir. Tip 1 diyabeti bulunan hastaların tedavisinde dapagliflozin kullanılmamalıdır. Perineal nekrotizan fasiit (Fournier kangreni)SGLT2 inhibitörleri kullanan kadın ve erkek hastalarda pazarlama sonrasında perineal nekrotizan fasiit (Fournier kangreni olarak da bilinir) vakaları bildirilmiştir (bkz. Bölüm 4.8).Bu acil cerrahi müdahale ve antibiyotik tedavisi gerektiren nadir ancak ciddi ve potansiyelolarak yaşamı tehdit edici bir olaydır. Hastalara, ateş veya halsizlik ile birlikte, genital veya perineal bölgede ağrı, hassasiyet, eritem veya şişlik semptomlarının bir kombinasyonunu yaşamaları durumunda tıbbi yardım almalarıönerilmelidir. Nekrotizan fasiitin öncesinde ürogenital enfeksiyon veya perineal apse ortayaçıkabileceği bilinmelidir. Fournier kangreninden şüphelenildiği takdirde FORZİGA kesilmelive acil tedavi (antibiyotikler ve cerrahi debridman dahil) başlatılmalıdır.
4/43 İdrar yolu enfeksiyonlarıİdrarla glukoz atılımı, idrar yolu enfeksiyonu riskinde artış ile ilişkili olabilir; bu nedenle piyelonefrit veya ürosepsis tedavisi sırasında dapagliflozine geçici olarak ara verilmesidüşünülmelidir. Yaşlı hastalar (>65)Yaşlı hastalarda volüm deplesyonu riski daha fazladır ve diüretiklerle tedavi edilme olasılıkları daha yüksektir. Yaşlı hastalarda böbrek işlev bozukluğunun olma olasılı ve/veya bu hastaların böbrek fonksiyonlarında değişikliklere neden olabilecek anjiyotensin dönüştürücü enzim inhibitörleri(ACE-I) ve anjiyotensin II tip I reseptör blokerleri (ARB) gibi anti-hipertansif tıbbi ürünlerletedavi görüyor olma olasılı daha yüksektir. Tüm hastalarda olduğu gibi yaşlı hastalarda daböbrek fonksiyonu ile ilgili aynı öneriler geçerlidir (bkz. Bölüm 4.2, 4.4, 4.8 ve 5.1). Kalp yetersizliğiNYHA sınıf IV'te dapagliflozin ile deneyim sınırlıdır. Kronik böbrek hastalıAlbümünirisi olmayan non-diyabetik hastalarda kronik böbrek hastalının tedavisi için dapagliflozin ile ilgili deneyim bulunmamaktadır. Albüminürisi olan hastalar dapagliflozintedavisinden daha fazla yarar görebilir. Alt ekstremite ampütasyonlarıBir başka SGLT2 inhibitörüyle tip 2 diyabette yapılan uzun süreli klinik çalışmalarda, alt ekstremite ampütasyon vakalarında (esas olarak ayak başparma) bir artış gözlenmiştir.Bunun bir sınıf etkisi oluşturup oluşturmadı bilinmemektedir. Diyabetli hastalara rutinönleyici ayak bakımı konusunda bilgi verilmesi önemlidir. İdrar laboratuvar değerlendirmeleriEtki mekanizması nedeniyle, FORZİGA almakta olan hastaların idrarlarında glukoz testi pozitif sonuç verecektir. LaktozFORZİGA film kaplı tablet laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacıkullanmamaları gerekir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriFarmakodinamik etkileşimlerDiüretiklerDapagliflozin; tiazid ve loop diüretiklerin diüretik etkilerine katkıda bulunabilir ve dehidratasyon ve hipotansiyon riskini artırabilir (bkz. Bölüm 4.4). İnsülin ve insülin salgılatıcı ilaçlarİnsülin ve sülfonilüreler gibi insülin salgılatıcı ilaçlar hipoglisemiye neden olur. Bu nedenle, tip 2 diyabetli hastalarda dapagliflozin ile kombinasyon halinde kullanıldında, hipoglisemiriskinin azaltılması için insülin veya insülin salgılatıcı ilacın daha düşük dozunun kullanılmasıgerekebilir (bkz Bölüm 4 2Bvee4e8).venli elektronik imza imzalanmıştır' Belge Domlmnaeb}du: ^vVfSöjıkll^ilTYSS3kOQ3NRZmxXYnUySHY3 Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys5/43 Farmakokinetik etkileşimlerDapagliflozin metabolizması başlıca UDP glukuronoziltransferaz 1A9 (UGT1A9) aracılı glukuronit konjugasyonu yoluyladır. İn vitroçalışmalarda dapagliflozin; sitokrom P450 (CYP) 1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP3A4'ü inhibe etmemiş ya da CYP1A2, CYP2B6,CYP3A4'ü indüklememiştir. Bu nedenle, dapagliflozinin, bu enzimler tarafından metabolizeolan eşzamanlı uygulanan tıbbi ürünlerin metabolik klirensini değiştirmesi beklenmemektedir.Diğer tıbbi ürünlerin dapagliflozin üzerindeki etkisiSağlıklı bireylerle gerçekleştirilen, özellikle tek doz tasarımın kullanıldı etkileşim çalışmaları, dapagliflozinin farmakokinetiğinin metformin, pioglitazon, sitagliptin, glimepirid,vogliboz, hidroklorotiazit, bumetanid, valsartan ya da simvastatin tarafındandeğiştirilmediğini göstermektedir. Dapagliflozin ile rifampisinin (çeşitli aktif taşıyıcı ve ilaç metabolize edici enzimlerin indükleyicisi) eşzamanlı uygulanmasını takiben sistemik dapagliflozin maruziyetinde (EAA)%22'lik bir düşüş gözlenmiş, ancak 24 saatlik üriner glukoz atılımında klinik olarak anlamlıbir etkisi olmamıştır. Herhangi bir doz ayarlaması önerilmemektedir. Diğer indükleyicilerle(örneğin; karbamazepin, fenitoin, fenobarbital) klinik olarak anlamlı bir etkibeklenmemektedir. Dapagliflozin ile mefenamik asidin (UGT1A9 inhibitörü) eşzamanlı uygulanmasını takiben sistemik dapagliflozin maruziyetinde %55'lik bir artış gözlenmiştir; ancak 24 saatlik ürinerglukoz atılımında klinik olarak anlamlı bir etkisi olmamıştır. Herhangi bir doz ayarlamasıönerilmemektedir. Dapagliflozinin diğer tıbbi ürünler üzerindeki etkisiDapagliflozin renal lityum atılımını artırabilir ve kan lityum seviyeleri düşebilir. Dapagliflozin başlatıldıktan ve doz değişikliklerinden sonra serum lityum konsantrasyonudaha sık izlenmelidir. Lityum serum konsantrasyonunu izlemek için lütfen hastayı reçeteyelityum yazan doktora sevk ediniz. Sağlıklı bireylerle gerçekleştirilmiş olan, özellikle tek doz tasarımın kullanıldı etkileşim çalışmalarında, dapagliflozin metformin, pioglitazon, sitagliptin, glimepirid, hidroklorotiazit,bumetanid, valsartan, digoksin (P-gp substratı) ya da varfarinin farmakokinetiğini (S-varfarin;CYP2C9 substratı), veya varfarinin INR ile ölçüldüğü üzere antikoagülan etkilerinideğiştirmemiştir. Tek doz 20 mg dapagliflozin ile simvastatin (CYP3A4 substratı)kombinasyonu simvastatinin EAA değerinde %19 artış ve simvastatin asidin EAA değerinde%31 artış ile sonuçlanmıştır. Simvastatin ve simvastatin asit maruziyetlerindeki artışlarınklinikte anlamlı olduğu düşünülmemektedir. 1,5-anhidroglusitol(1,5T-AG)Tayini ile EtkileşimSGLT2 inhibitörleri alan hastalarda glisemik kontrolün değerlendirilmesinde 1,5-AG ölçümleri güvenilir sonuçlar vermediğinden glisemik kontrolün 1,5-AG tayini ile izlenmesiönerilmez. Glisemik kontrolü izlemek için alternatif yöntemlerin kullanımı önerilmektedir.
6/43 Özel popülasyonlara ilişkin ek bilgilerHerhangi bir etkileşim çalışması yapılmamıştır. Pediyatrik popülasyonEtkileşim çalışmaları sadece erişkinlerde gerçekleştirilmiştir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik Kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Dapagliflozin ve östrojen/progesteron içeren kontraseptifler arasında, özel bir ilaç etkileşim çalışması yapılmamıştır. Ancak, metabolizma verisine göre, dapagliflozininöstrojen/progesteron içeren kontraseptiflerin farmakokinetiği üzerinde klinik olarak anlamlıbir etkisi beklenmemektedir. Çocuk doğurma potansiyeli olan kadınlarda özel bir önlemegerek yoktur. Gebelik dönemiGebe kadınlarda dapagliflozin kullanımına ilişkin veri bulunmamaktadır. Sıçanlar üzerindeki çalışmalarda, insanlardaki gebeliğin ikinci ve üçüncü trimesterlerine karşılık gelen dönemdegelişme sürecindeki böbreklerde toksisite gözlenmiştir (bkz. Bölüm 5.3). Bu nedenlegebeliğin ikinci ve üçüncü trimesterlerinde dapagliflozinin kullanılması önerilmemektedir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Gebelik saptandında dapagliflozin tedavisi durdurulmalıdır. Laktasyon dönemiDapagliflozin ve/veya metabolitlerinin insan sütü ile atılıp atılmadı bilinmemektedir. Hayvanlardaki mevcut farmakodinamik/toksikolojik veriler, dapagliflozin/metabolitlerinin sütile atıldını, ayrıca emzirilen yavrularda farmakoloji aracılı etkilerin olduğunu göstermiştir(bkz. Bölüm 5.3). Yenidoğanlar/bebekler için risk olasılık dışı bırakılamamaktadır.Dapagliflozin, emzirme döneminde kullanılmamalıdır. Üreme yeteneği/FertiliteDapagliflozinin insanda fertilite üzerindeki etkisi incelenmemiştir. Erkek ve dişi sıçanlarda dapagliflozin, test edilen herhangi bir dozda fertilite üzerinde bir etki göstermemiştir. 4.7. Araç ve makine kullanımı üzerindeki etkilerFORZİGA'nın, araç ve makine kullanma becerisi üzerinde herhangi bir etkisi bulunmamakta ya da ihmal edilebilir düzeyde etkileri olabilmektedir. Dapagliflozin, bir sülfonilüre veyainsülin ile kombinasyon halinde kullanıldında, hastalara, hipoglisemi riskine karşı dikkatliolmaları önerilmelidir. 4.8. İstenmeyen etkilerGüvenlilik profilinin özeti
Tip 2 diabetes mellitus7/43 Tip 2 diyabet konulu klinik çalışmalarda, 15000'den fazla hasta dapagliflozin ile tedavi edilmiştir. Güvenliliğin ve tolere edilebilirliğin birincil değerlendirmesi , plasebo kontrollü 13 kısa süreli (24 haftaya kadar) çalışmanın önceden tanımlanmış olan birleştirilmiş analizinde 2360 hasta10 mg dapagliflozin ile tedavi edilmiş, 2295 hastaya plasebo uygulanmıştır. Tip 2 diyabet konulu dapagliflozin kardiyovasküler sonlanımlar çalışmasında (DECLARE çalışması, bkz. Bölüm 5.1), 48 aylık bir medyan maruziyet süresi ile 8574 hasta 10 mgdapagliflozin, 8569 hasta ise plasebo almıştır. Toplamda dapagliflozin maruziyeti 30623 hastayılı olmuştur. Klinik çalışmalarda en sık bildirilen advers reaksiyon genital enfeksiyonlar olmuştur. Kalp yetersizliğiDüşük ejeksiyon fraksiyonuyla seyreden kalp yetersizliği hastalarında yürütülen dapagliflozin kardiyovasküler sonuç çalışmasında (DAPA-HF çalışması), 18 aylık bir medyan maruziyetsüresi boyunca 2368 hasta 10 mg dapagliflozin, 2368 hasta ise plasebo almıştır. Hastapopülasyonu, tip 2 diyabeti olan ve olmayan hastaları ve eGFR değeri > 30 mL/dak/1,73 m2olan hastaları içermiştir. Kalp yetersizliğine sahip, sol ventriküler ejeksiyon fraksiyonu > %40olan hastalarda yapılan dapagliflozin kardiyovasküler sonuç çalışmasında (DELIVER),3126 hasta dapagliflozin 10 mg ve 3127 hasta plasebo ile tedavi edilmiş ve medyan maruziyetsüresi 27 ay olmuştur. Hasta popülasyonu tip 2 diyabeti olan ve olmayan hastaları ve eGFRdeğeri > 25 mL/dak/1,73 m2 olan hastaları içermiştir. Dapagliflozinin kalp yetersizliği görülen hastalardaki genel güvenlilik profilinin dapagliflozinin bilinen güvenlilik profili ile tutarlı olduğu görülmüştür. Kronik böbrek hastalıKronik böbrek hastalı bulunan hastalarda yapılan dapagliflozin renal sonuç çalışmasında (DPA-CKD), ortanca 27 aylık maruziyette 2149 hasta dapagliflozin 10 mg ve 2149 hastaplasebo ile tedavi edilmiştir. Hasta popülasyonu >25 ile <75 mL/dak/1.73 m2 eGFR'ye sahiptip 2 diyabeti bulunan ve bulunmayan hastalardan ve albüminürisi (idrarda albümin kreatininoranı [UACR] > 200 ve < 5000 mg/g) olan hastalardan oluşmaktaydı. Tedavi, eğer eGFR 25mL/dak/1.73 m2 düzeyinin altına düşmüşse devam ettirilmiştir. Kronik böbrek hastalı bulunan hastalarda dapagliflozinin genel güvenlilik profili dapagliflozinin bilinen güvenlilik profili ile uyumlu idi. Aşadaki advers reaksiyonlar plasebo kontrollü klinik çalışmalarda ve pazarlama sonrası gözlemde tespit edilmiştir. Bu advers reaksiyonlardan herhangi birinin dozla bağlantılı olduğubulunmamıştır. Advers reaksiyonlar sistem organ sınıfına ve sıklığa göre listelenmektedir. Şuterimler ve sıklık dereceleri kullanılmıştır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10);yaygın olmayan (>1/1000 ila <1/100); seyrek (>1/10.000 ila <1/1000); çok seyrek(<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
8/43 Plasebo kontrollü klinik çalışmada ve pazarlama sonrası ortaya çıkan advers reaksiyonlarEnfeksiyonlar ve enfestasyonlarYaygın*: Vulvovajinit, balanit ve bağlantılı genital enfeksiyonlar*,b,c, idrar yolu enfeksiyonu*,b,d Yaygın olmayan**: Mantar enfeksiyonu Çok seyrek: Perineal nekrotizan fasiit (Fournier Kangreni)b,i Metabolizma ve beslenme hastalıklarıÇok yaygın: Hipoglisemi (SU veya insülin ile birlikte kullanıldında)3 Yaygın olmayan**: Volüm deplesyonub,e, susama hissi** Seyrek: Diyabetik ketoasidoz (tip 2 diyabette kullanıldında)b,i,k Sinir sistemi hastalıklarıYaygın*: Baş dönmesini de içeren sersemlik hali Gastrointestinal hastalıklarYaygın olmayan**: Konstipasyon**, az kuruluğu** Deri ve deri altı doku hastalıklarıYaygın*: Döküntüj Çok seyrek: Anjiyoödem Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın*: Sırt ağrısı* Böbrek ve idrar yolu hastalıklarıYaygın*: Disüri, poliüri*,f Yaygın olmayan**: Noktüri** Çok seyrek: Tübülointerstisyel nefrit Üreme sistemi ve meme hastalıklarıYaygın olmayan**: Vulvovajinal kaşıntı**, genital kaşıntı** AraştırmalarYaygın*: Dislipidemih, hematokrit yükselmesi, başlangıç tedavisi sırasında renal kreatinin klirensinde azalmab Yaygın olmayan**: Başlangıç tedavisi sırasında kanda kreatinin yükselmesi **,b, kanda üre yükselmesi**, kilo verme** a Glisemik kurtarmadan bamsız olarak, 24 haftaya kadarki (kısa süreli) veriler b Ek bilgi için aşada karşılık gelen bölüme bakınız. c Vulvovajinit, balanit ve bağlantılı genital enfeksiyonlar şunları içerir. Örneğin; ön tanımlı tercih edilen terimler: vulvovajinal mikotik enfeksiyon, vajinal enfeksiyon, balanit, genitalfungal enfeksiyon, vulvovajinal kandidiyazis, vulvovajinit, balanit kandida, genitalkandidiyazis, genital enfeksiyon, erkek genital enfeksiyonu, penil enfeksiyon, vulvit,bakteriyel vajinit, vulval apse. d Üriner sistem enfeksiyonu bildirilme sıklına göre sıralanmış şu tercih edilen terimleri içermektedir: üriner sistem enfeksiyonu, sistit, Escherichia üriner sistem enfeksiyonu,genitoüriner sistem enfeksiyonu, piyelonefrit, trigonit, üretrit, böbrek enfeksiyonu ve prostatit. Kfe Aptem taamsak şunları içsj& T,es Aİa,?ım!k.ier,cih,=ı.d,il,s?,!ı 'mlv ehidratasyon, hipovolemi, hipotansiyon. 9/43 f Poliüri şu tercih edilen terimleri içermektedir: pollakiüri, poliüri ve idrar çıkışında artış. Hematokritte başlangıca göre ortalama değişiklik 10 mg dapagliflozin için %2,30 karşısındaplasebo için -%0,33'tır. Dapagliflozin 10 mg ile tedavi edilen kişilerin %1,3'ünde >%55'likhematokrit değerleri bildirilirken, plasebo alan kişilerin %0,4'ünde bu düzey bildirilmiştir.h Plaseboya kıyasla dapagliflozin 10 mg ile başlangıca göre ortalama değişim yüzdesi şuşekilde olmuştur: total kolesterol %0,0'a karşı %2,5; HDL kolesterol % 2,7'ye karşı %6,0;LDL kolesterol -%1,0'a karşı %2,9; trigliseridler -%0,7'ye karşı -%2,7.i Bakınız Bölüm 4.4 jAdvers reaksiyon, pazarlama sonrası gözlem yoluyla tespit edildi. Döküntü, aşadaki tercih edilen terimleri içerir, klinik çalışmalardaki sıklığa göre sıralanmıştır: döküntü, yaygınlaşmışdöküntü, kaşıntılı döküntü, maküler döküntü, makülopapüler döküntü, döküntü püstüler,döküntü veziküller ve eritemli döküntü. Aktif ve plasebo kontrollü klinik çalışmalarda(dapagliflozin, N: 5936, tüm kontrol, N: 3403), döküntü sıklı sırasıyla dapagliflozin (%1,4)ve tüm kontroller (%1,4) için benzerdi. k Tip 2 diyabetli hastalar üzerinde gerçekleştirilen kardiyovasküler sonuçlar çalışmasında (DECLARE) bildirilmiştir. Sıklık, yıllık oranı temel almaktadır. * Hastaların > % 2'sinde ve plaseboya kıyasla dapagliflozin 10 mg ile tedavi edilen hastaların > %1'inde ve en az 3 hastada daha raporlanmıştır. ** Araştırıcı tarafından hastaların > %0,2'sinde çalışma tedavisiyle ilişkisi muhtemel, ilişkisi olası ya da ilişkili olarak bildirilmiştir ve plaseboya kıyasla > %1 fazla ve en az 3 fazla kişidapagliflozin 10 mg ile tedavi edilmiştir. Seçili advers reaksiyonların tanımıVulvovajinit, balanit ve ilişkili genital enfeksiyonlar13 çalışmalık güvenlilik havuzunda vulvovajinit, balanit ve ilişkili genital enfeksiyonlar 10 mg dapagliflozin ve plasebo alan gönüllülerin sırasıyla %5,5 ve %0,6'sında bildirilmiştir.Enfeksiyonların çoğunun hafif ila orta şiddetli olduğu görülmüştür ve gönüllüler ilk standarttedavi kürüne yanıt vermiştir. Enfeksiyonlar nadiren dapagliflozin tedavisinin kesilmesineneden olmuştur. Bu enfeksiyonların kadınlarda daha sık ortaya çıktı gözlenmiştir(dapagliflozin ve plasebo ile sırasıyla %8,4 ve %1,2) ve geçmiş öyküye sahip gönüllülerinrekürren enfeksiyon yaşama olasılının daha yüksek olduğu belirlenmiştir. DECLARE çalışmasında, ciddi genital enfeksiyon advers olayları yaşayan hastaların sayılarının düşük ve dengeli olduğu görülmüştür: dapagliflozin ve plasebo gruplarının herbirinde 2 hasta. DAPA-HF çalışmasında, dapagliflozin grubunda hiçbir hasta, ciddi genital enfeksiyonlara bağlı advers olay bildirmemiş, plasebo grubunda ise bir hasta böyle bir bildirimdebulunmuştur. Dapagliflozin grubunda genital enfeksiyonlara bağlı olarak tedavininbırakılmasına neden olan advers olaylar 7 (%0,3) hastada görülmüştür, plasebo grubunda iseböyle bir olay gözlenmemiştir. DELIVER çalışmasında, her bir tedavi grubundan bir hastada(<%0,1) ciddi genital enfeksiyonlara bağlı advers olay bildirmiştir. Dapagliflozin grubundagenital enfeksiyonlara bağlı olarak tedavinin bırakılmasına neden olan advers olaylar 3(%0,1) hastada görülmüştür, plasebo grubunda ise böyle bir olay gözlenmemiştir en wn6; DAPA-CKD çalışmasında, dapagliflozin grubunda genital enfeksiyonlardan oluşan ciddi advers olay bulunan 3 hasta (%0,1) varken, plasebo grubunda yoktur. Dapagliflozin grubundagenital enfeksiyonlar nedeniyle tedavinin bırakılmasına yol açan advers olay bulunan 3 hasta(%0,1) varken, plasebo grubunda yoktur. Diyabeti olmayan hiçbir hastada genitalciddi yan etkileri veya genital enfeksiyonlar nedeniyle tedavinin kesilmesine Lk}yŞHYyŞjK0Q3NRZmxyYııÜySH\ 3 Belge Takıp Adresılıttps://www Türkiye.govTr/sagiık-tıtck-eDysirilmemiştir. 10/43 Perineumda nekrotizan _ fasiit (Fournier gangreni)Dapagliflozin de dahil olmak üzere SGLT2 inhibitörleri alan hastalarda pazarlama sonrasında Fournier gangreni olguları bildirilmiştir (bkz. Bölüm 4.4). Tip 2 diabetes mellitus bulunan 17160 hasta ile yapılan ve medyan maruziyet süresinin 48 ay olduğu DECLARE çalışmasında, biri dapagliflozin ile tedavi edilen grupta ve 5'i plasebogrubunda olmak üzere 6 Fournier gangreni olgusu bildirilmiştir. HipoglisemiHipoglisemi sıklının diyabet konulu klinik çalışmalarda arka plan tedavisinin tipine bağlı olduğu görülmüştür. Monoterapide, metformine ilave ya da sitagliptine ilave (metforminle veya metforminsiz) dapagliflozinçalışmalarıiçin, minörhipoglisemiepizodlarının sıklıklarıtedavinin 102. haftasına kadar plasebo dahil tedavi grupları arasında benzer olmuştur (< %5). Tüm çalışmalarda majör hipoglisemi olayları yaygın olmayan sıklıkta gözlenmiştir ve dapagliflozinya da plasebo uygulanan gruplar arasında benzer olmuştur. İlave sülfonilüre ve ilave insülintedavilerininkullanıldıçalışmalardahipoglisemioranları daha yüksekolmuştur (bkz. Bölüm 4.5). Glimepiride ilave tedavi çalışmasında, 24 ve 48. haftalarda minör hipoglisemi epizodları, plasebo ile glimepirid uygulanan kombinasyon grup (sırasıyla %2,1 ve %2,1) ilekarşılaştırıldında 10 mg dapagliflozin ile glimepirid kombinasyonu uygulanan grupta dahasık (sırasıyla %6,0 ve %7,9) bildirilmiştir. İnsüline ilave çalışmasında, majör hipoglisemi epizodları, 24. ve 104. haftalarda 10 mg dapagliflozin ve insülin ile tedavi edilen bireylerin sırasıyla %0,5'i ve %1,0'ı ve 24. ve104. haftalarda plasebo ve insülin ile tedavi edilen bireylerin %0,5'inde bildirilmiştir. 24. ve104. haftalarda, minör hipoglisemi epizodları 10 mg dapagliflozin ve insülin alan bireylerinsırasıyla %40,3'ü ve %53,1'i ve plasebo ile insülin alan bireylerin %34,0'ında ve %41,6'sındabildirilmiştir. 24 haftaya kadar olan, metformin ve bir sülfonilüreye ekleme çalışmasında, majör hipoglisemi epizodu bildirilmemiştir. 10 mg dapagliflozine ek olarak metformin ve birsülfonilüre alan hastaların %12,8'inde ve plaseboya ek olarak metformin ve bir sülfonilürealan hastaların %3,7'sinde minör hipoglisemi epizodları bildirilmiştir. DECLARE çalışmasında plasebo ile karşılaştırıldında dapagliflozin tedavisiyle majör hipoglisemi riskinde artış gözlenmemiştir. Majör hipoglisemi olayları dapagliflozinle tedaviuygulanan 58 (%0,7) hastada ve plaseboyla tedavi uygulanan 83 (%1,0) hastada bildirilmiştir. DAPA-HF çalışmasında, hem dapagliflozin hem de plasebo tedavisi gruplarında 4 (%0,2) hastada majör hipoglisemi olayları gözlemlenmiştir. DELIVER çalışmasında, dapagliflozingrubunda 6 hastada (%0,2) ve plasebo grubunda 7 hastada (%0,2) majör hipoglisemi olaylarıbildirilmiştir. Majör hipoglisemi olayları sadece tip 2 diyabet bulunan hastalarda gözlenmiştir.DAPA-CKD çalışmasında, hipoglisemi majör olayları dapagliflozin grubunda 14 hastada(%0,7) ve plasebo grubunda 28 hastada (%1,3) bildirilmiş ve sadece tip 2 diyabet bulunanhastalarda gözlenmiştir. Volüm deplesyonuik havuzunda, volüm deplesyonuna işaret eden rea 3S3kOQ3NRZnıx\ijıUySH\ 3 Çelge^akırr Adregı:fıttps://www.turkıye.gQv.tr/sagük-tıtı3k,-ebysipovolemi ya da hipotansiyon bildirimlerini içerir) 10 mg dapagliflozin ve
onlar 13 Belge:oc(u: lZW56aJratasyon,11/43 plasebo alan bireylerin sırasıyla %1,10'unda ve %0,7'sinde bildirilmiştir; ciddi olaylar bireylerin < %0,2'sinde meydana gelmiş olup 10 mg dapagliflozin ve plasebo arasındadengelidir (bkz. Bölüm 4.4). DECLARE çalışmasında volüm deplesyonuna işaret eden olaylar yaşayan hastaların sayısının tedavi grupları arasında dengeli olduğu görülmüştür: dapagliflozin ve plasebo gruplarındasırasıyla 213 (%2,5) ve 207 (%2,4). Ciddi advers olaylar dapagliflozin ve plasebo grubundasırasıyla 81 (%0,9) ve 70 (%0,8) gönüllüde bildirilmiştir. Yaş, diüretik kullanımı, kan basıncıve anjiyotensin dönüştürücü enzim inhibitörleri (ACE-I)/anjiyotensin II tip 1 reseptörblokerleri (ARB) kullanımı alt gruplarında olayların genel olarak tedavi grupları arasındadengeli olduğu görülmüştür. Başlangıçta eGFR değeri < 60 mL/dak/1,73 m2 olan hastalardadapagliflozin grubunda volüm deplesyonuna işaret eden 19 ciddi advers olay, plasebogrubunda ise 13 olay ortaya çıkmıştır. DAPA-HF çalışmasında volüm deplesyonuna işaret eden olayların görüldüğü hastaların sayısı dapagliflozin grubunda 170 (%7,2), plasebo grubunda ise 153 (%6,5) olmuştur. Volümdeplesyonuna işaret eden ciddi olaylar yaşayan hastaların sayısının, dapagliflozin grubunda(23 [%1,0]) plasebo grubundakine kıyasla (38 [%1,6]) daha düşük olduğu gözlenmiştir.Sonuçların başlangıçta diyabet var olup olmamasından ve başlangıçtaki eGFR düzeyindenbamsız şekilde birbirine yakın olduğu gözlenmiştir. DELIVER çalışmasında, volümdeplesyonuna işaret eden ciddi advers olay yaşayan hastaların sayısı dapagliflozin grubunda35 (%1,1) ve plasebo grubunda 31 (%1)'dir. DAPA-CKD çalışmasında, volüm deplesyonuna işaret eden olayların görüldüğü hastaların sayısı dapagliflozin grubunda 120 (%5,6), plasebo grubunda ise 84 (%3,9) olmuştur.Dapagliflozin grubunda volüm deplesyonuna işaret eden ciddi advers olay yaşayan hastalarınsayısı 16 hasta (%0,7) iken, plasebo grubunda 15 hasta (%0,7)'dır. Tip 2 diyabette diyabetik ketoasidozMedyan maruziyet süresinin 48 ay olduğu DECLARE çalışmasında, dapagliflozin 10 mg grubunda 27 hastada, plasebo grubunda ise 12 hastada DKA olayları rapor edilmiştir. Olaylarçalışma periyodu boyunca eşit dalımlı olarak gerçekleşmiştir. Dapagliflozin grubunda DKAolaylarının görüldüğü 27 hastanın 22'sinin olay sırasında eşzamanlı insülin tedavisi almaktaolduğu saptanmıştır. DKA için hızlandırıcı faktörler, bir tip 2 diabetes mellituspopülasyonunda beklendiği şekilde olmuştur (bkz. Bölüm 4.4). DAPA-HF çalışmasında DKA olayları dapagliflozin grubunda tip 2 diyabetli 3 hastada bildirilmiş, plasebo grubunda ise hiçbir hastada bildirilmemiştir. DELIVER çalışmasındaDKA olayları dapagliflozin grubunda tip 2 diyabetli 2 hastada bildirilmiş, plasebo grubundaise hiçbir hastada bildirilmemiştir. DAPA-CKD çalışmasında DKA olayları dapagliflozin grubunda hiçbir hastada bildirilmezken, plasebo grubunda tip 2 diyabeti bulunan 2 hastada bildirilmiştir. İdrar yolu enfeksiyonları13 çalışmalık güvenlilik havuzunda, idrar yolu enfeksiyonları 10 mg dapagliflozin için plaseboya kıyasla daha sık bildirilmiştir (sırasıyla %4,7 karşısında %3,5; bkz. Bölüm 4.4).Enfeksiyonların çoğu hafif ila orta derecede olmuş ve bireyler ilk standart tedavi kürüne yanıtvermiş, nadir durumlarda dapagliflozin tedavisinin kesilmesi gerekmiştir. Bu enfeksiyonlarkadınlar arasında daha sık gözlenmiştir ve öyküsü olan hastaların enfeksiyon nüksü geliştirmeolasılı daha yüksek olmuştur. 12/43 DECLARE çalışmasında idrar yolu enfeksiyonu görülen ciddi advers olayları 10 mg dapagliflozin ile plasebo ile olandan daha düşük sıklıkta bildirilmiştir; sırasıyla 79 (%0,9)olaya karşılık 109 (%1,3) olay ortaya çıkmıştır. DAPA-HF çalışmasında idrar yolu enfeksiyonu görülen ciddi advers olaylar yaşayan hastaların sayısı dapagliflozin grubunda 14 (%0,6) , plasebo grubunda ise 17 (%0,7) olmuştur.Dapagliflozin ve plasebo gruplarının her birinde idrar yolu enfeksiyonlarına bağlı olaraktedavinin bırakılmasına neden olan advers olaylar 5 (%0,2) hastada görülmüştür. DELIVERçalışmasında, idrar yolu enfeksiyonu görülen ciddi advers olaylar yaşayan hastaların sayısıdapagliflozin grubunda 41 (%1,3) ve plasebo grubunda is 37 (%1,2) olmuştur. Dapagliflozingrubunda idrar yolu enfeksiyonlarına bağlı olarak tedavinin bırakılmasına neden olan adversolaylar 13 (%0,4) hastada ve plasebo grubunda ise 9 (%0,3) hastada görülmüştür. DAPA-CKD çalışmasında, idrar yolu enfeksiyonu görülen ciddi advers olaylar yaşayan hastaların sayısı dapagliflozin grubunda 29 (%1,3), plasebo grubunda ise 18 (%0,8) olmuştur.Dapagliflozin grubunda idrar yolu enfeksiyonlarına bağlı olarak tedavinin bırakılmasınaneden olan advers olaylar 8 hastada (%0,4) görülürken, plasebo grubunda ise 3 hastada(%0,1) görülmüştür. İdrar yolu enfeksiyonlarına bağlı ciddi advers olaylar veya idrar yoluenfeksiyonları nedeniyle tedavinin kesilmesine yol açan advers olaylar bildiren diyabetiolmayan hastaların sayısı, tedavi grupları arasında benzerdir (dapagliflozin ve plasebogruplarında sırasıyla ciddi advers olaylar için 6 [%0,9]'a karşı 4 [%0,6] ve tedavininkesilmesine neden olan advers olaylar için 1 [%0,1]'e karşı 0). Kreatinin artışıKreatinin artışıyla ilişkili advers reaksiyonlar gruplanmıştır (örn. Renal kreatinin klirensinde azalma, böbrek fonksiyon bozukluğu, kan kreatininde artış ve glomerüler filtrasyon hızındaazalma). 13 çalışmalık güvenlilik havuzunda, bu reaksiyon gruplaması dapagliflozin 10 mg veplasebo alan hastaların sırasıyla %3,2 ve %1,8'inde bildirilmiştir. Normal böbrek fonksiyonuolan ya da hafif böbrek bozukluğu bulunan hastalarda (başlangıçta eGFR > 60mL/dak/1,73m2) bu reaksiyon gruplaması dapagliflozin 10 mg ve plasebo alan hastalarınsırasıyla %1,3 ve %0,8'inde bildirilmiştir. Bu reaksiyonlar, başlangıçta eGFR > 30 ve < 60mL/dak/1,73m2 hastalarda daha yaygın olmuştur (dapagliflozin 10 mg ile %1,85 ve plaseboile %9,3). Böbrek ile ilişkili advers olaylar yaşamış olan hastaların ileri değerlendirmesi bunların çoğunda başlangıca kıyasla <44 mikromol/L (< 0,5 mg/dL) kreatinin değişiklikleri olduğunugöstermiştir. Kreatinin artışları sürekli tedavi sırasında genellikle geçici ya da tedavibırakıldıktan sonra geri dönüşlü olmuştur. Yaşlı hastaları ve böbrek fonksiyon bozukluğu (60 mL/dak/1,73 m2'den az eGFR) bulunan hastaları içeren DECLARE çalışmasında, eGFR her iki tedavi grubunda zamanla azalmıştır.Plasebo grubu ile karşılaştırıldında, dapagliflozin grubunda l.yılda ortalama eGFR birazdaha düşük olurken, 4. yılda ortalama eGFR biraz daha yüksek olmuştur. DAPA-HF ve DELIVER çalışmalarında hem dapagliflozin grubunda hem de plasebo grubunda eGFR zaman içinde düşmüştür. DAPA-HF çalışmasında, ortalama eGFR'debaşlangıçta gözlenen azalma dapagliflozin grubunda -4,3 mL/dak/1,73 m2, plasebo grubundaise -1,1 mL/dak/1,73 m2 olmuştur. Tedavi gruplarında eGFR'de başlangıca kıyasla 20. aydagözlenen farkın birbirine yakın olduğu görülmüştür: dapagliflozinle -5,3 mL/dak/1,73 m2,plaseboyla -4,5 mL/dak/1,73 m2. DELIVER çalışmasında, bir ayda ortalama eGFR'deki düşüş
ıda , 0,4, mL/dak/1,73m resi: https:İrwww. turkıy e. gov. tr/s a
dapagliflozin grubunda
3 ,mL S3£0Q3N:uştur. saglık-tıtck-ebysBelge Doelge^Takip Â<13/43 24. ayda, başlangıç eGF'ye göre değişim tedavi grupları arasında benzerdir: dapagliflozin grubunda 4,2 mL/dak/1,73 m2 ve plasebo grubunda 3,2 mL/dak/1,73 m2. DAPA-CKD çalışmasında, hem dapagliflozin grubunda hem de plasebo grubunda eGFR zaman içinde düşmüştür. Ortalama eGFR'deki ilk gözlenen azalma (14. gün) dapagliflozingrubunda -4,0 mL/dak/1,73 m2, plasebo grubunda ise -0,8 mL/dak/1,73 m2 olmuştur. 28.ayda,başlangıç eGFR'ye göre değişim, dapagliflozin grubunda -7,4 ml/dk/1,73 m2 ve plasebogrubunda ise -8,6 ml/dk/1,73 m2'dir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr;[email protected]. Doz aşımı ve tedavisiDapagliflozin, 500 mg'a (maksimum önerilen insan dozunun 50 katı) varan tek oral dozlarda sağlıklı bireylerde herhangi bir toksisite göstermemiştir. Bu bireylerin idrarında, bir süreboyunca dozla ilişkili olarak (500 mg doz için en az 5 gün) tespit edilir glukoz düzeylerigözlenmiş, dehidratasyon, hipotansiyon ya da elektrolit dengesizliği bildirimi olmamış veQTc aralında klinik açıdan anlamlı herhangi bir etki söz konusu olmamıştır. Hipoglisemiinsidansı plasebo ile benzer olmuştur. Sağlıklı bireylerde ve tip 2 diabetes mellitusu olanbireylere 2 hafta süreyle 100 mg'a (maksimum önerilen insan dozunun 10 katı) varan gündetek doz rejiminin uygulandı klinik çalışmalarda, hipoglisemi insidansı plaseboya göre hafifderecede daha yüksek olmuş ve dozla ilişkili olmadı görülmüştür. Dehidratasyon,hipotansiyon dahil advers reaksiyonların oranları plasebo ile benzer olmuş, böbrekfonksiyonu biyolojik göstergeleri ve serum elektrolitleri gibi laboratuvar parametrelerindeklinik olarak anlamlı, dozla bağlantılı değişiklikler olmamıştır. Doz aşımı durumunda, hastanın klinik durumunun gerektirdiği şekilde uygun destekleyici tedavi başlatılmalıdır. Dapagliflozinin hemodiyaliz ile vücuttan uzaklaştırılmasıçalışılmamıştır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Diyabet tedavisinde kullanılan ilaçlar, sodyum-glukoz ko-transporter 2 (SGLT2) inhibitörleriATC kodu: A10BK01 Etki mekanizması Dapagliflozin yüksek derecede potent (Ki: 0,55 nM), selektif ve geri dönüşümlü SGLT2 inhibitörüdür. Dapagliflozinle sağlanan SGLT2 inhibisyonu, sodyum reabsorbsiyonunda eşzamanlı bir azalmayla, proksimal renal tübülde glomerüler filtrattan glukoz reabsorbsiyonunu azaltır ve BdgCDoü^^s[K«tek?z?isıkreffi?nuQvgR2f,aotik,idiü/ez ortaKa ¥ıkart*raB:8lf^isıy.lâ.dapa8lifls^i=.âigsal tübüle sodyum taşınmasını arttırır ve bu da tübüloglomerüler geribildirimi arttırır ve 14/43 intraglomeruler basıncı azaltır. Bu, ozmotik diürez ile birlikte, aşırı volüm yüklemesinde azalma, kan basıncında düşüş ve ön yük ve son yükte azalma sağlar ve bunlar kardiyakyeniden modelleme ve diyastolik fonksiyon ve renal fonksiyonu koruma üzerinde yararlıetkiler ortaya çıkarabilir. Dapagliflozinin kardiyak ve renal faydaları kan glukozu düşürücüetkisinin ötesine geçer ve DAPA-HF, DELIVER ve DAPA-CKD çalışmalarında ortayakonmuş olduğu gibi diyabet hastaları ile sınırlı değildir. Diğer etkiler arasında hematokritartışı ve vücut arlında azalma bulunur. Dapagliflozin, böbreklerden glukoz reabsorpsiyonunu azaltarak gerek açlık gerekse post-prandiyal glukoz düzeylerini düşürür, idrarla glukoz atılımı sağlar. Bu glukoz atılımı (glukuretik etki) ilk dozdan sonra gözlenir, 24 saatlik doz uygulama aralı boyunca süreklidirve tedavi süresince bu etki korunur. Böbrek tarafından bu mekanizma ile uzaklaştırılan glukozmiktarı, kan glukoz konsantrasyonu ve glomerüler filtrasyon hızına bağlıdır. Dolayısıylaglukoz düzeyi normal olan gönüllülerde dapagliflozinin hipoglisemiye yol açma eğilimidüşüktür. Dapagliflozin hipoglisemiye cevaben normal endojen glukoz üretimini bozmaz.Dapagliflozin, insülin sekresyonunundan ve insülin etkisinden bamsız etki gösterir.Dapagliflozin ile yürütülen klinik çalışmalarda beta hücre fonksiyonu için homeostaz modeldeğerlendirmesinde (HOMA beta hücre) düzelme gözlenmiştir. SGLT2 selektif şekilde böbrekte eksprese olur. Dapagliflozin, periferik dokulara glukoz taşınmasında önemli diğer glukoz taşıyıcılarını inhibe etmez ve glukoz absorpsiyonundansorumlu, barsaktaki başlıca taşıyıcı olan SGLTl'e göre SGLT2 için >1400 kat dahaseçicidir. Farmakodinamik etkilerSağlıklı bireylerde ve tip 2 diabetes mellitusu olan bireylerde dapagliflozin uygulamasından sonra idrarla atılan glukoz miktarında artışlar görülmüştür. 12 hafta süreyle tip 2 diabetesmellitusu olan bireylere uygulanan 10 mg/gün dapagliflozin dozunda gün başına yaklaşık 70 gglukoz atılmıştır (280 kilokalori/gün'e eşdeğer). İki yıl boyunca 10 mg/gün dapagliflozinverilen tip 2 diabetes mellitusu olan bireylerde glukoz atılımının korunduğu yönünde kanıtlargörülmüştür. Tip 2 diabetes mellitusu olan bireylerde dapagliflozin ile sağlanan üriner glukoz atılımı ayrıca ozmotik diüreze ve idrar hacminde artışa neden olur. 10 mg dapagliflozin ile tedavi edilen tip2 diabetes mellitusu olan bireylerdeki idrar hacmi artışları 12 hafta süreyle korunmuştur veyaklaşık 375 mL/gün düzeyinde olmuştur. İdrar hacmindeki artış, idrarla sodyum atılımında,serum sodyum konsantrasyonlarında değişiklikler ile bağlantılı olmayan küçük ve geçici birartış ile ilişkilendirilmiştir. Ayrıca idrarla ürik asit atılımı da geçici olarak artmış (3-7 gün) ve buna, serum ürik asit konsantrasyonunda sürekli bir azalma eşlik etmiştir. 24. haftada serum ürik asitkonsantrasyonlarındaki düşüşler -48,3 mikromol/L ila -18,3 mikromol/L (-0,87 mg/dL ila- 0,33 mg/dL) aralında olmuştur. Klinik etkililik ve güvenlilikTip 2 diabetes mellitusGlisemik kontrolünün iyileşmesi ve kardiyovasküler ve renal morbidite ve mortalitenin azalması tip 2 diyabet tedavisinin bütünleyici parçalarıdır.
15/43 FORZİGA'nın glisemik etkililiğini ve güvenliliğini değerlendirmek üzere 7056 tip 2 diyabeti olan bireyler ile on dört adet çift kör, randomize, kontrollü klinik çalışma gerçekleştirilmiştir:bu çalışmalarda 4737 birey dapagliflozin ile tedavi edilmiştir. On iki çalışmada tedavi süresi24 hafta olup; sekizinde 24 ila 80 haftalık uzatma dönemleri yer almıştır (toplamda 104haftaya kadar çalışma süresi), bir çalışma 28 hafta tedavi süresi ve bir çalışma süresi 52 haftaolup; 52 haftalık ve 104 haftalık uzatma dönemleri yer almıştır (toplam çalışma süresi 208hafta). Ortalama diyabet süresi 1,4 ila 16,9 yıl aralında olmuştur. Çalışmaya katılanbireylerin %50'sinde hafif derecede böbrek yetmezliği ve %11'inde orta derecede böbrekyetmezliği olmuştur. Bireylerin %51'i erkek, %84'ü Beyaz, %8'i Asyalı, %4'ü Siyah ve %4'üdiğer etnik gruplardandır. Bireylerin %81'inde vücut kitle indeksi (VKİ) > 27'dir. Ayrıca,yeterince kontrol altına alınamayan tip 2 diyabeti ve hipertansiyonu olan hastalarda iki adet12 haftalık, plasebo-kontrollü çalışma yürütülmüştür. Kardiyovasküler ve renal olaylar üzerindeki etkinin değerlendirilmesi amacıyla, kanıtlanmış kardiyovasküler hastalı bulunan veya bulunmayan, tip 2 diyabetli 17160 hasta üzerindeplaseboyla karşılaştırmalı şekilde 10 mg dapagliflozin ile bir kardiyovasküler sonuç çalışması(DECLARE) gerçekleştirilmiştir. Glisemik kontrolMonoterapiYeterli derecede kontrol edilemeyen tip 2 diabetes mellitusu olan bireylerde FORZİGA ile monoterapinin güvenliliğini ve etkililiğini değerlendirme amacıyla çift kör, plasebo kontrollü,24 hafta süreli (ek uzatma süreli) bir çalışma gerçekleştirilmiştir. Dapagliflozin ile günde birkez tedavi sonucunda HbA1c'de plasebo ile karşılaştırıldında istatistiksel olarak anlamlıdüşüşler sağlanmıştır (p < 0,0001) (Tablo 2). Uzatma döneminde HbA1c düşüşü 102. haftaya kadar sürmüştür. (10 mg dapagliflozin ve plasebo için düzeltilmiş başlangıca göre ortalama değişiklik sırasıyla -%0,61 ve -%0,17).
16/43 c Başlangıçtaki değere göre düzeltilen küçük kareler ortalaması *p değeri < 0,0001; plasebo karşısında § İkincil sonlanım noktaları için ardışık test prosedürü nedeniyle istatistiksel anlamlılık açısından değerlendirilmemiştir.x GA: Güven Aralı İlave kombinasyon tedavisi52 haftalık, aktif kontrollü bir eşdeğerlik çalışmasında (52 ve 104 haftalık uzatma periyoduna sahip), glisemik kontrolün yetersiz olduğu bireylerde (HbA1c > %6,5 ve < %10) metformineilave tedavi olarak bir sülfonilüreye (glipizid) karşı, metformine ilave tedavi olarakFORZİGA değerlendirilmiştir. Bulgular, glipizide kıyasla HbA1c'de başlangıçtan 52. haftayakadar benzer bir ortalama azalmayı ve böylece eşdeğerliği göstermiştir (Tablo 3). 104.haftada, HbAlc'de başlangıca göre düzeltilmiş ortalama değişiklik dapagliflozin için -%0,32ve glipizid için -%0,14'tür. 208. haftada, Hb1Ac'de başlangıca göre düzeltilmiş ortalamadeğişiklik dapagliflozin için %-0,10 ve glipizid için 0,20% dir. 52. ve 104. ve 208. haftalarda,glipizid ile tedavi edilen grup ile (sırasıyla %40,8, %47,0, %50,0) karşılaştırıldındadapagliflozin ile tedavi edilen grupta (sırasıyla %3,5, %4,3 ve %5,0) anlamlı olarak dahadüşük bir birey oranında en az bir hipoglisemi olayı yaşanmıştır.104. ve 208. haftadaçalışmaya devam eden birey oranı dapagliflozin ile tedavi edilen grup için %56,2 ve %39,7 veglipizid ile tedavi edilen grup için %50,0 ve %34,6'dir. Tablo 3. Metformine ilave tedavi olarak dapagliflozin ile glipizidi karşılaştıran aktifkontrollü çalışmanın 52. hafta sonuçları (LOCFa)_Dapagliflozin GlipizidParametre_Nb__HbAlc (%)Başlangıç (ortalama) Başlangıca göre değişiklik cc(%95 GAx))_Vücut arlı (kg)Başlangıç (ortalama) Başlangıca göre değişiklik cc(%95 GAx))_+ metformin_+ metformin0,00d (-0,11, 0,11)_korunmuştur. 48. haftada sitagliptine ilave edildiğinde (metforminle veya metforminsiz), 10 mg dapagliflozin ve plasebo için başlangıca göre düzeltilmiş ortalama değişiklik sırasıyla-%0,30'dur ve %0,38'dir. Metformine ilave edilme çalışması için, HbA1c'deki azalmalar102. haftaya kadar korunmuştur (10 mg dapagliflozin ve plasebo için başlangıca göredüzeltilmiş ortalama değişiklik sırasıyla -%0,78 ve %0,02). İnsülin için 104. haftada (ilaveoral glukoz düşürücü tıbbi ürünler varlında veya yokluğunda), HbA1c'deki azalmalarailişkin olarak 10 mg dapagliflozin ve plasebo için başlangıca göre düzeltilmiş ortalamadeğişiklik sırasıyla -%0,71 ve -%0,06'dır. 48 ve 104. haftalarda insülin dozu 76 IU/gün'lükortalama bir dozda 10 mg dapagliflozin ile tedavi edilen bireylerde başlangıca göre stabilkalmıştır. Plasebo grubunda 48 ve 104. haftalarda başlangıca göre sırasıyla 10,5 IU/gün ve18,3 IU/gün'lük (ortalama doz 84 ve 92 IU/gün) ortalama bir artış söz konusudur. 104.haftada çalışmada kalan birey oranı 10 mg dapagliflozin ile tedavi edilen grup için %72,4'türve plasebo grubu için %54,8'dir.
1 Metformin > 1500 mg/gün 2 Sitagliptin 100 mg/gün a LOCF: İleri aktarılan son gözlem (kurtarma tedavisi yapılan gönüllülerde kurtarma öncesinde) b Kısa süreli çift kör dönemde çift kör çalışma ilacından en az bir doz almış olan tüm randomize bireyler c Başlangıçtaki değere göre düzeltilen küçük kareler ortalaması *p değeri < 0,0001; plasebo + oral glukoz düşürücü tıbbi ürüne karşı**p değeri < 0,05; plasebo + oral glukoz düşürücü tıbbi ürüne karşıx GA: Güven Aralı
18/43 Tablo 5. 24 haftalık, plasebo-kontrollü, ek sülfonilüre (glimepirid) ya da metformin ve bir sülfonilüre ile kombine dapagliflozin çalışmalarının sonuçları
1glimepirid 4 mg/gün; 2Metformin (çabuk- ya da uzatılmış-salımlı formülasyonlar) >1500 mg/gün, ek olarak, deneye katılmadan önce en az 8 hafta boyunca, maksimum dozun en az yarısı olacak şekilde,maksimum tolere edilebilir dozda bir sülfonilüre aBaşlangıç seviyesi ve en az 1 başlangıç sonrası etkinlik ölçümü olan randomize ve tedavi edilen hastalar d LOCF: İleri aktarılan son gözlem (kurtarma tedavisi yapılan bireylerde kurtarma öncesinde) e BTÖ: Boylamsal tekrarlanmış ölçümler analizi * plasebo + oral glukoz-düşürücü tıbbi ürün(ler)e göre p-değeri < 0,0001
19/43
a LOCF: İleri aktarılan son gözlem (eğer gerekmişse ilk insülin dozu yükseltiminden önce veya yükseltildiği gün) b Kısa süreli çift kör dönemde, çift kör çalışma ilacından en az bir doz almış olan tüm randomize bireyler c Oral glukoz düşürücü tıbbi ürün varlı ve başlangıçtaki değere düzeltilen küçük kareler ortalaması *p değeri < 0,0001; plasebo + insülin ± oral glukoz düşürücü tıbbi ürüne karşı **p değeri < 0,05; plasebo + insülin ± oral glukoz düşürücü tıbbi ürüne karşı1İnsülin rejimlerinde (kısa etkili, orta etkili ve bazal insülin dahil) dozun yükseltilmesineyalnızca bireylerin önceden belirlenmiş olan açlık plazma glukozu (AKŞ) kriterlerinikarşılaması halinde izin verilmiştir.) 2 Bireylerin %50'si başlangıçta insülin monoterapisindedir; %50'si insüline ilave olarak 1 veya 2 oral glukoz düşürücü tıbbi ürün(ler) kullanmaktadır. İkinci olarak tanımlanangruptakilerin %80'i tek başına metformin, %12'si metformin + sülfonilüre tedavisindedir vekalanlar diğer oral glukoz düşürücü tıbbi ürünler kullanmaktadır. İlaç-naif hastalarda metformin ile kombinasyon halindeİlaç-naif hastalarda metformin ile kombinasyon halinde dapagliflozin'in (5 mg veya 10 mg) etkililik ve güvenliliğini her iki ilacın tek başına uygulanmasına kıyasla değerlendirmek üzereiki aktif kontrollü, 24 haftalık çalışmaya yeterli düzeyde kontrol altına alınmayan tip 2 Belge Dcdiyabet©İlı(HbA1c^S%75 3^ I%12)ftopllami 1236 Ba^naif hasta1ka:tılmıştiıriy e.gov.tr/saglik-titck-ebys 20/43 Metformin (günde 2000 mg'a kadar) ile kombinasyon halinde dapagliflozin 10 mg tedavisi, kombinasyonun ayrı ayrı bileşenlerine kıyasla HbAlc'de anlamlı iyileşme sağlamış (Tablo 7)ve açlık plazma glukozunda (AKŞ) (kombinasyonun ayrı ayrı bileşenlerine kıyasla) ve vücutarlında (metformine kıyasla) daha fazla düşüşle sonuçlanmıştır. Tablo 7. İlaç-naif hastalarda dapagliflozin ve metformin kombinasyonunu araştıran aktif kontrollü bir çalışmada 24. hafta sonuçları (LOCFa)
aLOCF: son gözlemin ileriye taşınması (kurtarılan hastalar için kurtarma tedavisinden önce). bKısa süreli çift kör periyotta en az bir doz çift kör çalışma ilacı alan tüm randomize hastalar.cBaşlangıç değerleri için ayarlanan en küçük kareler ortalaması. *p-değeri <0,0001. Uzatılmış salımlı eksenatid ile kombinasyon tedavisiYirmi sekiz haftalık çift kör, aktif komparatör-kontrollü bir çalışmada, dapagliflozin ve uzatılmış salımlı eksenatid (bir GLP-1 reseptör agonisti) kombinasyonu, tek başına metforminile yeterli glisemik kontrol sağlanamayan (HbA1c >%8 ve < %12) hastalarda tek başınadapagliflozin ve uzatılmış salımlı eksenatid ile karşılaştırılmıştır. Tüm tedavi gruplarındabaşlangıca kıyasla HbAlc'de düşüş olmuştur. Dapagliflozin 10 mg ve uzatılmış salımlıeksenatid kombinasyonu uygulanan grupta, başlangıca göre HbAlc'de tek başınadapagliflozin ve uzatılmış salımlı eksenatid ile görülenden daha fazla düşüş gözlenmiştir(Tablo 8).
21/43 Tablo 8. Metformin ile kombinasyon halinde tek başına dapagliflozin ve uzatılmış salımlı eksenatide kıyasla dapagliflozin ve uzatılmış salımlı eksenatid kombinasyonunuaraştıran 28 haftalık çalışma sonuçları (tedavi amaçlanmış hastalar)
QD=günde bir kez, QW=haftada bir kez, N=hasta sayısı, GA=güven aralı. a Ayarlanmış en küçük kareler ortalamaları (LS Ortalamaları) ve 28. haftada başlangıçdeğerlerinden itibaren değişimde tedavi grupları arasındaki farklar, tekrarlı ölçümlere sahipbir karışık modelle (MMRM) modellenmiş ve bu modelde tedavi, bölge, başlangıç HbAlcgrubu (< %9,0 veya >% 9,0), hafta ve hafta bazında tedavi etkileşimi sabit faktörler,başlangıç değerleri ise eşdeğişken olarak kullanılmıştır. *p < 0,001, **p < 0,01. P-değerlerinin tümü üst katlılık için ayarlanmış p-değerleridir. Analizler kurtarma tedavisinden sonraki ölçümleri ve çalışma ilacının erken sonlandırılmasından sonra yapılan ölçümleri içermez. Açlık plazma glukozuMonoterapi olarak veya metformin, glimepiride, metformin ve bir sülfonilüre, sitagliptin (metforminle veya metforminsiz) ya da insüline ilave tedavi olarak 10 mg dapagliflozin iletedavi sonucunda, AKŞ düzeylerinde plasebo ile karşılaştırıldında (-0,33 mmol/L ila0,21 mmol/L [-6,0 mg/dL ila 3,8 mg/dL]) istatistiksel olarak anlamlı düşüşler meydanagelmiştir (-1,90 mmol/L ila -1,20 mmol/L [-34,2 mg/dL ila -21,7 mg/dL]). Bu etki, tedavininbirinci haftasında gözlenmiştir ve 104. haftaya kadar uzatılan çalışmalarda devam etmiştir. Dapagliflozin 10 mg ve uzatılmış salımlı eksenatid kombinasyonu 28. hafta AKŞ'de anlamlı şekra£( aafia ¦ f» düşüp1 MüçMmştır: -3:6b1 mmMh (-658m/df tek topa22/43 dapagliflozin için -2,73 mmol/l (-49,2 mg/dl) ile (p < 0,001) ve tek başına eksenatid için -2,54 mmol/l (-45,8 mg/dl) ile (p < 0,001) karşılaştırılmalı. Yalnızca bu konunun araştırıldı bir çalışmada eGFR değeri > 45 ila < 60 mL/dak/1,73 m2 olan diyabetli hastalarda dapagliflozin ile uygulanan tedavi 24 haftada FPG'de azalmalarortaya çıkarmıştır: plaseboyla elde edilen -0,27 mmol/L 'ye karşılık (-4,87 mg/dL) -1,19mmol/L (-21,46 mg/dL) (p=0,001). Post-prandiyal glukozGlimepiride ilave olarak 10 mg dapagliflozin ile tedavi sonucunda 24. haftada 2 saatlik post-prandiyal glukoz değerinde istatistiksel olarak anlamlı düşüşler sağlanmış olup bu etki 48. haftaya kadar devam etmiştir. Sitagliptine (metforminle veya metforminsiz) ilave olarak 10 mg dapagliflozin tedavisi, 24 haftada, 2 saatlik post-prandiyal glukoz düzeyinde azalmalar ile sonuçlanmış olup bu etki48. haftaya kadar devam etmiştir. Dapagliflozin 10 mg ve uzatılmış salımlı eksenatid kombinasyonu, her iki tıbbi ürünün tek başına uygulamasına kıyasla 28. haftada 2. saatlik post-prandiyal glukoz düzeyinde anlamlışekilde daha fazla düşüşle sonuçlanmıştır. Vücut arlıMetformin, glimepirid, metformin ve bir sülfonilüre, sitagliptin (metforminle veya metforminsiz) veya insüline ilave olarak 10 mg dapagliflozin, 24. haftada vücut arlındaistatistiksel olarak anlamlı düşüş sağlamıştır (p < 0,0001, Tablo 4 ve 5). Bu etkiler uzun süreliçalışmalarda korunmuştur. 48. haftada, plaseboya kıyasla sitagliptine ilave tedavi olarak(metforminle veya metforminsiz) dapagliflozin için fark -2,22 kg'dır. 102. haftada, plaseboyakıyasla metformine ilave tedavi olarak veya plaseboya kıyasla insüline ilave olarakdapagliflozin için fark sırasıyla -2,14 ve -2,88 kg'dır. Aktif kontrollü bir eşdeğerlik çalışmasında metformine ilave tedavi olarak dapagliflozin, glipizide kıyasla 52. haftada vücut arlında -4,65 kg'lık istatistiksel olarak anlamlı birazalma (p < 0,0001, Tablo 3) ile sonuçlanmış ve bu, 104. ve 208. haftada korunmuştur(sırasıyla -5,06 kg ve -4,38 kg ). Dapagliflozin 10 mg ve uzatılmış salımlı eksenatid kombinasyonu, her iki tıbbi ürünün tek başına uygulamasına kıyasla anlamlı şekilde daha fazla kilo kaybı ile sonuçlanmıştır (Tablo8). Vücut bileşimini değerlendirmek üzere çift enerjili X-ışını absorpsiyometrisinin (DXA) kullanıldı, 182 diyabetik birey ile gerçekleştirilen 24 haftalık bir çalışma, yağsız doku veyasıvı kaybı yerine DXA ile ölçüldüğünde, plasebo ve metformin ile karşılaştırıldında 10 mgdapagliflozin ve metformin ile sırasıyla vücut arlında ve vücut yağ kütlesinde düşüşlerinolduğunu göstermiştir. FORZİGA ve metformin ile tedavi sonucunda, manyetik rezonansgörüntüleme alt çalışmasında plasebo ve metformin tedavisi ile karşılaştırıldında iç organyağ dokusunda sayısal azalma gözlenmiştir. Kan basıncı13 plasebo kontrollü çalışmanın önceden tanımlanmış olan birleştirilmiş analizinde, 24. haftada 10 mg dapagliflozin ile tedavi, sistolik kan basıncında başlangıca göre -3,7 mmHg ve ile sonuçlanırken aynı w.tumye.go\otr/saglık-tıtck-ebys-1,8 m ast
işi Adre9:lfttps://www.turkıye.goVtr/sag'23/43 değerler plasebo grubu için sırasıyla -0,5 mmHg ve -0,5 mmHg olmuştur. 104 haftaya kadar benzer azalmalar gözlenmiştir. Dapagliflozin 10 mg ve uzatılmış salımlı eksenatid kombinasyonu, tek başına dapagliflozin (1,8 mmHg, p < 0,05) ve tek başına uzatılmış salımlı eksenatide (-1,2 mmHg, p < 0,01) kıyasla 28. haftada sistolik kan basıncında anlamlı şekilde daha fazla düşüşle (-4,3 mmHg)sonuçlanmıştır. Yeterince kontrol altına alınamayan tip 2 diyabeti ve hipertansiyonu (bir çalışmada bir ACE-I ya da ARB ile önceden mevcut stabil tedaviye ve diğer çalışmada ACE-I ya da ARB artı birilave antihipertansif tedaviye rağmen) olan toplam 1062 hasta, iki adet 12-haftalık, plasebo-kontrollü çalışmada dapagliflozin 10 mg ya da plasebo ile tedavi edilmiştir. Her iki çalışmada,12. haftada dapagliflozin 10 mg artı alışıldık antidiyabetik tedavi, HbAlc'de düzelmesağlamış ve plasebo açısından düzeltilmiş sistolik kan basıncında sırasıyla ortalama 3,1 ve 4,3mmHg azalma sağlamıştır. Yalnızca bu konunun araştırıldı bir çalışmada eGFR değeri > 45 ila < 60 mL/dak/1,73 m2 olan diyabetli hastalarda dapagliflozin ile uygulanan tedavi 24 haftada oturur pozisyondakisistolik kan basıncında azalmalar ortaya çıkarmıştır: plaseboyla elde edilen -1,7 mmHg'yekarşılık -4,8 mmHg (p < 0,05). Orta derecede böbrek yetmezliği görülen hastalarda glisemik kontrol KBH 3A (eGFR > 45 ila< 60 mL/dak/1,73 m2)Dapagliflozinin etkililiği yalnızca bu konunun araştırıldı bir çalışmada eGFR değeri > 45 ila < 60 mL/dak/1,73 m2 olan ve olağan bakımla yeterli glisemik kontrol sağlanamayan diyabetlihastalarda değerlendirilmiştir. Dapagliflozinle uygulanan tedavi HbAlc'de ve vücutarlında plaseboya kıyasla azalmalar ortaya çıkarmıştır (Tablo 9).
24/43 Başlangıç HbAlc değeri > %9 olan hastalarBaşlangıçta HbAlc değeri > %9,0 olan bireylerle gerçekleştirilen önceden tanımlanmış olan bir analizde 10 mg dapagliflozin ile tedavi sonucunda 24. haftada HbAlc'de istatistikselolarak anlamlı düşüşler elde edilmiştir (monoterapi olarak: düzeltilmiş başlangıca göreortalama değişiklik: 10 mg dapagliflozin ve plasebo için sırasıyla -%2,04 ve %0,19;metformine ilave tedavi olarak: düzeltilmiş başlangıca göre ortalama değişiklik: dapagliflozinve plasebo için sırasıyla -%1,32% ve -%0,53). Kardiyovasküler ve renal sonuçlarDapagliflozinin Kardiyovasküler Olaylar Üzerindeki Etkisi (DECLARE) çalışması, mevcut arka plan tedavisine eklendiğinde dapagliflozinin kardiyovasküler ve renal sonuçlar üzerindeplaseboya kıyasla etkisini belirlemek üzere gerçekleştirilmiş olan uluslararası, çok merkezli,randomize, çift kör, plasebo kontrollü bir klinik çalışmaydı. Tüm hastalarda tip 2 diyabet veen az iki ilave kardiyovasküler risk faktörü (erkeklerde yaşın > 55 olması veya kadınlardayaşın > 60 olması ve dislipidemi, hipertansiyon ya da eşzamanlı tütün kullanımıdurumlarından bir veya daha fazlasının mevcut olması) ya da kanıtlanmış kardiyovaskülerhastalık mevcuttu. Randomize edilen 17160 hastanın 6974'ü (%40,6) kanıtlanmış kardiyovasküler hastalığa sahipti, 10186'sında ise (%59,4) kanıtlanmış kardiyovasküler hastalık mevcut değildi.8582 hasta 10 mg dapagliflozine, 8578'i ise plasebo randomize edildi ve medyan 4,2 yılsüresince takip edildi. Çalışma popülasyonunun ortalama yaşı 63,9'du ve %37,4'ü kadındı. Toplamda %22,4'ü < 5 yıldır diyabetliydi ve diyabetin ortalama süresi 11,9 yıldı. Ortalama HbA1c %8,3,ortalama beden kütle indeksi (BKİ) ise 32,1 kg/m2'ydi. Başlangıçta hastaların %10,0'ı kalp yetersizliği öyküsüne sahipti. Ortalama eGFR 85,2 mL/dak/1,73 m2'ydi, hastaların %7,4'ünde eGFR < 60 mL/dak/1,73 m2'ydi, hastaların%30,3'ünde ise mikroalbüminüri veya makroalbüminüri (UACR sırasıyla > 30 ila < 300 mg/gveya > 300 mg/g) mevcuttu. Hastaların çoğu (%98) başlangıçta metformin (%82), insülin (%41) ve sülfonilüreyi (%43) içeren bir ya da daha fazla diyabetik ilaç kullanmıştır. Birincil sonlanım noktaları, kardiyovasküler ölüm, miyokard infarktüsü ya da iskemik inmeden (MACE) oluşan ilk olaya kadar geçen süre ve kalp yetersizliği için hastane yatışı yada kardiyovasküler ölümden oluşan ilk olaya kadar geçen süre olmuştur. İkincil sonlanımnoktaları bir renal bileşik sonlanım noktası ve tüm nedenlere bağlı mortalite olmuştur. Majör advers kardiyovasküler olaylarDapagliflozin 10 mg, plaseboya karşı kardiyovasküler ölüm, miyokard infarktüsü ya da iskemik inme bileşimi için daha kötü olmamıştır (tek-taraflı p < 0,001). Kalp yetersizliği veya kardiyovasküler ölümDapagliflozin 10 mg, kalp yetersizliğine bağlı hastane yatışı ya da kardiyovasküler ölüm bileşiminin önlenmesinde plaseboya karşı üstünlük göstermiştir (Şekil 1). Tedavi etkisindekifarklılın kalp yetersizliği nedeniyle hastaneye yatıştan kaynaklandına ve kardiyovaskülerölüm açısından açık bir farklılık olmadına işaret etmektedir (Şekil 2).
»Dxag$.ozi». plaseb
3 k^^asla sahiıp tedavİıtı ardiyovasküler hastalı bulunan hem de bulunmayan hastalarda ve hem başlangıçta kalp 25/43 yetersizliği bulunan hem de bulunmayan hastalarda gözlenmiştir. Bu yarar yaş, cinsiyet, böbrek fonksiyonu (eGFR) ve bölgenin aralarında olduğu kilit alt gruplarda tutarlılıksergilemiştir. Şekil 1: Kalp yetersizliği nedeniyle ilk hastaneye yatışa veya kardiyovasküler ölüme kadar geçen süre
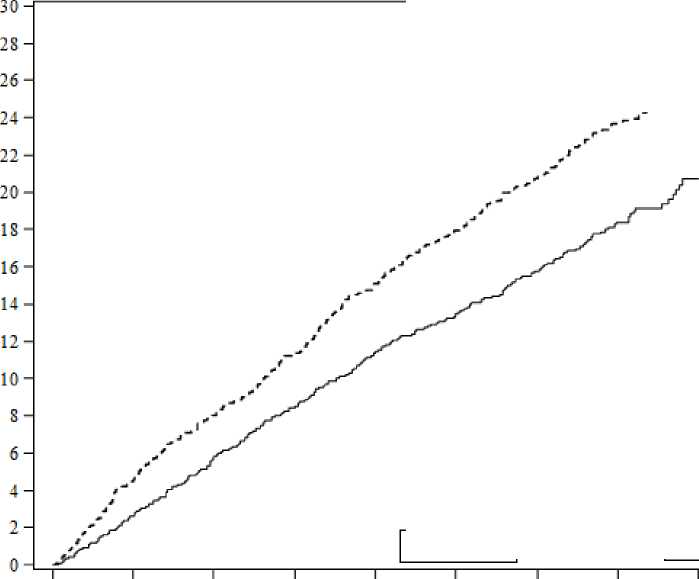
Risk altındaki hastalarDapaglıflozm 8582 Plasebo 8578797078801626157354455362749773678224812781108003832282598415838785178485Risk altındaki hastalar periyodun başlangıcındaki risk altındaki hastaların sayısıdır. HR=Tehlike oranı GA=güven aralı. Birincil ve ikincil sonlanım noktalarının sonuçları Şekil 2'de gösterilmektedir. MACE için dapagliflozinin plasebo karşısındaki üstünlüğü gösterilmemiştir (p=0,172). Bu nedenle renalbileşik son nokta ve tüm nedenlere bağlı mortalite doayıcı test prosedürünün bir parçasıolarak test edilmemiştir.
26/43 Şekil 2: Primer birleşik sonlanım noktaları ile bunların bileşenleri ve sekonder sonlanını noktalan ile bunların bileşenleri üzerindeki tedavi etkileri
Birindi sonLanun noktalanölüm kalp yetmezliği için vatu birleşik sonlanım noktasıÖlüm'{pj^ekjıçt} enfarktüsü iskenuk inme icia vatu birleşik sonlanım noktasıBirleşik sonlanım noktası bileşenleriKalp yetmezliği için yatışenfarktusnUteKMfcinme İkincil sonlanım noktalanbirleşik sonlanım noktasıbileşenleruzun süreli düşüşü Son dönem böbrek hastalıölümbağİLTam nedenlereÇaçi^ıfloza Dsia iyiÇİ£i*Jıç>X>aha İyi0 4 0 6 0.8 1 1.2 16Renal birleşik sonlanım noktası şu şekilde tanımlanmıştır: eGFR'de devam eden doanmış > %40'lık düşüş (eGFR <60 mL/dak/1,73m2'ye) ve/veya son dönem böbrek hastalı (> 90gün diyaliz veya böbrek nakli, devam eden doanmış eGFR < 15 mL/dak/1,73m2) ve/veyarenal ya da kardiyovasküler ölüm. p değerleri primer sonlanım noktaları için iki yanlı p değerleridir, sekonder sonlanım noktaları ve tüm tekli bileşenler içinse nominal p değerleridir. İlk olay meydana gelene kadar geçensüre Cox orantılı tehlikeler modeli kullanılarak analiz edilmiştir. Tekli bileşenler için ilkolayların sayısı her bir bileşen için ilk olayların gerçek sayısıdır ve birleşik sonlanımnoktasındaki olayların sayısına eklenmez. GA=güven aralı. NefropatiDapagliflozin doanmış devam eden eGFR düşüşü, son dönem böbrek hastalı, renal veya kardiyovasküler ölüm birleşik olaylarının insidansını azaltmıştır. Gruplar arasındaki farklılıkrenal bileşenler olan devam eden eGFR düşüşü, son dönem böbrek hastalı ve renal ölümdeortaya çıkan azalmalardan kaynaklanmıştır (Şekil 2). Nefropatiye kadar geçen süre için tehlike oranı (HR) (sürekli eGFR azalması, son evre böbrek hastalı ve renal ölüm) plaseboya karşı dapagliflozin için 0,53 (%95 GA 0,43, 0,66)olmuştur. Ayrıca, plasebo ile karşılaştırıldında dapagliflozin yeni başlangıçlı sürekli albüminüriyi azaltmış (HR 0,79 [%95 GA 0,72, 0,87]) ve makroalbüminüride daha fazla gerilemesağlamıştır (HR 1,82 [%95 GA 1,51, 2,20]). Kalp yetersizliğiDAPA-HF çalışması: Düşük ejeksiyon fraksiyonlu kalp yetersizliği (LVEF < %40)Dapagliflozin ve Kalp Yetersizliğinde Advers Sonuçların Önlenmesi (DAPA-HF) çalışması,Beige Dodüşük %j£ksiyoftfr&STyofeU(sopv^mmis3 ejeksiyon MksıyööUıpLvEFi'^ %40)si?eseyreden 27/43 kalp yetersizliği (New York Kalp Birliği [NYHA] fonksiyonel sınıfı II-IV) görülen hastalar üzerinde arka plan standart tedaviye eklenen dapagliflozinin kardiyovasküler ölüm ve kalpyetersizliğinde kötüleşme insidansı üzerinde plaseboya kıyasla etkisini belirlemek amacıylagerçekleştirilmiş olan uluslararası, çok merkezli, randomize, çift kör, plasebo kontrollü birçalışmaydı. 4744 hastanın 2373'ü 10 mg dapagliflozine, 2371 'i ise plaseboya randomize edildi ve medyan 18 aylık bir süre boyunca takip edildi. Çalışma popülasyonunun medyan yaşı 66'ydı ve%77'si erkekti. Başlangıçta hastaların %67,5'i NYHA sınıf II, %31,6'sı sınıf III, %0,9'u ise sınıf IV şeklinde sınıflandırıldı, medyan LVEF %32'ydi, kalp yetmezliklerinin %56'sının iskemik, %36'sınıniskemik dışı olduğu görüldü, %8'inin ise etiyolojisi belirlenemedi. Her bir tedavi grubundakihastaların %42'si tip 2 diyabet öyküsüne sahipti ve her bir gruptaki hastaların ilave bir %3'ühem kayıt hem de randomizasyon sırasında > %6,5 seviyesinde HbA1c değerine dayanılaraktip 2 diyabete sahip şeklinde sınıflandırıldı. Hastalara standart tedavi uygulanmaktaydı;hastaların %94'ü ACE-I, ARB veya anjiyotensin reseptörü-neprilisin inhibitörü (ARNI, %11),%96'sı beta-bloker, %71'i mineralokortikoid reseptör antagonisti (MRA), %93'ü diüretik iletedavi görmekteydi, %26'sında ise implante edilebilir bir cihaz (defibrilatör fonksiyonu ile)bulunmaktaydı. Kayıt sırasında eGFR değeri > 30 mL/dak/1,73 m2 olan hastalar çalışmaya dahil edildi. Ortalama eGFR değeri 66 mL/dak/1,73 m2'ydi,hastaların %41'inde eGFR < 60mL/dak/1,73 m2, %15'inde ise eGFR < 45 mL/dak/1.73 m2 olarak tespit edildi. Kardiyovasküler ölüm ve kalp yetersizliğinde kötüleşmeDapagliflozin, kardiyovasküler ölüm, kalp yetersizliği nedeniyle hastaneye yatış veya kalp yetersizliği nedeniyle acil servis viziti primer birleşik sonlanım noktasını önlemek konusundaplaseboya kıyasla üstünlük sergilemiştir (HR 0,74 [%95 GA 0,65, 0,85], p < 0,0001). Bu etkierken dönemde gözlenmiştir ve çalışma süresince varlını korumuştur (Şekil 3).
28/43 Şekil 3: Kardiyovasküler ölüm, kalp yetersizliği nedeniyle hastaneye yatış veya kalp yetersizliği nedeniyle acil hastane vizitini içeren primer birleşik sonlanım noktası ilkortaya çıkana kadar geçen süre
<0 00011 S £.aC3 O
Kalp yetersizliği nedeniyle acil hastane viziti, örneğin bir acil serviste gerçekleştirilen ve kalp yetersizliğinde kötüleşme (yalnızca oral diüretiklerde bir artış şeklinde değil) nedeniyle tedavigerektiren, acil, planlı olmayan bir doktor değerlendirmesi şeklinde tanımlanmıştır. Risk altındaki hastalar periyodun başlangıcında risk altında olan hastaların sayısıdır. Primer birleşik sonlanım noktasının üç bileşeni de tedavi etkisine ayrı ayrı katkıda bulunmuştur (Şekil 4). Birkaç acil kalp yetersizliği viziti olmuştur.
29/43 Şekil 4: Primer birleşik sonlanım noktası, onun bileşenleri ve tüm nedenlerden kaynaklanan mortaliteye ilişkin tedavi etkileriölüm, kalp yetmediği ıı&ieiiiyLr hastaneye yatış veya acilkalp yetmezliği ziyareti olayhrmmbirleşim:Olay gözlenen gönüllüler TehlikeOTITJ]P-değeri(olay oranı)Plajaho (H = 23T]> 386 (11.6) 502 (15.6)0.74(0.65,0.85)<0.0001Kalp yetmezliği nedeniyle hastaneyeyatışAcilkalpyetmezliğe ziyaretiTüm. nedenlere bağlı ıpçrjşljiş.I-1--1-1 0.5 0.81 1.252231(6.9) 318 (9.8)0.70 (0.59, 0.83)<0.000110 (0.3) 23 (0.7)0.43 (0.20,0.90)0.0213227 (6.5) 273 (7.9)0.82 (0.69, 0.98)0.0294276 (7.9) 329 (9.5)0.83 (0.71,0.97)0.0217Dimiyi Kalp yetersizliği nedeniyle acil hastane viziti, örneğin bir acil serviste gerçekleştirilen ve kalp yetersizliğinde kötüleşme (yalnızca oral diüretiklerde bir artış şeklinde değil) nedeniyle tedavigerektiren, acil, planlı olmayan bir doktor değerlendirmesi şeklinde tanımlanmıştır. İlk olayların sayısı, her bir bileşene ilişkin ilk olayların gerçek sayısıdır ve toplamı birleşik sonlanım noktasındaki olay sayısına eşit değildir. Olay oranları, 100 hasta yılı takip başına olay gözlenen gönüllülerin sayısı şeklinde sunulmaktadır. Tek tek bileşenlere ve tüm nedenlerden kaynaklanan mortaliteye ilişkin p değerleri nominaldir. Dapagliflozin, aynı zamanda kalp yetersizliği nedeniyle hastaneye yatış (ilk ve rekürren) ve kardiyovasküler ölüm olaylarının toplam sayısını düşürmüştür; dapagliflozin grubunda 567olay, plasebo grubunda ise 742 olay ortaya çıkmıştır (Olay Oranı 0,75 [%95 GA 0,65, 0,88], p< 0,0002). Dapagliflozinin ortaya çıkardı tedavi yararı, tip 2 diyabeti olan ve olmayan kalp yetersizliği hastalarında gözlenmiştir. Dapagliflozin, kardiyovasküler ölüm insidansı ve kalpyetersizliğinde kötüleşme primer birleşik sonlanım noktasını diyabet hastalarında 0,75'lik(%95 GA 0,63, 0,90), diyabeti olmayan hastalarda ise 0,73'lük (%95 GA 0,60, 0,88) bir HRdeğeri ile düşürmüştür.
30/43 Dapagliflozinin primer sonlanım noktası üzerinde plaseboya kıyasla sergilediği tedavi faydası, eşzamanlı kalp yetersizliği tedavisi, böbrek fonksiyonu (eGFR), yaş, cinsiyet vebölgenin de aralarında olduğu diğer kilit alt gruplarda da tutarlılık göstermiştir. Hasta tarafından bildirilen sonuç - kalp yetersizliği semptomlarıDapagliflozinin kalp yetersizliği semptomları üzerinde ortaya çıkardı tedavi etkisi, bitkinlik, periferik ödem, dispne ve ortopneyi içeren kalp yetersizliği semptomlarının sıklını veşiddetini ölçen Kansas City Kardiyomiyopati Anketi Toplam Semptom Skoru (KCCQ-TSS)ile değerlendirilmiştir. Skor 0 ile 100 arasında değişmektedir ve daha yüksek skorlar sağlıkdurumunun daha iyi olduğunu göstermektedir. Dapagliflozinle uygulanan tedavi, KCCQ-TSS'de başlangıçtan 8. aya kadar meydana gelen değişiklikle ölçüldüğü üzere, kalp yetersizliği semptomları üzerinde plaseboya kıyaslaistatistiksel ve klinik açıdan anlama sahip olan bir yarar ortaya çıkarmıştır (Kazanç Oranı 1,18[%95 GA 1,11, 1,26]; p < 0,0001). Hem semptom sıklı hem de semptom yükü sonuçlarakatkıda bulunmuştur. Hem kalp yetersizliği semptomlarında iyileşme sağlanması hem de kalpyetersizliği semptomlarındaki kötüleşmenin önlenmesi konusunda yarar gözlenmiştir. Yanıt veren analizlerinde KCCQ-TSS'de başlangıçtan 8. aya 5 puan veya daha fazla artış şeklinde tanımlanan klinik açıdan anlamlı bir iyileşme gözlenen hastaların oranınındapagliflozin tedavisi grubunda plaseboya kıyasla daha yüksek olduğu görülmüştür. 5 puanveya daha fazla düşüş şeklinde tanımlanan klinik açıdan anlamlı kötüleşme gözlenenhastaların oranının dapagliflozin tedavisi grubunda plaseboya kıyasla daha düşük olduğugörülmüştür. Dapagliflozin ile elde edilen yararlar, klinik açıdan anlamlı daha büyükdeğişiklik için daha konservatif kesmeler uygulandında da varlını korumuştur (Tablo 10).
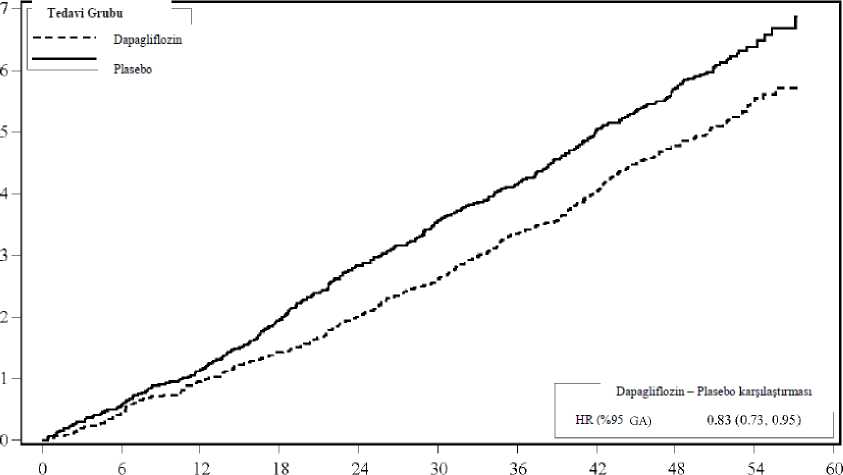
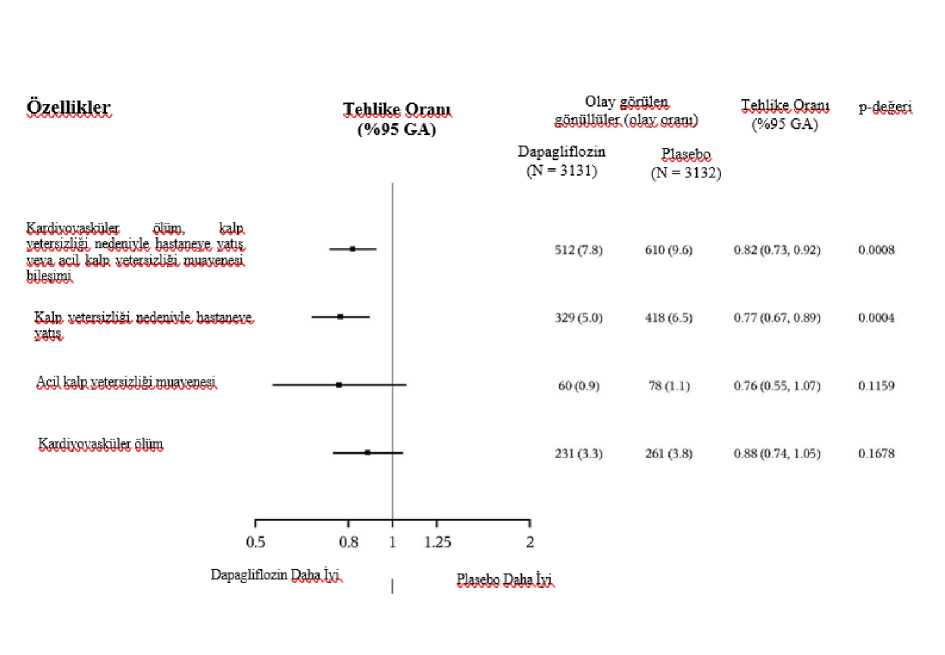
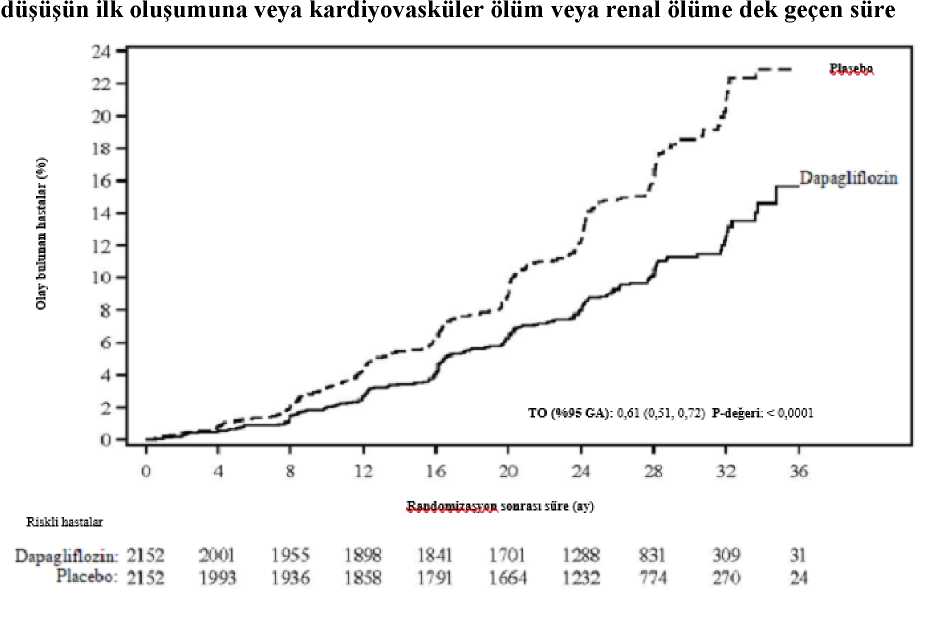
31/43 a KCCQ-TSS gözlemi bulunan veya 8 aydan önce ölen hastaların sayısı. b Başlangıca kıyasla en az 5, 10 veya 15 puan iyileşme gözlenen hastaların sayısı.Belirtilen zaman noktasından önce ölen hastalar iyileşme kaydetmemiş sayılmıştır.c İyileşme açısından > 1'lik bir olasılık oranı 10 mg dapagliflozin lehinedir.d Başlangıca kıyasla en az 5 veya 10 puan kötüleşme gözlenen hastaların sayısı. Belirtilenzaman noktasından önce ölen hastalar kötüleşmiş sayılmıştır.e Kötüleşme açısından < 1'lik bir olasılık oranı 10 mg dapagliflozin lehinedir.f p değerleri nominaldir. NefropatiRenal birleşik sonlanım noktası olaylarının (doanmış uzun süreli > %50 eGFR düşüşü, SDBY veya renal ölüm) sayısının az olduğu gözlenmiştir; insidansın dapagliflozin grubunda%1,2, plasebo grubunda ise %1,6 olduğu görülmüştür. DELİVER çalışması: Sol ventrikül ejeksiyon fraksiyonu >%40 olan kalp yetersizliğitersizliğiHastalarının YAŞAMLARINIİYİLEŞTİRMEK İÇİN Dapagliflozinin Değerlendirmesi (DELİVER) çalışması plasebo ilekarşılaştırıldında kardiyovasküler ölüm ve kalp yetersizliğinde kötüleşme olayları üzerindedapagliflozinin etkisini belirlemek için, LVEF > %40 olan kalp yetersizliği (NYHA sınıf II-IV) ve yapısal kalp hastalı kanıtı olan > 40 yaşındaki hastalarda yapılan uluslararası, çokmerkezli, randomize, çift kör, plasebo kontrollü bir çalışmasıdır.6263 hastanın 3131'i 10 mg dapagliflozine ve 3132'si plaseboya randomize edilmiş ve medyan 28 ay boyunca takip edilmiştir. Çalışma 654 (%10) subakut kalp yetersizliği hastasınıiçermektedir (kalp yetersizliği nedeniyle hastaneye yatış sırasında veya taburcu olduktansonraki 30 gün içinde randomize edilen hasta olarak tanımlanmıştır). Çalışmapopülasyonunun ortalama yaşı 72'dir ve %56'sı erkektir. Başlangıçta, hastaların %75'i NYHA sınıf II, %24'ü sınıf III ve %0,3'ü sınıf IV olarak sınıflandırılmıştır. Medyan LVEF %54 olup hastaların %34'ünde LVEF < %49, %36'sındaLVEF %50-59 ve %30'unda LVEF > %60 dır. Her tedavi grubunda hastaların %45'inde tip 2diyabet öyküsü vardır. Başlangıç tedavisi ACEi/ARB/ARNI (%77), beta blokerler (%83),diüretikler (%98) ve MRA'yı (%43) içermektedir. Çalışmaya kayıt sırasında eGFR > 25 mL/dak/1,73 m2 olan hastalar çalışmaya dahil edilmiştir. Ortalama eGFR 61 mL/dak/1,73 m2 olup hastaların %49'unda eGFR <60mL/dak/1,73 m2, %23'ünde eGFR < 45 ml/dak/1,73 m2 ve %3'ünde eGFR < 30 ml/dak/1,73 m2 dir Kardiyovasküler ölüm ve kalp yetersizliğinin kötüleşmesiDapagliflozin, birincil birleşik sonlanım noktası olan kardiyovasküler ölüm, kalp yetersizliği nedeniyle hastaneye yatış veya acil kalp yetersizliği viziti insidansını azaltmada plasebodanüstündür (HR 0,82 [%95 GA 0,73, 0,92]; p=0,0008). Dapagliflozin ve plasebo olay eğrilerierken ayrılmış ve ayrılma çalışma boyunca korunmuştur (Şekil 5).
32/43 Şekil 5: Birleşik sonlanım noktası kardiyovasküler ölüm, kalp yetersizliği nedeniyle hastaneye yatış ve acil kalp yetersizliği vizitinin ilk oluşmasına kadar geçen süre?apaglınozmDapaglıflozın karşısında PlaseboHR (%95 GA): 0,82 (0,73- 0,92) r-değerı: 0,0008Randomızasyon itibaren geçen sure (ay)Riskli hastalar[oztn:118111401603L55419821923214724ü I2710280728852799294928%30403007271(126062318Acil kalp yetersizliği viziti bir doktor tarafından (örn. Acil Serviste) acil, planlanmamış bir değerlendirme ve kötüleşen kalp yetersizliği için tedavi gereksinimi (sadece oral diüretiklerdebir artış dışında) olarak tanımlanmıştır. Riskli hasta sayısı, dönemin başlangıcındaki risk altındaki hasta sayısıdır. Birincil bileşik sonlanım noktasının üç bileşeni de tedavi etkisine ayrı ayrı katkıda bulunmuştur (Şekil 6).
33/43
Acil kalp yetersizliği viziti, bir doktor tarafından (örn. Acil Serviste) acil, planlanmamış bir değerlendirme ve kötüleşen kalp yetersizliği için tedavi gereksinimi (sadece oral diüretiklerdebir artış dışında) olarak tanımlandı. Tek bileşenlerin ilk olaylarının sayısı, her bir bileşen için ilk olayların gerçek sayısıdır ve birleşik sonlanım noktasındaki olayların sayısına katkıda bulunmaz. Olay oranları, 100 hasta yılı takip başına olay olan hasta sayısı olarak sunulmuştur. Her bir bileşen için p-değerleri nominaldir. Burada birincil sonlanım noktasının bir bileşeni olarak sunulan kardiyovasküler ölüm, ikincil bir sonlanım noktası olarak resmi Tip 1 hatakontrolü altında da test edilmiştir. Dapagliflozin, kalp yetersizliği olaylarının toplam sayısını (kalp yetersizliği nedeniyle ilk ve tekrarlayan hastaneye yatış veya acil kalp yetersizliği viziti) ve kardiyovasküler ölümüazaltmada plasebodan üstündür; plasebo grubunda 1057 olaya karşılık dapagliflozin grubunda815 olay vardır (Oran Oranı 0,77 [%95 GA 0,67- 0,89]; p=0,0003). Dapagliflozinin birincil sonlanma noktasında plaseboya göre tedavi yararı, LVEF < %49, %50-59 ve > %60 olan hasta alt gruplarında gözlenmiştir. Etkiler, örn. yaş, cinsiyet, NYHAsınıfı, NT-proBNP seviyesi, subakut durum ve tip 2 diyabet durumu olarak kategorize edilendiğer kilit alt gruplar arasında tutarlı olmuştur. Hasta tarafından bildirilen sonuç - kalp yetersizliği belirtileriDapagliflozin ile tedavi, KCCQ-TSS'de 8. ayda başlangıca göre değişiklikle ölçüldüğü üzere, kalp yetersizliği semptomlarında plaseboya göre istatistiksel olarak anlamlı bir fayda ilesonuçlanmıştır (Kazanma Oranı 1,11 [%95 GA 1,03- 1,21]; p=0,0086). Hem semptom sıklıhem de semptom yükü sonuçlara katkıda bulunmuştur.
34/43 Yanıt veren analizlerinde, 5 puan veya daha fazla olarak tanımlanan klinik olarak anlamlı bozulma, plaseboya kıyasla dapagliflozin tedavi grubu için daha düşüktür. Dapagliflozin ilegözlemlenen fayda, daha sıkı bir sınır değer uygulandında da devam etmiştir. 8 aydabaşlangıca göre KCCQ-TSS'de klinik olarak anlamlı bir iyileşme gösteren hastaların oranıtedavi grupları arasında farklılık göstermemştir (Tablo 10).
a KCCQ-TSS'si gözlemlenen veya 8 aydan önce ölen hastaların sayısı. Sayı, COVID-19'un DSÖ tarafından pandemi olarak ilan edildiği 11 Mart 2020'den önce planlanan veyagerçekleştirilen 8 aylık bir değerlendirmesi (5. vizit) olan hastaları içerir. 11 Mart 2020'denönce planlanmış ancak değerlendirme yapılmamış hastaların verileri de dahil edilmiştir.b Belirli bir zaman noktasından önce ölen veya başlangıç seviyesinden verilen eşiğe eşitveya bu eşiği aşan bir bozulma gözlemlenen hastaların sayısı. Başlangıçta KCCQ-TSS'simuhtemelen bir bozulma yaşamak için çok düşük olan hastalar, eğer 8 aydaki puanlarıbaşlangıçtan daha yüksek değilse, kötüleşmiş olarak tanımlandı.c Bozulma için, <1'lik bir olasılık oranı 10 mg dapagliflozin lehinedird Başlangıca göre en az 13 veya 17 puanlık bir iyileşme gözlemlenen hastaların sayısı.Verilen zaman noktasından önce ölen hastalar iyileşmemiş olarak sayılır. Başlangıçtamuhtemelen bir iyileşme yaşamak için çok yüksek KCCQ-TSS'ye sahip olan hastalar, eğer8 aydaki puanları başlangıçtan düşük değilse, iyileşmiş olarak tanımlandıe İyileşme için, >1 'lik bir olasılık oranı 10 mg dapagliflozin lehinedir DAPA-HF ve DELİVER çalışmalarında kalp yetersizliğiDAPA-HF ve DELİVER birleştirilmiş analizinde, dapagliflozinin kardiyovasküler ölüm, kalp yetersizliği nedeniyle hastaneye yatış veya acil kalp yetersizliği viziti birleşik sonlanımnoktası üzerindeki tedavi etkisi ejeksiyon fraksiyonundan bamsız olarak tutarlılıkgöstermiştir (Şekil 7).
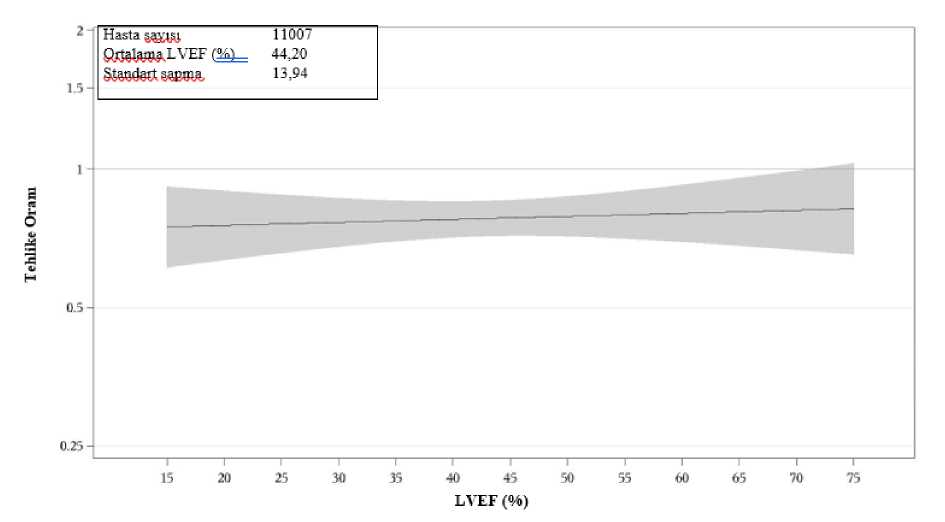
35/43 Şekil7:LVEF Başlangıç LVEF'sine göre birincil birleşik sonlanım noktası için tedavi etkisi
DAPA-HF ve DELİVER çalışmalarının önceden belirtilmiş hasta düzeyinde havuzlanmış analizinde, dapagliflozin plasebo ile karşılaştırıldında kardiyovasküler ölüm riskiniazaltmıştır (HR 0,85 [%95 GA 0,75 - 0,96], p=0,0115) (Şekil 8). Her iki çalışma da etkiyekatkıda bulunmuştur.
36/43 Şekil 8: Kardiyovasküler ölümün oluşmasına kadar geçen süre (DAPA-HF ve DELİVER çalışmalarının birleştirilmiş analizi)
: >.fı PlaseboDapaalıflozmLO.O-7.5-Dapagliflozin karşısında PlaseboHR(%95GA): 0,85 (0,75-0,96) P-değeri: 0,011515 182124Riskli hastalar:Randomizasvondan itibaren süre (ay)Dapagliflozin:1312130617811767240323013010207838263780508750484 -; 450852M5238533053335430542035045503
Pli s ebe
Her çalışmadan KV ölüm tanımları kullanılmıştır. DAPA-HF'de KV ölüm, nedeni belirsiz ölümleri içermiştir. DELIVER çalışmasında KV ölüm, nedeni belirsiz ölümleri içermemiştir.Riskli hasta sayısı, dönemin başlangıcında risk altındaki hasta sayısıdır. Kronik böbrek hastalıKronik Böbrek Hastalı Bulunan Hastalarda Renal Sonuçlar ve Kardiyovasküler Mortaliteye Dapagliflozinin Etkilerinin İncelenmesi (DAPA-CKD) çalışması kronik böbrek hastalı ilebirlikte >25 ile <75 mL/dak/1,73 m 22düzeyinin altına uzun süreli düşüş, kronik diyaliztedavisi veya böbrek nakli), kardiyovasküler ölüm ve renal ölüm üzerine etkisini belirlemeküzere yapılan uluslararası, çok-merkezli, randomize, çift-kör, plasebo-kontrollü çalışmadır.4304 hastadan 2152'si 10 mg dapagliflozin, 2152'si plaseboya randomize edilmiş ve medyan 28,5 ay boyunca takip edilmiştir. Çalışma süresince eGFR seviyesi 25 mL/dak/1,73 m 2düzeyinin altına düştüğünde de tedaviye devam edilmiş ve diyalize gereksinim duyulandurumlarda dahi tedavi devam ettirilebilmiştir.Çalışma popülasyonun ortalama yaşı 61,8 olup, %66,9'u erkekti. Başlangıçta ortalama eGFR 43,1 mL/dak/1,73 m 222idi; hastaların %67,5'inde tip 2diyabet vardı. Hastalar standart tedavi alıyordu; %97,0'ı anjiyotenssin dönüştürücü enzim(ACE) inhibitörü veya anjiyotensin reseptör blokörü (ARB) ile tedavi ediliyordu.Çalışma, Bamsız Veri İzleme Komitesinin tavsiyesi üzerine planlanan analizden önce etkililik için erken durdurulmuştur. Dapagliflozin eGFR'de uzun süreli >%50 düşüşten oluşanbirincil bileşik sonlanım noktasını, son dönem böbrek hastalına ilerleme ve renal ölümüönlemede plasebodan üstündür. Birincil bileşik sonlanım noktasının ilk ortaya çıkışına kadar
37/43 geçen süre için Kaplan-Meier grafiğine göre, tedavi etkisi 4 aydan itibaren belirgindir ve çalışmanın sonuna kadar sürdürülmüştür (Şekil 9).
Primer birleşik sonlanım noktasının 4 bileşeninin tümü tedavi etkisine katkıda bulunmuştur. Dapagliflozin ayrıca eGFR, son dönem böbrek hastalı veya böbrek ölümünde uzun süreli>%50 düşüş olan birleşik sonlanım noktasının görülme sıklını ve kardiyovasküler ölüm vekalp yetersizliği nedeniyle hastaneye yatış birleşik sonlanım noktasının görülme sıklını daazaltmıştır. Dapagliflozin ile tedavi, tüm nedenlere bağlı mortalitede önemli bir azalma ilekronik böbrek hastalı hastalarında genel sağkalımı iyileştirmiştir. (Şekil 10).
38/43 Şekil 10: Primer ve sekonder birleşik sonlanım noktaları, onun bileşenleri ve tüm nedenlere bağlı mortalite için tedavi etkileri
Tek bileşen için ilk olay sayısı her bir bileşenin ilk olaylarının gerçek sayısıdır ve birleşik sonlanım noktasındaki olay sayısının toplamından oluşmaz. Beige DopiaMoMıs^ar^k vsri^teHMtek-ebys39/43 Tehlike oranı hesaplamaları toplamda 15'ten az olay bulunan alt gruplar için sunulmamıştır; her iki kol birleştirilmiştir. Dapagliflozinin tedavi faydası tip 2 diyabet bulunan ve diyabet bulunmayan kronik böbrek hastalı hastalarında benzerdir. Dapagliflozin eGFR'de %50 veya daha fazla uzun sürelidüşüş, son dönem böbrek hastalı, kardiyovasküler ölüm veya renal ölüm birincil birleşiksonlanım noktasını tip 2 diyabet bulunan hastalarda 0,64 TO (%95 GA: 0,52-0,79) ve diyabetbulunmayan hastalarda 0,50 TO (%95 GA: 0,35-0,72) ile düşürmüştür. Birincil sonlanım noktasında dapagliflozinin plasebodan daha yüksek olan tedavi faydası da eGFR, yaş, cinsiyet ve bölge dahil diğer önemli alt gruplarda tutarlıdır. 5.2. Farmakokinetik özelliklerGenel ÖzelliklerEmilim:Dapagliflozin, oral uygulama sonrasında hızla ve iyi absorbe edilmektedir. Maksimum dapagliflozin plazma konsantrasyonlarına (Cmaks) genellikle aç karnına uygulamadan sonrakiiki saat içerisinde ulaşılmaktadır. Günde bir kez 10 mg dapagliflozin dozlarından sonrageometrik ortalama kararlı durum dapagliflozin Cmaks ve EAAX değerleri sırasıyla 158 ng/mLve 628 ng s/mL olmuştur. 10 mg dozunun uygulanmasından sonra dapagliflozinin mutlak oralbiyoyararlanımı %78 olmaktadır. Yüksek oranda yağ içeren bir öğünle birlikte verildiğindedapagliflozinin Cmaks değeri %50'ye kadar azalmış ve Tmaks değeri yaklaşık 1 saat uzamış;ancak açlık durumu ile karşılaştırıldında EAA değeri değişmemiştir. Bu değişiklikler klinikolarak anlamlı kabul edilmemektedir. Bu nedenle FORZİGA aç veya tok karnına alınabilir. Dalım:Dapagliflozin yaklaşık %91 oranında proteine bağlanmaktadır. Proteine bağlanma oranı farklı hastalık durumlarından etkilenmemektedir (örn. böbrek veya karaciğer yetmezliği).Dapagliflozinin ortalama kararlı durum dalım hacmi 118 L'dir. Biyotransformasyon:Dapagliflozin büyük ölçüde metabolize olarak, başlıca inaktif bir metabolit olan dapagliflozin 3-O-glukuronide metabolize olmaktadır. Dapagliflozin 3-O-glukuronid veyadiğer metabolitler glukoz düşürücü etkilere katkıda bulunmamaktadır.Dapagliflozin 3-O-glukuronid oluşumuna karaciğer ve böbrekte bulunan bir enzim olanUGT1A9 aracılık eder ve CYP'nin aracılık ettiği metabolizma insanda minör bir klerensyoladır. Eliminasyon:Dapagliflozinin ortalama plazma terminal yarı ömrü (t 1/214C]-dapagliflozin dozunun uygulanmasındansonra %96'sı geri kazanılmış olup, bunun %75'i idrarda ve %21'i feçestedir. Feçeste dozunyaklaşık %15'i ana ilaç olarak atılmıştır.Belge Do 40/43 Doğrusal/doğrusal olmayan durum:Dapagliflozin maruziyeti, 0,1 mg ila 500 mg aralında dapagliflozin dozundaki artış ile orantılı olarak artmıştır ve 24 haftaya kadarki tekrarlı günlük doz uygulamaları ilefarmakokinetiğinde zaman içinde değişiklik olmamıştır. Hastalardaki karakteristik özelliklerBöbrek yetmezliği:Kararlı durumda (7 gün süreyle günde bir kez 20 mg dapagliflozin), tip 2 diabetes mellitusu ve hafif, orta veya ar derecede böbrek yetmezliği olan bireylerde (ioheksol plazma klerensiile belirlenmiştir) ortalama sistemik dapagliflozin maruziyeti, böbrek fonksiyonu normal olantip 2 diabetes mellitusu olan bireylere göre sırasıyla %32, %60 ve %87 daha yüksek olmuştur.Kararlı durumda 24 saatlik üriner glukoz atılımı, böbrek fonksiyonu ile yüksek derecedeilişkili olup tip 22diyabeti bulunan ve bulunmayankronik böbrek hastaları arasında anlamlı fark yoktur.Karaciğer yetmezliği:Hafif veya orta derecede karaciğer yetmezliği olan hastalarda (Child-Pugh sınıf A ve B), ortalama dapagliflozin Cmaks ve EAA değerleri, sağlıklı, benzer özelliklere sahip kontrolbireylere kıyasla sırasıyla %12'ye ve %36'ya kadar daha yüksek olmuştur. Bu farklılıklarınklinik olarak anlamlı olmadı kabul edilmiştir. Ar derecede karaciğer yetmezliği olanbireylerde (Child-Pugh sınıf C) dapagliflozinin ortalama Cmaks ve EAA değerleri, benzerözelliklere sahip sağlıklı kontrollerden sırasıyla %40 ve %67 daha yüksek bulunmuştur. Geriyatrik hastalarda (> 65 yaş):70 yaşına kadarki bireylerde tek başına yaşa bağlı maruziyette klinik olarak anlamlı bir artış olmamaktadır. Bununla birlikte, böbrek fonksiyonunda yaşa bağlı düşüş nedeniyle artmışmaruziyet beklenebilir. 70 yaşın üzerindeki hastalarda maruziyet ile ilgili sonuçlaravarabilmek için yeterli veri bulunmamaktadır. Pediyatrik popülasyonPediyatrik popülasyonda farmakokinetik henüz çalışılmamıştır. CinsiyetKadınlarda ortalama dapagliflozin EAAss değerinin erkeklere oranla %22 daha yüksek olduğu tahmin edilmektedir. IrkBeyaz, Siyah veya Asyalı ırklar arasında sistemik maruziyet açısından klinik olarak anlamlı herhangi bir farklılık bulunmamaktadır. Vücut arlıBelge Do
farklılık
Dapagliflozin maruziyetinin, artan arlıkla düştüğü bulunmuştur. Bu nedenle düşük vücut arlına sahip hastalarda maruziyet biraz daha yüksek olabilir ve yüksek vücut arlınasahip hastalarda ise maruziyet biraz daha düşük olabilir. Bununla birlikte maruziyettekiar klinik açıdan önemli kabul edilmemektedir. 41/43 5.3. Klinik öncesi güvenlilik verileriKlinik dışı veriler; güvenlilik farmakolojisi, tekrarlı doz toksisitesi, genotoksisite, karsinojenik potansiyel ve fertiliteyi kapsayan standart çalışmalar dotusunda insanlar içinözel bir tehlike ortaya koymamıştır. Dapagliflozin farelerde veya sıçanlarda, iki yıllıkkarsinojenisite çalışmalarında değerlendirilen dozların herhangi birinde tümör oluşumunaneden olmamıştır. Üreme toksisitesi ve gelişimsel toksisiteYeni sütten kesilen jüvenil sıçanlara doğrudan dapagliflozin uygulaması ve gebelik (insanda böbrek matürasyonu açısından gebeliğin ikinci ve üçüncü trimesterlerine karşılık gelendönemler) ile emzirme dönemi sırasındaki dolaylı maruziyet, ayrı ayrı, yavrularda böbrekpelvis ve tübüler dilatasyon insidans ve/veya şiddetinde artış ile ilişkilidir. Jüvenil toksisite çalışmasında, dapagliflozin genç sıçanlara 21. postnatal günden itibaren postnatal 90. güne kadar doğrudan uygulandında tüm doz düzeylerinde renal pelvis vetübüler dilatasyonlar bildirilmiştir; yavrularda, test edilen en düşük dozda maruziyet,maksimum önerilen insan dozunun > 15 katı olmuştur. Bu bulgular, tüm dozlarda gözlenendozla ilişkili böbrek arlı artışı ve makroskobik böbrek büyümesi ile ilişkilendirilmiştir.Jüvenil hayvanlarda gözlenen renal pelvik ve tübüler dilatasyonlar yaklaşık 1 aylık iyileşmedöneminde tamamen geri dönüşümlü olmamıştır. Başka bir prenatal ve postnatal gelişim çalışmasında anne sıçanlara gebeliğin 6. gününden postnatal 21. güne kadar doz uygulanmıştır ve yavrular intra uterinve emzirme yoluyla ilacadolaylı olarak maruz bırakılmıştır (sütte ve yavrularda dapagliflozin maruziyetinideğerlendirme amaçlı bir ek çalışma gerçekleştirilmiştir). İlaç uygulanan dişi hayvanlarınerişkin yavrularında renal pelvis dilatasyon insidansında veya şiddetinde artış görülmüş;ancak bu etkiler sadece test edilen en yüksek dozda meydana gelmiştir (karşılık gelenmaternal ve yavru dapagliflozin maruziyetleri maksimum önerilen insan dozunda insandeğerinin sırasıyla 1415 ve 137 kat üstü olmuştur). Bunlar dışındaki gelişimsel toksisiteetkileri yavruların vücut arlıklarında dozla ilgili düşüşleri ile sınırlı olmuş ve sadece> 15 mg/kg/gün dozlarında görülmüştür (maksimum önerilen insan dozunda insandeğerlerinin > 29 katı olan yavru maruziyetleri ile ilişkili). Maternal toksisite sadece testedilen en yüksek dozda görülmüş ve vücut arlında ve dozla birlikte yem tüketimindegeçici azalmalar ile sınırlı kalmıştır. Gelişimsel toksisite açısından advers etkinin görülmediğidüzey (NOAEL), yani test edilen en düşük doz, maksimum önerilen insan dozunda insandeğerinin yaklaşık 19 katı olan maternal sistemik maruziyet ile ilişkilidir.Sıçanlar ve tavşanlardaki ek embriyo-fetal gelişim çalışmalarında dapagliflozin, her türde başlıca organogenez dönemlerine denk gelen aralıklarda uygulanmıştır. Tavşanlarda testedilen dozların herhangi birinde maternal ya da gelişimsel toksisite gözlenmemiştir; testedilen en yüksek doz, maksimum önerilen insan dozunun yaklaşık 1191 katı sistemikmaruziyet ile ilişkilidir. Dapagliflozin, sıçanlarda, maksimum önerilen insan dozunun 1441katına kadarki maruziyetlerde embriyoletal ya da teratoj enik etki göstermemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiMikrokristalin selüloz (E460i) Laktoz (sığ loama Kodu""«ktronik imza ile imzalanmıştır.7ySHY3 Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebysır sütünden el Belge Doama KctftuRZW56aklÜSHY3S3t;Krospovidon (E1202) 42/43 Silikon dioksit (E551) Magnezyum stearat (E470b) Polivinil alkol (E1203) Titanyum dioksit (E171) Polietilen glikol 3350 (E1521) Talk (E553b) Sarı demir oksit (E172) 6.2. GeçimsizliklerBilinen herhangi bir geçimsizliği bulunmamaktadır. 6.3. Raf ömrü36 ay 6.4. Saklamaya yönelik özel tedbirler30°C altındaki oda sıcaklında saklayınız. 6.5. Ambalajın niteliği ve içeriğiPerfore olmayan takvimli Alu/Alu blisterler içinde 28 film kaplı tablet içeren ambalajlarda ve perfore Alu/Alu blisterler içinde 90 film kaplı tablet içeren ambalajlarda. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİAstraZeneca İlaç San. ve Tic. Ltd. Şti. Büyükdere Cad. Yapı Kredi Plaza, B Blok, Kat:3-4 Levent/İstanbul 8. RUHSAT NUMARASI2015/34 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 29.01.2015 Ruhsat yenileme tarihi: 02.03.2020 10. KÜB'ÜN YENİLENME TARİHİ
43/43 a LOCF: İleri aktarılan son gözlem b Başlangıçta ve başlangıçtan sonra en az bir etkililik ölçümü olan randomize ve tedavi edilmiş bireyler c Başlangıçtaki değere göre düzeltilen ek küçük kareler ortalaması d Glipizid + metformin ile eşit etkililik p değeri < 0,0001 x GA: Güven Aralı Metformin, glimepirid, metformin ve bir sülfonilüre, sitagliptin (metforminle veya metforminsiz) ya da insüline ilave tedavi olarak dapagliflozin, plasebo alan bireyler ilekarşılaştırıldında 24 haftada HbAlc'de istatistiksel olarak anlamlı düşüşler sağlamıştır(p < 0,0001; Tablo 4, 5 ve 6). 24. haftada HbA1c'de gözlenen Belge Doverifere^insüm^ıısaıhYps sdav&Rtadavhtkörabinasyonue^ljşmalaM^d^^lime.piriıdıaveı-tin&üljn) 17/43 |
İlaç BilgileriForziga 10 Mg Film Kaplı TabletEtken Maddesi: Dapagliflozin Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.