Glivon 400 Mg Film Kaplı Tablet Kısa Ürün BilgisiKISA URUN BILGISI¡Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonlarıTÜFAM'a bildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasılraporlanır?1. BEŞERI TIBBİ ÜRÜNÜN ADIGLİVON 400 mg film kaplı tablet 2. KALITATIF VE KANTİTATIF BILEŞIMEtkin madde:Bir film kaplı tablet, 400 mg imatinibe eşdeğer 477,874 mg imatinib mesilat içerir. Yardımcı maddeler:Pharmaburst 500*.............. 10,246 mg *Sorbitol ve maltitol içermektedir. Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTIK FORMFilm kaplı tablet Kahverengimsi turuncu renkli oval, bombeli, tek tarafı çentikli film kaplı tabletlerdir. Çentiğin amacı tabletleri iki eşit parçaya bölebilmektir. 4. KLINIK ÖZELLIKLER4.1. Terapötik endikasyonlarGLİVON'un endikasyonları: Yeni tanı konmuş Philadelphia kromozomu pozitif kronik faz kronik miyeloidlösemi (KML) hastalarında, Akselere faz Philadelphia kromozomu pozitif kronik miyeloid lösemi (KML)hastalarında, Blastik faz Philadelphia kromozomu pozitif kronik miyeloid lösemi (KML)hastalarında, Diğer tedavilere dirençli Philadelphia kromozomu pozitif kronik miyeloid lösemi(KML) hastalarında, İlk tanısı Philadelphia kromozomu pozitif kronik miyeloid lösemi (KML) olanancak tedavi ile Philadelphia kromozomu negatif hale gelenkronik/akselere/blastik faz kronik miyeloid lösemi hastalarında, Kronik miyeloid lösemili (KML) olan 3 yaş ve üzerindeki çocuklarda birincibasamak tedavide, Erişkin hastalarda rezeke edilemeyen ve/veya metastatik malign C-KIT reseptörütaşıyan gastrointestinal stromal tümör (GIST) hastalarında, Opere edilmiş, C-KIT reseptörü pozitif bulunan erişkin GIST (gastrointestinalstromal tümör) hastalarında AFIP* kriterlerine göre yüksek risk** taşıyanlarda adjuvan tedavidelüç^i^ktronik imza ile imzalanmıştır. Belge Dokemoterapi şemaları ile kombine olarak remisyon indüksiyonu amacıyla, Relaps-refrakter Philadelphia kromozomu pozitif akut lenfoblastik lösemi(Ph+ALL) hastalarında klinik yararı gösterilmiş çoklu ajanlı kemoterapi şemalarıile kombine olarak remisyon indüksiyonu amacıyla, FIP1L1-PDGFRA füzyon geni laboratuvar incelemeleriyle gösterilenhipereozinofilik sendrom ve sistemik mastositoz hastalarında kullanılabilir. (* Armed Forces Institute of Pathology (AFIP) kriterleri bölüm 5.1'de verilmiştir.**AFIP kriterlerine göre yüksek riskli grupların tanımı;1- Mide yerleşimli alanlarda tümör büyüklüğü 6 cm'nin üzerinde olan ve mitotik indeksi 5'in üzerinde bulunanlar2- Mide dışındaki yerleşimlerde 10 cm ve üzerinde tümör büyüklüğü olan ya da mitotik indeksi 5'in üzerindebulunanlar)4.2 POZOİOJİ VE UYGULAMA ŞEKLIPOZOLOJI/UYGULAMA SıKLıĞı VE SÜRESI:Tedavi, hematolojik malign hastalıklar ve malign sarkomlar bulunan hastaların tedavisinde deneyimi olan bir doktor tarafından başlatılmalıdır. Tedavi, hasta yarar sağladığı sürece devam ettirilmelidir. Kronik Miyeloid Lösemi de (KML) DozajGLİVON'un önerilen dozu, kronik fazdaki erişkin KML hastaları için 400 mg/gündür. Kronik faz KML, aşağıdaki tüm kriterlerin karşılandığı durum olarak tanımlanır: kandave kemik iliğinde blast <%15, periferik kan bazofilleri <%20, trombosit >100 x 109/L.GLİVON'un önerilen dozu, akselere fazdaki erişkin hastalar için 600 mg/gündür.Akselere faz, aşağıdakilerden herhangi birinin varlığı olarak tanımlanır: kanda ve kemikiliğinde blast >%15 fakat <%30, kanda ve kemik iliğinde blast artı promiyelosit > %30(<%30 blasta neden olur), periferik kan bazofilleri >%20, trombosit <100 x 109/L(tedaviden ilişkisiz olarak). GLİVON'un önerilen dozu, blast krizindeki erişkin hastalariçin 600 mg/gündür. Blast krizi, kanda veya kemik iliğinde ~ %30 blast ya dahepatosplenomegali harici bir ekstramedüller hastalık olarak tanımlanır. İlaca bağlı oluşan ciddi advers etki ve ağır lösemiyle ilişkili nötropeni veya trombositopeni gelişmemiş olması koşuluyla, hastalığın ilerlemesi (herhangi birzamanda), en az 3 aylık tedaviden sonra tatmin edici bir hematolojik yanıt alınamaması,12 aylık tedaviye rağmen sitogenetik cevap elde edilmemesi veya daha önce elde edilmişolan hematolojik ve/veya sitogenetik yanıtın kaybolması gibi durumlarda; kronik fazdahastalık bulunanlarda dozun 400 mg'dan 600 mg'a yükseltilmesi, ya da hızlanmış fazveya blast krizi bulunan hastalarda da dozun 600 mg'dan maksimum 800 mg günlükdoza yükseltilmesi düşünülebilir. Philedelphia kromozomu pozitif, akut lenfoblastik lösemide (Ph+ ALL) dozajPh+ ALL hastalarında önerilen GLİVON dozajı, remisyon indüksiyon kemoterapi şemaları çerçevesinde belirlenir. Hipereozinofilik sendrom ve sistemik mastositozda dozajYetişkin hipereozinofilik sendrom ve sistemik mastositoz hastalarında önerilen GLİVON dozajı, günde 100 mg'dır. Yanıtsız hallerde 400 mg'a dek çıkılabilir. Bu dozaşılamaz. Gastrointestinal Stromal Tümörlerde (GIST) dozajYetişkin, rezeke edilemeyen ve/veya metastatik malign GIST hastalarında önerilen GLİVON dozajı, günde 4°ftım,g'dı5i elektronik imza ile imzalanmıştır.
Değerlendirmelerin tedaviye yetersiz yanıtı ortaya koymaları durumunda, advers ilaç reaksiyonları göstermeyen hastalarda dozun 400 mg'dan 600 mg veya 800 mg'a yükseltilmesi düşünülebilir. GIST rezeksiyonunu takiben yetişkin hastaların adjuvan tedavisinde önerilen GLİVON dozu 400mg/gün'dür. Önerilen tedavi süresi 36 aydır. Adjuvan tedavi ortamında,GLİVON ile optimum tedavi süresi bilinmemektedir. Advers reaksiyonlar için doz ayarlamalarıHematolojik olmayan advers reaksiyonlarGLİVON kullanıldığında eğer ciddi hematolojik olmayan advers reaksiyon gelişirse, tedavi bu olay ortadan kalkıncaya kadar durdurulmalıdır. Daha sonra, olayın ilkciddiyetine göre değişecek şekilde tedavi devam ettirilir. Eğer bilirubin, normal sınırın üst limitini (NSÜL) 3 kattan fazla aşacak şekilde yükselirse ya da karaciğer transaminazlarında NSÜL değerinin 5 katından fazla artışolursa, GLİVON, bilirubin düzeyleri < 1,5 x NSÜL ve transaminaz düzeyleri <2,5 xNSÜL seviyesine ininceye kadar durdurulmalı ve daha sonra da azaltılmış günlükdozlarla devam ettirilmelidir. Yetişkinlerde doz 400 mg'dan 300 mg'a veya 600 mg'dan400 mg'a veya 800 mg'dan 600 mg'a, çocuklarda ise 260 mg/m2/gün'den 200mg/m2/gün'e veya 340 mg/m2/gün'den 260 mg/m2/gün'e düşürülmelidir. Hematolojik advers reaksiyonlarAğır nötropeni ve trombositopeni geliştiği takdirde dozun azaltılması ya da tedavinin kesilmesi aşağıdaki tabloda belirtildiği şekilde düzenlenmelidir. Tablo 1 Nötropeni ve trombositopeni için doz ayarlamaları
Uygulama şekli:Reçetedeki doz, gastrointe'sti^ıli'etkilietioeft iazaiiittdiiitaektıtçin yemek sırasında ve büyük bir bardak suyla yutulmalıdır. Günde 400 veya 600 miligramlık dozlar bir defada. 800miligramlık ise her birinde 400'er miligram olmak üzere sabah ve akşam iki bölümde alınmalıdır. Film kaplı tabletleri yutamayan hastalarda tablet, bir bardak suda veya elma suyunda dağıtılabilir. İhtiyaç duyulan sayıda tablet, uygun hacimde içeceğin (100 miligramlıktablet için yaklaşık 50, 400 miligramlık tablet için yaklaşık 200 mL) içerisine konarak birkaşıkla karıştırılır. Meydana gelen süspansiyon, tablet(ler)in tam olarak dağılmasındansonra derhal içilmelidir. Özel popülasyonlara ilişkin ek bilgiler:Karaciğer yetmezliği:İmatinib, temel olarak karaciğer yoluyla metabolize olur. Hafif, orta şiddette veya şiddetli karaciğer fonksiyon bozukluğu olan hastalara, önerilen minimal doz olan günde400 mg verilmelidir. Bu doz, tolere edilemediği takdirde azaltılabilir (bkz. bölüm 4.4,4.8, 5.1 ve 5.2). Böbrek yetmezliği:İmatinib ve metabolitleri böbrek yoluyla önemli miktarda atılmazlar. Böbrek yetmezliği olan veya diyaliz uygulanan hastalara böbrek bozukluğu başlangıç dozu olarak, önerilenminimum doz, günlük 400 mg verilebilir. Bununla birlikte, bu hastalarda dikkatliolunması önerilir. Tolere edilememesi halinde doz azaltılabilir ya da etki görülmemesihalinde doz artırabilir (bkz. bölüm 4.4). Pediyatrik popülasyon:GLİVON'un KML endikasyonunda 2 yaşın altındaki çocuklarda ve Ph+ ALL endikasyonunda 1 yaşın altındaki çocuklarda kullanımıyla ilgili herhangi bir deneyimbulunmamaktadır. GLİVON'un diğer endikasyonlarda çocuklarda kullanılmasıkonusundaki deneyim çok sınırlıdır. İmatinibin 18 yaşın altındaki MDS/MPD, DFSP, GIST ve HES/CEL hastası çocuklardaki güvenliliği ve etkililiği klinik çalışmalarda belirlenmemiştir. Halihazırdamevcut yayımlanmış veriler bölüm 5.1'de özetlenmektedir fakat pozoloji ile ilişkili biröneride bulunulamamaktadır (bkz. bölüm 5.1). Çocuklarda doz uygulaması vücut yüzey alanını (mg/m2) temel almalıdır. Kronik faz ve ilerlemiş faz KML'si ve Ph+ ALL'si olan çocuklar için 340 mg/m2 günlük dozönerilmektedir (toplam doz günde 600 mg'ı geçmemelidir). Tedavi KML ve Ph+ALL'de günde bir kere doz uygulaması yoluyla verilebilir. KML'de alternatif olarakgünlük doz iki uygulamaya bölünebilir - sabah bir ve akşam bir (bkz. bölüm 5.1). Geriyatrik popülasyon:Yaşlılarda spesifik olarak imatinib farmakokinetiği araştırılmamıştır. Katılan hastaların %20'sinden fazlasının 65 ve daha yukarı yaşlarda olduğu klinik çalışmalarda, yetişkin hastalarda yaşla ilişkili anlamlı farmakokinetik farklılıklargözlenmemiştir. Yaşlılarda, özel bir doz önerisi gerekli değildir. 4.3. KontrendikasyonlarAktif maddeye veya eksipiyanlardan herhangi birine karşı aşırı duyarlılık. 4.4. Özel kullanım uyarıları ve önlemleriGLİVON, başka ilaçlarla eşzamanlı olarak kullanıldığında önemli ilaç etkileşimleri görülme potansiyeli bulunmaktadır. GLİVON, proteaz inhibitörleri, azol antifungaller,belirli makrolitler (bkz. bölüm 4.5), dar terapötik pencereye sahip CYP3A4 substratları (örn. siklosporin, pimozid, takrolimus, sirolimus, ergotamin, diergotamin, fentanil, alfentanil, terfenadin, bortezomib, dosetaksel, kinidin) veya varfarin ve diğer kumarintürevleri ile birlikte verildiğinde dikkatli olunmalıdır (bkz. bölüm 4.5). İmatinib ve CYP3A4 enzimini indükleyen tıbbi ürünlerin (örn. deksametazon, fenitoin, karbamazepin, rifampisin, fenobarbital veya Hypericum perforatum[Sarı kantaron])eşzamanlı kullanımı, imatinib maruziyetini önemli ölçüde azaltarak terapötik başarısızlıkriskini artırabilir. Bu nedenle kuvvetli CYP3A4 indükleyicilerinin ve imatinibineşzamanlı uygulamasından kaçınılmalıdır (bkz. bölüm 4.5).Ateş düşürücü olarak düzenli aralıklarla parasetamol (asetaminofen) alan bir hastanın akut karaciğer yetmezliği nedeniyle öldüğü bildirilmiştir. Etiyolojisi tam olarakbilinmemekle beraber, parasetamol/asetaminofen kullanımında dikkatli olunmalıdır (bkz.bölüm 4.5). Hipotiroidizm: İmatinib tedavisi sırasında levotiroksin replasmanı yapılan tiroidektomi hastalarında klinik hipotiroidizm olguları bildirilmiştir. Bu tür hastalarda tiroid stimule edici hormon(TSH) düzeyleri yakından izlenmelidir. Hepatotoksisite: Karaciğer disfonksiyonu (hafif, orta şiddette ve şiddetli) olan hastalarda, periferik kan sayımları ve karaciğer enzimleri dikkatli bir şekilde izlenmelidir (bkz. bölüm 4.2, 4.8, 5.1, 5.2). GIST hastalarında karaciğer yetmezliğine sebebiyet verebilecek karaciğermetaztazları görülmesi olasıdır. İmatinib ile karaciğer yetmezliği ve hepatik nekroz dahil karaciğer hasarı vakaları gözlenmiştir. İmatinib, yüksek doz kemoterapi rejimleri ile kombine edildiğinde ciddihepatik reaksiyonlarda bir artış bildirilmiştir. İmatinib, yüksek doz kemoterapi kürleriylebirlikte kullanıldığında transaminaz ve bilirubin düzeylerinin yükselmesi şeklinde, geçicikaraciğer toksisitesi görülmüştür. Buna ilave olarak yaygın olmayan akut karaciğeryetmezliği rapor edilmiştir. İmatinib, karaciğer fonksiyon bozukluğu potansiyeli olankemoterapi kürleriyle birlikte kullanılacaksa, karaciğer fonksiyonlarının izlenmesitavsiye edilir (bkz. bölüm 4.8). Sıvı retansiyonu: İmatinib alan yeni tanı konulmuş KML hastalarının yaklaşık %2,5'inde ciddi sıvı retansiyonu (plevral efüzyon, ödem, pulmoner ödem, asit, yüzeysel ödem) ortaya çıktığıbildirilmiştir. Bu nedenle, hastalarda düzenli aralıklarla kilo kontrolü önerilir.Beklenmedik, ani bir kilo artışı dikkatli araştırılmalı ve gerektiğinde uygun destektedavisi uygulanmalı ve terapötik önlemler alınmalıdır. Klinik çalışmalarda, yaşlıhastalarda ve daha önceden kardiyak hastalık hikayesi bulunanlarda bu olaylarıninsidanslarının arttığı saptanmıştır. Kardiyak disfonksiyonu olan hastalarda dikkatliolunmalıdır. Kalp hastalığı ya da böbrek yetmezliği olan hastalar: Kalp hastalığı, kalp yetmezliği açısından risk faktörleri bulunan veya böbrek yetmezliği hikayesi olan hastalar dikkatlice takip edilmeli, kalp veya böbrek yetmezliğinidüşündüren belirti ve semptomları olan her hasta değerlendirilmeli ve tedavi edilmelidir. Miyokardiyum içinde hipereozinofili sendromu (HES) hücrelerinin gizli sızdırmasının görüldüğü hastalarda izole kardiyojenik şok/sol ventrikül disfonksiyonu olguları,imatinib tedavisine başlanmasıyla beraber oluşan HES hücre degranülasyonu ileilişkilendirilmiştir. Bu durumun sistemik steroidler kullanılarak, dolaşımı destekleyenönlemler alarak ve imatinib tedavisini geçici olarak durdurarak düzeltilebileceğibildirilmiştir. Yaygın olmayan kardiyak yan etkiler bildirildiği için, GLİVON tedavisinebaşlamadan önce dikkatli bir yarar/zarar (risk) değerlendirmesi yapılmalıdır.Miyelodisplastik/miyeloproliferatif hastalıklar (MDS/MPD) ve sistemik mastositozyüksek eozinofil düzeyleri ile ilişkili olabilir. Bu nedenle, eozinofil düzeylerinin yüksekolduğu MDS/MPD vakalarında, sistemik mastositoz (SM) vakalarında ve HESvakalarında kardiyoloji uzmanı tarafından değerlendirme yapılmalı, ekokardiyografikinceleme yapılmalı ve serum troponin düzeyleri ölçülmelidir. Bunlardan birindeanormallik tespit edilirse kardiyoloji uzmanı ile beraber takip edilmeli ve tedavibaşlangıcında imatinible birlikte 1-2 hafta boyunca 1-2 mg/kg dozunda sistemik steroidkullanılması düşünülmelidir. Gastrointestinal kanama: Rezeke edilemeyen ve/veya metastatik GIST'li hastalarda yürütülen bir çalışmada gerek gastrointestinal gerekse tümör içi hemorajiler bildirilmiştir (bkz. bölüm 4.8). Eldekiverilere dayanılarak, GIST'li hastaları her iki hemoraji tipi açısından daha yüksek riskaltına sokan herhangi bir predispozan faktör tanımlanmamıştır (örn. tümör büyüklüğü,tümör yeri, pıhtılaşma bozuklukları). Vaskülarite artışı ve kanamaya yatkınlıkta artış,GIST'in doğasında yer aldığından ve hastalığın klinik seyrinin parçası olduğundan, tümhastalarda hemoraji izlemi ve kontrolüne yönelik standart uygulamalar ve prosedürleruygulanmalıdır. Ayrıca, KML, ALL ve diğer hastalıkları olan hastalarda pazarlama sonrası deneyimde nadir bir gastrointestinal hemoraji nedeni olarak gastrik antral vasküler ektazi (GAVE)bildirilmiştir (bkz. bölüm 4.8). Gerektiğinde, GLİVON tedavisinin bırakılmasıdüşünülmelidir. Tümör lizis sendromu: İmatinib ile tedavi edilen hastalarda tümör lizis sendromu (TLS) vakaları bildirilmiştir. TLS meydana gelme olasılığı nedeniyle, GLİVON başlatılmadan önce klinik açıdananlamlı dehidrasyonun düzeltilmesi ve yüksek ürik asit düzeylerinin tedavisiönerilmektedir (bkz. bölüm 4.8). Hepatit B reaktivasyonu: Hepatit B virüsü (HBV) kronik taşıyıcısı olan hastalarda, BCR-ABL tirozin kinaz inhibitörleri ile tedavi sonrası, Hepatit B reaktivasyonu ortaya çıkmıştır. Bazı vakalar,karaciğer nakli veya ölüme sebep olan akut karaciğer yetmezliği veya fulminan hepatitile sonuçlanır. GLİVON tedavisine başlanmadan önce, hastalar HBV enfeksiyonu açısından test edilmelidir. Pozitif HBV serolojisine sahip (aktif hastalığı olanlar dahil) ve tedavisırasında HBV enfeksiyonu için pozitif test sonucu veren hastalarda, tedavibaşlatılmadan önce karaciğer hastalığı ve HBV tedavisi konusunda uzman hekimleredanışılmalıdır. GLİVON ile tedaviye ihtiyaç duyan HBV taşıyıcıları, tedavi boyunca vetedavi sonlandırıldıktan sonra birkaç ay boyunca aktif HBV enfeksiyonu bulgu vebelirtileri için yakından izlenmelidir (bkz. bölüm 4.8). Fototoksisite: gy belge
İmatinib alan çocuklarda ve ergenlik öncesi çocuklarda görülen büyüme geriliğine ilişkin vaka raporları alınmıştır. CML pediyatrik popülasyonundaki gözlemsel bir çalışmada ikiküçük alt kümede pubertal durum veya cinsiyet fark etmeksizin medyan boy standartsapma skorlarında 12 ve 24 ay sonra istatistiksel olarak anlamlı (fakat klinik anlamlılığıbelirsiz) bir azalma bildirilmiştir. İmatinib tedavisi görmekte olan çocuklarda büyümeninyakından izlenmesi önerilir (bkz. bölüm 4.8). 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriİmatinibin plazma konsantrasyonlarını değiştiren ilaçlar İmatinibin plazma konsantrasyonlarını artırabilen ilaçlar: Sitokrom P450 izoenzimlerinden CYP3A4 aktivitesini inhibe eden maddeler (örn. indinavir, lopinavir/ritonavir, ritonavir, sakinavir, telaprevir, nelfinavir ve boseprevirgibi proteaz inhibitörleri; ketokonazol, itrakonazol, posakonazol ve varikonazol gibi azolantifungal ajanlar; eritromisin, klaritromisin ve telitromisin gibi belirli makrolidler)metabolizmayı azaltabilir ve imatinib konsantrasyonlarını artırabilirler. Sağlıklıdeneklere tek doz ketokonazol (bir CYP3A4 inhibitörü) ile birlikte uygulandığında,imatinibe maruz kalma durumunda anlamlı bir artış ortaya çıkmıştır (imatinibin ortalamaCmaks ve EAA değerleri sırasıyla %26 ve %40 artmıştır). GLİVON, CYP3A4 izoziminininhibitörleri ile birlikte verilirken dikkatli olunmalıdır. İmatinibin plazma konsantrasyonlarını azaltabilen ilaçlar: ile eşzamanlı uygulama GLİVON'a maruz kalmayı azaltabilir. Sağlıklı 14 gönüllünün 8 gün boyunca günde 600 mg rifampisin kullanmasından sonraverilen, 400 miligramlık tek doz imatinib, oral doz klirensini 3,8 kat artırmıştır (%90güven aralığı 3,5-4,5). Bu artış, ortalama pik plazma konsantrasyonu (Cmaks), plazmakonsantrasyonu-zaman eisi (EAA(0-24 ssat) ve EAA(0-ro)) değerlerinin, daha öncerifampin kullanılmamasına kıyasla sırasıyla %54, %68 ve %74 azalması demektir.Karbamazepin, okskarbazepin, fenitoin, fosfenitoin, fenobarbital ve primidon gibienzim indükleyici anti-epileptik ilaçlar (AEİ) kullanırken imatinib ile tedavi edilenmalign gliyomlu hastalarda da benzer sonuçlar gözlenmiştir. İmatinib için plazma EAAdeğeri, AEİ'ler kullanmayan hastalarla karşılaştırıldığında %73 oranında azalmıştır.Yayınlanmış iki çalışmada, imatinib ve St. John's Wort içeren bir ürünün birlikteuygulanması imatinib EAA değerinde %30-32'lik bir azalmaya yol açmıştır. Rifampin veya CYP3A4 indüksiyonu yapan diğer ilaçların kullanılmasına ihtiyaç olduğunda, enzim indüksiyon potansiyeli daha az olan başka ilaçların kullanılmasıdüşünülmelidir. GLİVON ile plazma konsantrasyonu değişebilen ilaçlar: İmatinib, simvastatinin (CYP3A4 substratı) ortalama Cmaks ve EAA değerlerini sırasıyla 2 ve 3,5 kat artırmaktadır ve bu durum CYP3A4'ün imatinib tarafından inhibe edildiğinigöstermektedir. Bu nedenle GLİVON, dar bir terapötik pencereye sahip CYP3A4substratlarıyla (örn. siklosporin, pimozid, takrolimus, sirolimus, ergotamin, diergotamin,fentanil, alfentanil, terfenadin, bortezomib, dosetaksel, kinidin) birlikte uygulandığındadikkatli olunmalıdır. GLİVON, CYP3A4 tarafından metabolize edilen diğer ilaçların daplazma konsantrasyonunu artırabilir (örn. triazolo-benzodiazepinler, dihidropiridinkalsiyum kanal blokörleri, bazı HMG-KoA redüktaz inhibitörleri, örn. statinler, vs.). İmatinib kullanımı ile birlikte bilinen artmış kanama riski nedeniyle (örn. hemoraji), anti-koagülasyon gerektiren hastalar varfarin gibi kumarin türevleri yerine düşükmolekül ağırlıklı ya da standart heparin ile tedavi edilmelidir. In vitroortamda imatinib, CYP3A4 aktivitesini etkileyen konsantrasyonların benzeri konsantrasyonlarda sitokrom P450 izoenzimlerinden CYP2D6 aktivitesini de inhibeetmektedir. Günde iki kez 400 mg dozda uygulanan imatinibin CYP2D6-aracılımetoprolol metabolizması üzerinde zayıf bir inhibitör etkisi vardır; metoprolol Cmaks veEAA değerleri yaklaşık %23 kadar artar (%90 GA [1,16-1,30]). İmatinib, CYP2D6substratları ile bir arada uygulandığında doz ayarlamalarının gerekli olmadığıgörülmektedir ancak metoprolol gibi dar terapötik pencereye sahip CYP2D6 substratlarıile dikkatli olunması tavsiye edilir. Metoprolol ile tedavi edilen hastalarda klinik izlemgöz önünde bulundurulmalıdır.İmatinib in vitroin vivokoşullarda, 400 mg imatinib ve 1000 mg parasetamoluygulamasının ardından görülmemiştir. Daha yüksek imatinib ve parasetamol dozlarıçalışılmamıştır. Bu nedenle yüksek dozda imatinib ve parasetamol eşzamanlıuygulanırken dikkatli olunmalıdır.Levotiroksin kullanan tiroidektomi hastalarında imatinib eşzamanlı kullanıldığında levotiroksine plazma maruziyeti azalabilir (bkz. bölüm 4.4). Bu nedenle dikkat önerilir.Bununla birlikte gözlenen etkileşimin mekanizması halen bilinmemektedir. Belge Do^ ^ Tüm Th+ ALL nastal^rında kemoterapiyle eşzamanlı olarak imatinio^uygulanmasıyTa ilgili klinik deneyim vardır (bkz. bölüm 5.1), ancak imatinib ve kemoterapi rejimleri arasındaki ilaç-ilaç etkileşimleri iyi tanımlanmamıştır. İmatinibin advers etkileri, örn.hepatotoksisite, miyelosupresyon ya da diğerleri artış gösterebilir ve L-asparaginaz ileeşzamanlı kullanımın hepatatoksite artışıyla ilişkili olabileceği bildirilmiştir (bkz. bölüm4.8). Bu nedenle, imatinibin kombinasyonda kullanımı özel dikkat gerektirmektedir. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin klinik etkileşim çalışması yürütülmemiştir. Pediyatrik popülasyonPediyatrik popülasyona ilişkin klinik etkileşim çalışması yürütülmemiştir. Bu ürün sorbitol ve maltitol içermektedir. Nadir kalıtımsal früktoz intolerans problemi olan hastaların bu ilacı kullanmamaları gerekir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi D'dir. Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlara tedavi sırasında etkili bir kontrasepsiyon uygulamaları önerilmelidir. Yüksek düzeyde etkili kontrasepsiyon, düzenli ve dou birşekilde kullanıldığında başarısızlık oranı düşük olan (yani, yıl başına %1'den düşük) birdoğum kontrol yöntemidir. Gebelik dönemiHayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. bölüm 5.3). İmatinibin gebe kadınlarda kullanımına ilişkin klinik çalışmalarmevcut değildir. İmatinib alan kadınlarda spontan düşükler ve bebekte konjenitalanomalilerle ilgili pazarlama sonrası raporlar mevcuttur. GLİVON, beklenen fayda,potansiyel riske ağır basmadığı sürece gebelik sırasında kullanılmamalıdır. Gebeliksırasında kullanılması durumunda, hastaya fötüs üzerindeki potansiyel riskleri hakkındabilgi verilmelidir. Laktasyon dönemiHem imatinib, hem de aktif metaboliti anne sütüne geçebilir. Süt/plazma oranı imatinib için 0,5, metaboliti için ise 0,9 olarak saptanmıştır; bu da metabolitin süte daha büyükoranda geçtiğini düşündürmektedir. İmatinib ve metabolitinin toplam konsantrasyonu vebebeklerin maksimum günlük süt alımı düşünüldüğünde, toplam maruziyetin düşükolması beklenir (bir terapötik dozun ~%10'u). Bununla birlikte, bebeğin imatinibe düşükdozlarda maruz kalmasının etkileri bilinmediğinden, GLİVON kullanan annelerbebeklerini emzirmemelidir. Üreme yeteneği/Fertiliteİmatinib alan erkek hastalarda ilacın erkek fertilitesi ve spermatogenezi üzerindeki etkileri ile ilgili klinik çalışmalar yapılmamıştır. GLİVON tedavisi gören ve fertilitekonusunda endişe duyan erkek hastalar hekimlerine danışmalıdır. Üremeyeteneği/fertilite konusunda yapılan klinik öncesi çalışmalar için ilgili bölüme bakınız.(bkz. bölüm 5.3). Belge Do4n?Kodu:ARAŞaVE JmafemA^UİiaHTOCTyA^etkİSİBelge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebysİmatinib alan hastalarda motorlu araç kazaları bildirilmiştir. Bu raporların büyük kısmında sebebin imatinib olduğundan şüphelenilmemiş olsa da, hastalara imatinib ile tedavi sırasında baş dönmesi, somnolans ya da bulanık görme gibi istenmeyen etkileryaşayabilecekleri bildirilmelidir. Bu nedenle, araba ya da araç kullanırken dikkatliolunması önerilmelidir. 4.8. İstenmeyen etkilerİleri aşamalarda maligniteleri olan hastalarda, altta yatan hastalık, progresyon ve sayısız tıbbi ürünün eşzamanlı uygulanması ile bağlantılı çeşitli semptomlar nedeniyle adversreaksiyonların nedensellik ilişkisinin değerlendirilmesini zorlaştıran sayısızkarmaşıklaştırıcı tıbbi durum mevcut olabilir. KML klinik çalışmalarında ilaçla ilişkili advers reaksiyonlar nedeniyle ilacın kesilmesi durumu, yeni tanı konan hastaların %2,4'ünde, interferon tedavisinin başarısızolmasından sonra geç kronik fazdaki hastaların %4'ünde, interferon tedavisinin başarısızolmasından sonra hızlanmış fazdaki hastaların %4'ünde ve interferon tedavisininbaşarısız olmasından sonra blast krizindeki hastaların %5'inde gözlenmiştir. GISTçalışmasında ilaç, hastaların %4'üne ilaçla ilişkili advers reaksiyonlar nedeniylekesilmiştir. İki istisna haricinde advers reaksiyonlar tüm endikasyonlarda benzer olmuştur. GIST ile karşılaştırıldığında KML hastalarında daha fazla miyelosüpresyon görülmüştür, budurum olasılıkla altta yatan hastalık ile ilişkilidir. Rezekte edilemeyen ve/veya metastatikGIST'li hastalarda yürütülen bir çalışmada 7 (%5) hasta CTC derece 3/4 GI kanamalar (3hasta), tümör içi kanamalar (3 hasta) ya da ikisini birden (1 hasta) yaşamıştır. GI tümörbölgeleri GI kanamaların kaynağı olmuş olabilir (bkz. bölüm 4.4). GI ve tümörkanamaları ciddi ve bazen ölümcül olabilmektedir. Her iki endikasyonda en sık bildirilen(>%10) ilaçla ilişkili advers reaksiyonlar hafif bulantı, kusma, ishal, abdominal aı,yorgunluk, kas aısı, kas krampları ve döküntü olmuştur. Yüzeysel ödemler tümçalışmalarda yaygın bir bulgu olmuş ve temelde periorbital ya da alt uzuv ödemlerişeklinde tarif edilmiştir. Bununla birlikte, bu ödemler nadiren şiddetli olmuş vediüretiklerle, diğer destekleyici önlemlerle veya imatinib dozu azaltılarak kontroledilebilmiştir. İmatinib Ph+ ALL hastalarında yüksek doz kemoterapi ile kombine edildiğine transaminaz yükselmesi ve hiperbilirubinemi formunda geçici karaciğer toksisitesigözlenmiştir. Sınırlı güvenlilik veritabanı göz önünde bulundurulduğunda, çocuklarda şuana kadar bildirilen advers olaylar, erişkin Ph+ ALL hastalarında bilinen güvenlilikprofili ile uyumludur. Ph+ ALL hastası çocuklardaki güvenlilik veritabanı çok sınırlıolmakla birlikte herhangi bir yeni güvenlilik endişesi tanımlanmamıştır. Plevral efüzyon, assit, pulmoner ödem ve yüzeysel ödemin eşlik ettiği ya da etmediği hızlı kilo artışı gibi çeşitli advers reaksiyonlar kolektif olarak sıvı tutulumu şeklindetarif edilebilir. Bu reaksiyonlar genellikle imatinib tedavi geçici olarak durdurularak vediüretiklerle ya da diğer uygun destekleyici bakım önlemleriyle kontrol edilebilmektedir.Diğer yandan, bu reaksiyonların bazıları şiddetli ya da yaşamı tehdit edici olabilmektedirve blast krizi olan çeşitli hastalar plevral efüzyon, konjestif kalp yetmezliği ve böbrekyetmezliğinden oluşan kompleks bir klinik öykü ile yaşamlarını kaybetmiştir. Pediyatrikklinik çalışmalarda özel bir güvenlilik bulgusu söz konusu olmamıştır. Olayların şiddetine bağliuolaEakvdfflzisayaclamaat igenekliıfilabilir. Çok az sayıda vakada advers reaksiyonlara bağlı olarak ilacın bırakılması gerekecektir. Advers reaksiyonlar en sık görülen en önce olmak üzere ve şu sınıflandırma uygulanarak sıklıklarına göre sıralanmıştır: Çok yaygın (> 1/10); yaygın (> 1/100, < 1/10); yaygınolmayan(> 1/1.000, < 1/100); seyrek (> 1/10.000, < 1/1.000); çok seyrek (< 1/10.000),bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Aşağıda bildirilen adversreaksiyonlar ve sıklıkları, KML ve GIST için yürütülen çalışmalara dayanmaktadır. Gözlenen advers reaksiyonlar Enfeksiyonlar ve enfestasyonlarYaygın olmayan: Herpes zoster, herpes simplex, nazofarenjit , pnömoni1, sinüzit, selülit, üst solunum yolu enfeksiyonu, influenza, idrar yolu enfeksiyonu, gastroenteritis, sepsisSeyrek: Fungal enfeksiyonBilinmiyor: Hepatit B reaktivasyonu* (Kist ve polipler de dahil olmak üzere) iyi huylu ve kötü huylu neoplazmalarSeyrek: Tümör lizis sendromu Bilinmiyor: Tümör kanaması/tümör nekrozu* Kan ve lenf sistemi hastalıklarıÇok yaygın: Nötropeni, trombositopeni, anemi Yaygın: Pansitopeni, febril nötropeni
kemik iliği depresyonu, eozinofili,
Yaygın olmayan: Trombositemi, lenfopeni, lenfadenopati Seyrek: Hemolitik anemi Bağışıklık sistemi hastalıkları:Bilinmiyor: Anafilaktik şok* Metabolizma ve beslenme bozukluklarıYaygın: Anoreksi Yaygın olmayan: Hipokalemi, iştah artışı, hipofosfatemi, iştah azalması, dehidrasyon, gut, hiperürisemi, hiperkalsemi, hiperglisemi, hiponatremiSeyrek: Hiperkalemi, hipomagnezemi Psikiyatrik hastalıklarYaygın: Uykusuzluk Yaygın olmayan: Depresyon, libido azalması, anksiyete Seyrek: Konfüzyon Sinir sistemi hastalıklarıÇok yaygın: Baş aısı2 Yaygın: Göz kararması, parestezi, tat duyusu bozuklukları, hipoestezi Yaygın olmayan: Migren, somnolans, senkop, periferik nöropati, bellek bozukluğu, siyatik, huzursuz ayak sendromu, tremor, beyin kanaması Seyrek: Kafa-içi basıncının artması, konvülziyon, optik nörit Bilinmiyor: Serebral ödem* GÖZ HASTALıKLARıYaygın: Göz kapağı ödemi, lakrimasyon artışı, konjunktiva kanaması, konjunktivit, göz kuruması, bulanık görme Yaygın olmayan: Göz tahrişi, göz aısı, orbita ödemi, sklera kanaması, retina kanaması,
Seyrek: Katarakt, glokom, papilödem Bilinmiyor: Vitröz kanama* Kulak ve iç kulak hastalıklarıYaygın olmayan: Vertigo, kulak çınlaması, işitme kaybı Kardiyak hastalıklarıYaygın olmayan: Palpitasyonlar , taşikardi, konjestif kalp yetmezliği3, pulmoner ödem Seyrek: Aritmi, atriyal fibrilasyon, kardiyak arest, miyokartd enfarktüsü, angina pektoris,perikardiyal efüzyonBilinmiyor: Perikardit*, kalp tamponadı* Vasküler hastalıkları4Yaygın: Al basması, kanama Yaygın olmayan: Hipertansiyon, hematom, subdural hematom, periferik soğukluk, hipotansiyon, Raynaud fenomeniBilinmiyor: Tromboz/emboli* Solunum, göğüs bozuklukları ve mediastinal hastalıklarıYaygın: Dispne, burun kanaması, öksürük Yaygın olmayan: Plevral efüzyon5, faringolaringeal aı, farenjit Seyrek: Plevra aısı, pulmoner fibroz, pulmoner hipertansiyon, pulmoner kanama Bilinmiyor: Akut respiratuvar yetmezlik11*, interstisyal akciğer hastalığı* Gastrointestinal hastalıklarıÇok yaygın: Bulantı, ishal, kusma, dispepsi, karın aısı6 Yaygın: Aşırı miktarda barsak gazları, karında gerilme, gastro-özofageal reflü, kabızlık, ağız kuruması, gastrit Yaygın olmayan: Stomatit, ağız ülserasyonu, gastrointestinal kanama7, geğirme, melena, özofajit, asit, gastrik ülser, kan kusma, dudak iltihabı, disfaji, pankreatitSeyrek: Kolit, ileus, enflamatuar barsak hastalığı Bilinmiyor: İleus/intestinal obstrüksiyon*, gastrointestinal perforasyon*, divertikülit*, gastrik antral vasküler ektazi (GAVE)* Hepato-bilier hastalıklarıYaygın: Karaciğer enzimlerinde artışYaygın olmayan: Hiperbilirübinemi, hepatit, sarılık Seyrek: Karaciğer yetmezliği8, hepatik nekroz Deri ve deri altı doku hastalıklarıÇok yaygın: Periorbital ödem, dermatit/egzama/deri döküntüsü Yaygın: Kaşıntı, yüz ödemi, deride kuruma, eritem, alopesi, gece terlemeleri, ışığa duyarlılık reaksiyonu Yaygın olmayan: Püstüler döküntü, kontüzyon, terlemede artış, ürtiker, ekimoz, çürük eğiliminde artış, hipotrikoz, deride hipopigmentasyon, eksfoliyatif dermatit, tırnakkırılması, folikülit, peteşiler, psoriazis, purpura, deride hiperpigmentasyon, büllözerupsiyonlar Seyrek: Akut febril nötrofilik dermatoz (Sweet's hastalığı), tırnakta renk kaybı, anjiyonörotik ödem, veziküler döküntü, eritem multiform, lökositoklastik vaskülit, Stevens-Johnson sendromu, akut jeneralize ekzantematöz püstülozis (AGEP) Bilinmiyor: Palmar-plantar eritrodisestezi sendromu (el-ayak sendromu)*, likenoid Belge Doearltoouz*i£^^k?a&piafixuz*Jİok|fkŞİi%(rİalnekrolI|TTİo;zlSofilipve/wsİswtfumik.gsoevm/patgoffll§rle%y^ilaç döküntüsü (DRESS sendromu)*, psödoporfiri* Kas-iskelet bozukluklar, bağ doku ve kemik hastalıklarıÇok yaygın: Kas spazmları ve krampları, miyalji9, artralji, kemik aısı10 da dahil olmak üzere kas-iskelet aıları Yaygın: Eklemlerde şişme Yaygın olmayan: Kaslarda ve eklemlerde sertlik Seyrek: Kas zayıflığı, artrit, rabdomiyoliz/miyopati Bilinmiyor: Avasküler nekroz/kalça osteonekrozu1, çocuklarda büyüme geriliği1 Böbrek ve idrar yolu hastalıklarıYaygın olmayan: Böbrek aısı, hematüri, akut böbrek yetmezliği, idrar sıklığında artış Bilinmiyor: Kronik böbrek yetmezliği Üreme sistemi ve meme hastalıklarıYaygın olmayan: Jinekomasti, erektil disfonksiyon, menoraji, düzensiz menstrüasyon, cinsel disfonksiyon, meme başında aı, memelerde büyüme, skrotum ödemiÇok seyrek: Hemorajik korpus luteum, hemorajik over kisti Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıÇok yaygın: Sıvı retansiyonu ve ödem, yorgunluk Yaygın: Güçsüzlük, pireksi, anazarka , titreme nöbetleri, kaslarda sertlikler Yaygın olmayan: Göğüs aısı, keyifsizlik Laboratuvar bulgularıÇok yaygın: Vücut ağırlığı artışı Yaygın: Vücut ağırlığı azalması Yaygın olmayan: Kanda kreatinin düzeyinin yükselmesi, kandaki kreatin fosfokinaz düzeyinin yükselmesi, kandaki laktat dehidrojenaz düzeyinin yükselmesi, kanda alkalinfosfataz düzeyinin yükselmesiSeyrek: Kanda amilaz düzeyinin yükselmesi Laboratuvar testi anormallikleri HematolojiKML'de başta nötropeni ve trombositopeni olmak üzere sitopeniler tüm çalışmaların devamlı bir bulgusu olmuş, > 750 mg gibi daha yüksek dozlarda daha sık olduklarıdüşünülmüştür (faz I çalışma). Bununla birlikte, sitopenilerin ortaya çıkışı, aynı zamandaaçıkça hastalığın evresine de bağlı olmuştur. Sitopeniler, yeni tanı konulan KMLvakalarında, diğer vakalara kıyasla daha seyrektir. Evre 3 veya 4 nötropenilerin (ANC <1,0x109/L) ve trombositopenilerin (trombosit sayısı <50x109/L) blast krizindeki vehızlanmış fazdaki sıklığı, yeni tanı konulan kronik faz KML vakalarındakinin 4-6 katıdır.Yeni tanı kronik faz KML vakalarında %16,7 nötropeni ve %8,9 trombositopenigörülürken, bu oranlar hızlanmış ve blastik fazda sırasıyla, %59-64 ve %44-63 olarakbildirilmiştir. Yeni tanı konulmuş olan kronik faz KML vakalarında evre 4 nötropeni(ANC < 0,5x109/L) ve trombositopeni (trombosit sayısı <10x109/L), sırasıyla yalnızca%3,6 ve <%1 oranında görülmüştür. Nötropenik ve trombositopenik periyotlarınortalama süresi genellikle sırasıyla 2 ve 3. haftalar arasında ve 3 ve 4. haftalar arasındayer almıştır. Bu olaylar, genellikle imatinib ile tedavinin dozu azaltılarak ya da tedavikesilerek kontrol edilebilir, ancak bazı nadir vakalarda kalıcı olarak tedavininbırakılmasına neden olabilir. Pediyatrik KML hastalarında en sık gözlenen toksisiteler;nötropeni, trombositopeni ve anemi dahil olmak üzere 3 ya da 4. derece sitopenilerolmuştur. Bunlar genellikle ilk birkaç ay içerisinde gerçekleşmektedir. Rezeke edilemeyen ya da metastatik malign GIST (çalışma B2222) bulunan hastalarda, sırasıyla hastaların %5,4 ve %0,7'sinde evre 3 ve 4 anemi bildirilmiştir ve bu durum enazından bazı hastalarda gastrointestinal ya da intra-tümöral kanamayla ilişkili olabilir.Sırasıyla hastaların %7,5 ve %2,7'sinde evre 3 ve 4 nötropeni ve hastaların %0,7'sindeevre 3 trombositopeni görülmüştür. Hiçbir hastada evre 4 trombositopeni gelişmemiştir.Özellikle tedavinin ilk 6 haftasında beyaz kan hücresi ve nötrofil sayılarında azalmalarortaya çıkmış, bu değerler daha sonra nispeten sabit kalmıştır. BiyokimyaKML hastalarında transaminazlarda (<%5) ya da bilirubinde (<%1) ciddi artışlar olmuştur ve genellikle doz azaltılarak ya da kesilerek (bu epizodların ortalama süresiyaklaşık 1 hafta olmuştur) kontrol altına alınmıştır. KML hastaların %1'inden azındakaraciğer laboratuar anormallikleri nedeniyle tedavi sürekli olarak kesilmiştir. GISThastalarının (çalışma B2222) %6,8'inde 3. veya 4. evre SGPT (serum glutamik piruviktransferaz); %4,8'inde 3. veya 4. evre SGOT (serum glutamik oksaloasetik transferaz)yükselmeleri kaydedilmiş; bilirübin düzeyi yükselen hastaların oranı %3'ün altındakalmıştır. Nadir sitolitik ve kolestatik hepatit ve karaciğer yetmezliği olguları söz konusu olmuştur; yüksek doz parasetamol kullanan bir hasta dahil olmak üzere bunların bazıları ölümlesonuçlanmıştır. Seçili advers reaksiyonların tanımlanmasıHepatit B reaktivasyonuBCR-ABL TKI'lerle ilişkili olarak hepatit B reaktivasyonu bildirilmiştir. Bazı vakalarda, karaciğer nakliyle veya ölümle sonuçlanan akut karaciğer yetmezliği veya fulminanhepatit ortaya çıkmıştır (bkz. bölüm 4.4). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarakizlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli adversreaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr:[email protected]. Doz aşımıTerapötik dozlardan daha yüksek dozlarla deneyim sınırlıdır. GLİVON doz aşımı ile ilgili bireysel vakalar spontan olarak ve literatürde bildirilmiştir. Genellikle, buvakalarda bildirilen sonuçlar düzelme ya da iyileşme şeklinde olmuştur. Doz aşımıhalinde, hasta gözlem altında tutulmalı ve uygun semptomatik tedavi uygulanmalıdır.Farklı doz aralıklarında bildirilen olaylar aşağıda verilmiştir: Erişkinlerde doz aşımı: 1200 ila 1600 mg (1 ila 10 gün arasında değişen sürelerle): Bulantı, kusma, diyare, döküntü, eritem, ödem, şişme, yorgunluk, kas spazmları, trombositopeni, pansitopeni,karın aısı, baş aısı, iştahta azalma. 1800 ila 3200 mg (6 gün boyunca günde 3200 mg'a kadar dozlar): Güçsüzlük, miyalji, CPK düzeyinde yükselme, bilirubin düzeyinde yükselme, gastrointestinal aı. 6400 mg (tek doz): Literatürde yer alan bir vakada, bulantı, kusma, karın aısı, pireksi, yüzde şişme, nötrofil sayısında azalma, transaminaz düzeylerinde yükselme görülen birhasta bildirilmiştir. 8 ila 10 g (tek doz): Kusma ve gastrointestinal aı bildirilmiştir. Pediyatrik doz aşımı: 400 mg'lık tek doza maruz kalan 3 yaşındaki bir erkek çocukta kusma, diyare ve anoreksi; 980 mg'lık tek doza maruz kalan 3 yaşındaki diğer bir erkek çocukta iselökosit sayısında azalma ve diyare görülmüştür. 5. Farmakolojik özellikler5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Antineoplastik ajan, protein-tirozin kinaz inhibitörü, BCR-ABL tirozin kinaz inhibitörleriATC kodu: L01EA01 Etki mekanizması: İmatinib küçük bir molekül yapısına sahip bir protein-tirozin kinaz inhibitörüdür; Bcr-Abl tirozin kinaz (TK) aktivitesini ve birçok reseptör TK'yı kuvvetli bir şekilde inhibe etmektedir: KIT, c-KIT proto-onkogen tarafından kodlanan kök hücre faktörü (Stem cellfactor - SCF) reseptörü, diskoidin etki bölgesine ait reseptörler (DDR1 ve DDR2), koloniuyarıcı faktör reseptörü (CSF-1R), trombosit kökenli büyüme faktörü (Platelet derivedgrowth factor - PDGF) reseptörleri alfa ve beta (PDGFR-alfa ve PDGFR-beta). İmatinibaynı zamanda bu reseptör kinazların aktivasyonunun aracılık ettiği hücresel olayları dainhibe edebilmektedir. İmatinib, in vitre,in vivoEx vivoperiferik kan ve kemik iliği örneklerininkullanıldığı koloni transformasyon tahlillerinde, imatinib KML hastalarındaki Bcr-Ablpozitif kolonilerde selektifûnbibiisyöflegfâstermefctediranmıştır.Belge Doama Kodu: lZW56aklUZlAxZlAxM0FySHY3M0FyQ3NR Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebysBileşik, in vivoolarak, Bcr-Abl pozitif tümör hücreleri kullanılan hayvan modellerindetek ajan olarak anti-tümör aktivite gösterir. İmatinib, aynı zamanda trombosit türevi büyüme faktörü (Platelet derived growth factor -PDGF) ve kök hücre faktörü (Stem cell factor - SCF), c-KIT için reseptör tirozin kinazların bir inhibitörüdür ve PDGF- ve SCF- tarafından yönlendirilen hücresel olaylarıinhibe eder. In vitroKronik Miyeloid Lösemide Klinik Çalışmalarİmatinibin etkinliği, bir bütün olarak elde edilen hematolojik ve sitogenetik yanıt oranlarını ve hastalıksız sağkalım süresini temel alır. Yeni tanı almış KML harici,hastalık ilişkili semptomların iyileşmesi veya sağkalım süresinin artması gibi klinikfaydaların olduğunu gösteren kontrollü çalışma yoktur. Bütün klinik çalışmalarda hastaların %38-40'ının en az 60, %10-12'sinin en az 70 yaşında olduğu bildirilmiştir. Kronik faz, yeni tanı konulmuş:Bu faz III çalışmasında, imatinib monoterapisi, interferon-alfa (IFN) + sitarabin (ARA-C) kombinasyonuyla karşılaştırılmıştır.Kullanılan tedaviye yanıt vermeyen hastaların, kullandıkları tedaviyi bırakarak diğertedaviyi kullanmalarına izin verilmiştir. İmatinib grubundaki hastalarda günde 400miligramlık doz kullanılmıştır. IFN grubundaki hastalar, hedef alınan günlük subkütanIFN dozu 5 MIU/m2 + her ayın 10 günü, günde 20 mg/m2 Ara-C kombinasyonukullanmıştır.16 ülkedeki 177 çalışma merkezinden toplam 1106 (her grupta 553) hasta, randomize edilmiştir. Yaşları 18-70 arasında değişmek üzere ortanca 51 olan hastaların%21,9'unun, 60 yaşında ya da daha ileri yaşta olduğu görülmüştür. Verilerin bu analizdekullanılmak üzere derlendiği sıradaki (son hastanın kaydedilmesinden 7 yıl sonra)ortanca ilk seçenek tedavi süresi imatinib grubunda 82, IFN (kombinasyon) grubunda 8aydır. İmatinib ile ortanca ikinci seçenek tedavi süresi 64 aydır. İmatinib grubunaayrılmış olan hastaların %60'ı, başlangıçta kullandıkları ilaca (imatinib) devametmektedir. Bu hastalarda ortalama imatinib dozu 403±57 mg'dir. Genel olarak, birinciseçenek olarak imatinib alan hastalarda dağıtılan ortalama günlük doz 406±76 mg'dır.IFN + ARA-C grubundaki hastaların yalnızca %2'si başlangıçta kullandıkları tedaviyedevam etmektedir. IFN + ARA-C grubunda başlangıçtaki tedaviye devam etmeyenhastalarda bunun en sık rastlanan nedeni (%14), hastaların verdikleri onayı geri çekmesi;imatinib grubuna geçenlerde ise buna en sık (hastaların %26'sında) yol açan neden,şiddetli intolerans ve hastalığın ilerlemesidir (%14). Primer bitiş noktası, hastalıksızsağkalım süresidir. Sekonder sonlanım noktalarının yanıt verileri de Tablo 2'degösterilmektedir. Belge Doama Kodu: lZW56aklUZlAxZlAxM0FySHY3M0FyQ3NR Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys
Birinci basamak tedavide tam hematolojik yanıt, majör sitogenetik yanıt ve tam sitogenetik yanıt oranları, son muayene tarihinde yanıtsızlıkların sansürlendiği Kaplan-Meier yaklaşımı kullanılarak hesaplanmıştır. Bu yaklaşım kullanıldığında, imatinib ilebirinci basamak tedavi için hesaplanan kümülatif yanıt oranları 12 aylık tedaviden 84aylık tedaviye şu şekilde düzelme göstermiştir: THY %96,4'ten %98,4'e ve TSY%69,5'ten %87,2'ye. 7 yıllık takipte, imatinib grubunda 93 (%16,8) olay olmuştur: 37 (%6,7) hızlanmış faz/blastik kriz (AF/BK) ilerleme, 31 (%5,6) major sitogenetik yanıt (MSY) kaybı, 15(%2,7) tam hematolojik yanıt (THY) kaybı ya da white blood cell (beyaz kan hücresi)(wBC) artışı ve 10 (%1,8) KML ile ilişkisiz ölüm. Buna karşılık IFN+Ara-C grubunda165 (%29,8) olay olmuş ve bunların 130'u birinci seçenek IFN+Ara-C tedavisi sırasındameydana gelmiştir. 84 ayda tahmin edilen progresyonsuz sağkalım imatinib grubunda %95 güven aralığı ile %81.2 (78, 85) ve kontrol grubunda %60.6 (56.5) olmuştur (p < 0.001). 84 ayda hızlanmış faza ya da blast krizine ilerleme olmayan hastaların tahmin edilen oranı, IFN grubu ile karşılaştırıldığında imatinib grubunda anlamlı düzeyde yüksekolmuştur (%85,1 (82,89) karşısında %92,5 (90,95), p <0,001). Yıllık progresyon hızıtedavide geçirilen süre ile birlikte azalmaktadır. 40 (%7,2) ölüm KML ile ilişkilendirilmiştir. Yalnızca KML ile ilişkili İmatinib ve IFN+Ara-C gruplarında, sırasıyla, toplam 71 (%12,8) ve 85 (%15,4) hasta ölmüştür. 84 ayda randomize imatinib ve IFN+Ara-C gruplarında tahmin edilen genelsağkalım, sırasıyla %86,4 (83, 90) ve %83,3 (80, 87) düzeyindedir (p=0.073, log-ranktesti). Buna ek olarak, 84 aylık verilere göre imatinib hastalarında yalnızca 31 (%5,6)ölüm (BMT öncesi) KML''fledfişk'lieWdiri'imişti'r.'®una'karşılık IFN+Ara-C hastalarında dikkate alınır ve BMT sonrası ya da diğer nedenlerle meydana gelen bütün ölümler sansürlenirse, tahmin edilen 84 aylık sağkalım oranları %93,6 ve %91,1 olmaktadır(p=0,1, log-rank testi). İmatinib tedavisinin kronik fazdaki, yeni tanı konulmuş KML'deki sağkalım etkisi, aynı rejimde IFN+Ara-C (n=325) kullanılan başka bir Faz III çalışmadan elde edilen birincilverilerle birlikte yukarıda belirtilen imatinib verilerinin retrospektif analizinde ayrıntılıolarak incelenmiştir. Bu yayında, genel sağkalım bakımından imatinibin IFN+Ara-Ckarşısındaki üstünlüğü kanıtlanmıştır (p<0,001); 42 ay içinde 47 (%8,5) imatinib hastasıve 63 (%19,4) IFN+Ara-C hastası ölmüştür. İmatinib tedavisindeki hastalarda sitogenetik yanıt ve moleküler yanıt derecesi, uzun dönem sonuçlar üzerinde açık bir etkiye sahip olmuştur. 12 ayda TSY'si (KSY) olanhastaların tahmini %96'sında (%93) akselere faza/blast krizine progresyon olmazken 12ayda MSY'si olmayan hastaların sadece %81'inde 84 ayda ilerlemiş KML'ye progresyonolmadığı görülmüştür (genel p<0,001, TSY ile KSY arasında p=0,25). 12 ayda Bcr-Abltranskriptlerinde en az 3 logaritmalık azalması olan hastalarda akselere faza/blast krizineprogresyonsuz kalma olasılığı 84 ayda %99 bulunmuştur. 18 aylık dönüm noktasıanalizine dayanılarak benzer bulgular tespit edilmiştir. Bu çalışmada günde 400 mg'dan 600 mg'a, ardından günde 600 mg'dan 800 mg'a doz artırımlarına izin verilmiştir. 42 aylık izlem sonrasında 11 hasta sitogenetik yanıtlarındadoanmış bir kayıp (4 hafta içinde) deneyimlemiştir. Bu 11 hastanın 4'ünde dozgünde 800 mg'a artırılmış olup hastaların 2'si sitogenetik yanıtı tekrar elde etmiş (1'indekısmi, 1'inde tam; tam yanıt elde eden ayrıca moleküler yanıta da ulaşmıştır), diğeryandan dozları artırılmayan 7 hastanın sadece biri tam sitogenetik yanıtı tekrar eldeetmiştir. Doz artırımı öncesindeki hasta popülasyonu (n=551) ile karşılaştırıldığında,dozun günde 800 mg'a yükseltildiği 40 hastada bazı advers reaksiyonların yüzdesi dahayüksek olmuştur. Daha sık görülen advers reaksiyonlar gastrointestinal hemorajileri,konjonktivit ve transaminazlar veya bilirubinde yükselmeyi içermiştir. Diğer adversolaylar daha düşük ya da eşit sıklıkla bildirilmiştir. Kronik faz, interferon tedavisinin başarısız kaldığı hastalar:532 hasta, 400 miligramlık başlangıç dozuyla tedavi edilmiştir. Bu hastalar; hematolojik başarısızlık (%29),sitogenetik başarısızlık (%35) veya interferon intoleransı (%36) olmak üzere başlıca 3gruba ayrılmıştır. Hastalar daha önce medyan 14 ay boyunca >25 x 106 lU/hafta dozlardaIFN tedavisi görmüştür ve hepsi de geç kronik fazdadır; tanıdan itibaren geçen medyansüre 32 aydır. Çalışmanın birincil etkililik değişkeni majör sitogenetik yanıt oranıdır(tam yanıt artı kısmı yanıt, kemik iliğinde %0 ila %35 Ph+ metafaz).Bu çalışmada hastaların %65'i bir majör sitogenetik yanıta ulaşmıştır; hastaların %53'ünde (doanmış %43) yanıt tamdır (Tablo 3). Hastaların %95'inde tamhematolojik yanıta ulaşılmıştır. Bu çalışmada hastaların %65'inde (%53'ü tam olmak üzere) majör sitogenetik yanıt elde edilmiştir. Hastaların %95'i bu tedaviye tam hematolojik yanıt vermiştir. Hızlanmış faz:Bu fazdaki 235 KML vakasanın ilk 77'sinde tedaviye günde 400 mg ile başlanmıştır; daha sonra çalışma protokolü, daha yüksek imatinib dozlarınınkullanılmasına olanak tanıyacak şekilde tadil edilmiştir ve geriye kalan 158 hasta,başlangıçta 600 mg imatinib kullanmıştır. İmza ile imzalanmıştır.
Tam hematolojik yanıt, hiçbir lösemi kanıtının mevcut olmaması (kemik iliğindeki ve kandaki blast hücrelerinin kaybolması, ancak periferik kan tablosunda, tam yanıt için gereken düzelmenin gerçekleşmemesi) veya kronik faz kronik miyeloid lösemiye dönüşolarak tanımlanan tam hematolojik yanıt ede edilme oranı, bu çalışmanın etkililikkonusundaki değerlendirilen primer parametresi olmuştur. Doanmış hematolojikyanıt, hastaların %71,5'inde elde edilmiştir. Bu hastalardan %27,7'sinde ayrıca majörsitogenetik yanıt (%20,4'ünde tam sitogenetik yanıt) alınmış olması önemlidir. 600 mgimatinib kullanan hastalarda bugünkü saptamalara göre tahmini ortanca medyanhastalıksız sağkalım ve genel sağkalım oranları, sırasıyla 22,9 ay ve 42,5 ay olarakhesaplanmıştır. Miyeloid blast krizi:Bu çalışma, blast krizi gelişmiş olan 260 hasta üzerinde yapılmıştır. Bu hastaların 95'i (%37'si), hızlanmış faz veya yine blast krizi nedeniyle daha önce dekemoterapi görmüştür (önceden tedavi edilmiş olan hastalar), 165 (%63) hastada isedaha önce kemoterapi uygulanmamıştır (önceden tedavi edilmemiş olan hastalar).Başlangıç dozu, ilk 37 hastada 400 miligramdı; daha sonra yapılan protokol tadilatı, dahayüksek dozların kullanılmasına olanak verdiğinden, diğer 223 hasta, başlangıçta 600 mgimatinib kullanmıştır.Primer etkililik parametresi, hızlanmış faz çalışmasında olduğu gibi yine tam hematolojik yanıt, lösemi kanıtının mevcut olmaması veya kronik faza dönüş olaraktanımlanan, hematolojik yanıt oranı olmuştur. Hastaların %31'inde hematolojik yanıtelde edilmiştir. 600 mg imatinib kullanan hastalardaki hematolojik yanıt oranı, 400 mgimatinib kullanmış olanlara kıyasla daha yüksektir (%16'ya karşılık %33, p=0,0220).Daha önceden tedavi edilmemiş ve tedavi edilmiş hastaların mevcut tahmini ortalamasağkalımı sırasıyla 7,7 ve 4,7 aydır. Lenfoid blast krizi:Tablo 3 KML vakalarında elde edilen yanıtlar
Pediyatrik hastalar:Kronik faz KML'si (n=11) veya blast krizi aşamasında KML'si ya da Ph+ akut lösemileri (n=15) olan, 18 yaş altı toplam 26 pediyatrik hasta bir faz I dozyükseltme çalışmasına kaydedilmiştir. Bu, yoğun ön tedavi görmüş hastalardan oluşanbir popülasyondur: hastaların %46'sı önceden BMT ve %73'ü önceden çoklu ajanlıkemoterapi görmüştür. Hastalar 260 mg/m2/gün (n=5), 340 mg/m2/gün (n=9), 440mg/m2/gün (n=7) ve 570 mg/m2/gün (n=5) imatinib dozları ile tedavi edilmiştir.Sitogenetik verileri mevcut olan 9 kronik faz KML hastasının 4'ünde (%44) ve 3'ünde(%33) sırasıyla tam ve kısmi sitojenik yanıt elde edilmiş olup bu oranlar %77 MCyRdeğeri ile sonuçlanmıştır.Yeni tanı almış ve tedavi edilmemiş, kronik fazda KML'si olan toplam 51 pediyatrik hasta açık-etiketli, çok merkezli, tek kollu bir faz II çalışmaya kaydedilmiştir. Hastalar340 mg/m2/gün imatinib ile tedavi edilmiş, doz sınırlayıcı toksisitesi hariç araverilmemiştir. İmatinib tedavisi yeni tanı konmuş pediyatrik KML hastalarında, 8haftalık tedavi sonrasında %78 CHR oranı ile hızlı yanıt sağlamaktadır. Yüksek CHRoranına, hastaların %65'inde tam sitojenik yanıt (CCyR) gelişimi eşlik etmiş olup buoran, erişkinlerde gözlenen sonuç ile karşılaştırılabilir niteliktedir. Ek olarak, hastaların%16'sında kısmı sitojenik yanıt (PCyR) gözlenmiş, bu da %81 MCyR değerini vermiştir.CCyR'ye ulaşan hastaların büyük çoğunluğu, Kaplan-Meier tahmine dayalı 5.6 aylıkyanıta kadar geçen medyan süre ile CCyR'ye 3 ila 10'uncu aylar arasında ulaşmıştır. Avrupa İlaç Ajansı, Philadelphia kromozomu (bcr-abl translokasyon) pozitif kronik faz kronik miyeloid lösemide pediyatrik popülasyonun tüm alt kümelerinde imatinib ileçalışmaların sonuçları sunma zorunluluğunu iptal etmiştir (pediyatrik kullanım ile ilgilibilgi için bkz. bölüm 4.2). Ph+ ALL için klinik çalışmalar Yeni teşhis edilen Ph+ ALL:Kontrol grubuna yer vererek yapılan ve imatinibin, 55 yaş ve üzeri yeni tanı almış 55 hastada kemoterapi indüksiyonuyla karşılaştırıldığı bir çalışmada (ADE10), tek ajanolarak kullanılan imatinib, kemoterapiye kıyasla anlamlı derecede daha yüksek tamhematolojik yanıt oranı ile sonuçlanmıştır (%50'ye karşılık %96,3, p=0,0001).Kemoterapiye yanıt vermeyen veya zayıf yanıt veren hastalarda imatinib kurtarmatedavisi olarak kullanıldığında, 11 hastanın 9'unda (%81,8) tam hematolojik yanıt eldeedilmiştir. Bu klinik etki, 2 haftalık tedaviden sonra, kemoterapi kolu ilekarşılaştırıldığında imatinib ile tedavi edilen hastalarda, bcr-abl transkriptlerinde dahabüyük bir azalmayla ilişkilendirilmiştir (p=0,02). Tüm hastalar indüksiyon sonrasındaimatinib ve konsolidasyon kemoterapisi almış (bkz. Tablo 4) ve bcr-abl transkriptlerinindüzeyleri sekizinci haftada iki kolda aynı olmuştur. Çalışma tasarımı dotusundabeklendiği üzere, iki grup arasında remisyon süresi, hastalıksız sağkalım veya genelsağkalım açısından herhangi bir fark gözlenmemiş, ancak tam moleküler yanıt eldeedilen ve minimal rezidüel hastalık düzeyinde kalan hastalarda gerek remisyon süresi(p=0.01) gerekse hastalıksız sağkalım (p=0,02) bakımından sonuçlar daha iyi olmuştur. Kontrol gruplarına yer verilmeyen dört klinik çalışmada (AAU02, ADE04, AJP01 ve AUS01) yeni tanı almış 211 Ph+ ALL hastasından oluşan bir popülasyonda gözlenensonuçlar, yukarıda tarif edilen sonuçlar ile uyumludur. Kemoterapi indüksiyonu ilekombinasyon halindeki imatinib (bkz. Tablo 4) %93'lük bir tam hematolojik yanıt oranı(değerlendirilebilir 158 ıhastanme147e'sj<)niv&z%ı90'lıkmbıirır.majör sitogenetik yanıt oranıBelge Do Kontrol gruplarına yer verilmeyen dört klinik çalışmada (AAU02, ADE04, AJP01 ve AUS01) yeni tanı almış 211 Ph+ ALL hastasından oluşan bir popülasyonda gözlenensonuçlar, yukarıda tarif edilen sonuçlar ile uyumludur. Kemoterapi indüksiyonu ilekombinasyon halindeki imatinib (bkz. Tablo 4) %93'lük bir tam hematolojik yanıt oranı(değerlendirilebilir 158 ıhastanme147e'sj<)niv&z%ı90'lıkmbıirır.majör sitogenetik yanıt oranıBelge DoImatinible kombinasyon halinde kullanılan kemoterapi rejimi
Pediyatrik hastalar:Nüksetmiş/tedaviye dirençli Ph+ ALLİmatinib, yineleyen/refraktör Ph+ ALL hastalarında tek ajan olarak kullanıldığında, 411 hastanın 53'ünde yanıt değerlendirilebilmiş, hematolojik yanıt oranı %30 (%9'u tam) vemajör sitogenetik yanıt oranı ise %23 olarak bulunmuştur (Not: 411 hastanın 353'ü,primer yanıt verileri toplanmaksızın genişletilmiş erişim çalışmasında tedavi edilmiştir).411 yineleyen/refraktör Ph+ ALL hastasından oluşan toplam popülasyonda progresyonakadar geçen medyan süre 2,6 ile 3,1 ay aralığında olurken, değerlendirilebilir 401hastada medyan genel sağkalım 4.9 ile 9 ay aralığında bulunmuştur. Bu veriler, sadece55 yaş ve üzeri hastalar dahil edilecek şekilde yeniden analiz yapıldığında da benzerolmuştur. SM ile İlgili Klinik ÇalışmalarABL, KIT ya da PDGFR protein tirozin kinazlarla ilişkili yaşamı tehdit edici hastalıkları olan farklı hasta popülasyonlarında imatinibin test edildiği açık-etiketli, çok merkezli birfaz II klinik çalışma (çalışma B2225) yürütülmüştür. Bu çalışmada tedavi edilen ve45'inde hematolojik hastalıklar, 140'ında da çeşitli solid tümörler bulunan 185 hastadan5'inde SM saptanmıştır. SM hastaları günlük 100 mg ila 400 mg imatinib ile tedaviedilmiştir. Yayınlanmış 10 vaka raporu ve vaka serisinde, yaşları 26 ila 85 arasındadeğişen 25 SM hastası daha bildirilmiştir. Bu hastalara da günlük 100 mg ila 400 mgdozda imatinib uygulanmıştır. SM için tedavi edilen toplam popülasyonun (30 hasta)10'unda (%33) tam hematolojik yanıt, 9'unda (%30) kısmi hematolojik yanıt eldeedilmiştir (toplam yanıt oranı %63). Sitogenetik anormallikler yayınlanmış raporlarda veçalışma B2225'te tedavi edilen 30 hastanın 21'inde değerlendirilmiştir. Bu 21 hastanınsekizinde FIP1L1-PDGFR-alfa füzyon kinaz saptanmıştır. Çalışma B2225'te tedaviedilen hastalarda ortanca medyan tedavi süresi 13 ay olmuş (aralık: 1,4-22,3 ay),yayınlanmış literatürde yanıt veren hastalarda ise aralık 1 ay ila 30 ayın üzerinde bir sürearasında değişmiştir. HES ile İlgili Klinik ÇalışmalarABL, KIT ya da PDGFR protein tirozin kinazlarla ilişkili yaşamı tehdit edici hastalıkları olan farklı hasta popülasyonlarında imatinibin test edildiği açık-etiketli, çok merkezli birfaz II klinik çalışma (çalışma B2225) yürütülmüştür. Bu çalışmada, toplam 185 hastadan(45'i hematolojik hastalık, 140'ında çeşitli solid tümörler saptanmıştır) HES'i olan 14hasta günde 100 mg ila 1000 mg dozda imatinib ile tedavi edilmiştir. Yayınlanmış 35vaka raporu ve vaka serisinde, HES'i olan ve yaşları 11 ila 78 arasında değişen 162 hastadaha bildirilmiştir. Bu hastalara, günde 75 mg ila 800 mg dozda imatinib verilmiştir.HES için tedavi edilen toplam popülasyonun (176 hasta) 107'sinde (%61) tamhematolojik yanıt, 16'sında ise (%9) kısmi hematolojik yanıt elde edilmiştir (toplamyanıt oranı %70). Yayınlanmış raporlarda ve çalışma B2225'te, tedavi edilen 176hastadan 117'sinde sitogenetik anormallikler değerlendirilmiştir. Bu 117 hastanın 61'i,FIP1L1-PDGFR-alfa füzyon kinaz pozitif bulunmuştur. Tüm bu FIP1L1-PDGFR- alfafüzyon kinaz pozitif hastalarda, tam hematolojik yanıt elde edilmiştir. 115 hastadaFIP1L1-PDGFR- alfa füzyon ya negatif bulunmuştur ya da bilinmemektedir. Bunların62'sinde (%54) ya tam (n=46) ya da kısmi (n=16) hematolojik yanıt elde edilmiştir.Ayrıca, vaka raporlarında araştırmacılar tarafından, semptomatoloji ve diğer organfonksiyon bozukluğu anormalliklerinde iyileşmeler bildirilmiştir. Kalp, sinir, cilt/ciltaltıdokusu, solunum/toraks/mediasten, kas-iskelet/bağ dokusu/vasküler ve gastrointestinalorgan sistemlerinde iyileşmeler bildirilmiştir. Rezeke edilemeyen ya da metastatik GIST'de yapılan klinik çalışmalarRezektabl olmayan veya metastatik malign gastrointestinal stromal tümörleri (GIST) olan hastalarda faz II, açık etiketli, randomize, kontrolsüz çok uluslu bir çalışmayürütülmüştür. Bu çalışmaya 147 hasta kaydedilmiş ve 36 ay boyunca günde bir kez oralolarak 400 mg veya 600 mg kullanımına randomize edilmiştir. Bu hastalar 18 ila 63yaşında olup, rezektabl olmayan ve/veya metastatik Kit-pozitif malign GIST patolojiktanısına sahiptir. İmmünohistokimya Kit antikoru ile (A-4502, tavşan poliklonalantiserumu, 1:100; DAKO Corporation, Carpinteria, CA) antijen geri kazanımı sonrasıavidin-biotin-peroksidaz kompleksi yöntemi ile analize göre rutin olarak yürütülmüştür. Birincil etkililik kanıtı objektif yanıt oranlarını temel almıştır. Tümörlerin en az bir hastalık bölgesinde ölçülebilir olması gerekmiş olup, yanıt karakterizasyonu GüneybatıOnkoloji Grubu (SWOG) kriterlerini temel almıştır. Bulgular Tablo 5'te sunulmaktadır. Tablo 5
İki doz grubu arasında yanıt oranları bakımından farklılıklar söz konusu olmamıştır. Ara analiz tarihinde önemli sayıda stabil hastalığa sahip hasta, daha uzun süreli tedavi ilekısmi yanıta ulaşmıştır (medyan takip süresi 31 ay). Yanıta kadar geçen medyan süre 13hafta olmuştur (%95 GA 12-23)., Yanıt . .veren olgularda tedavi başarısızlığına kadar Belge Doalgeeenımgdyâfi ıgürexi2.2ifı(%95yGAı 106-147ı), seneAdçâJ:ışma,popülasyon«'ada-i§e-84's hafta (%95 GA 71-109) bulunmuştur. Medyan genel sağkalım noktasına ulaşılamamıştır.KML hastalarında kas iskelet aısı ve ilişkili olaylar GIST hastalarından çok daha sık gözlemlenmiştir. İleri evrede hastalığı, ağır enfeksiyonları, şiddetli nötropenisi ve diğer ciddi eşlik eden rahatsızlıklarıolan hastalarda fatal vakalar bildirilmiştir.Belge Doama Kodu: lZW56aklUZlAxZlAxM0FySHY3M0FyQ3NR Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebysİki klinik çalışmada (çalışma B2222 ve gruplar arası çalışma S0033), günlük imatinib dozu, 400 mg veya 600 mg daha düşük günlük dozlarında progrese olan hastalarda 800mg'a yükseltilmiştir. Doz, toplam 103 hastada 800 mg'a çıkarılmıştır; dozyükseltildikten sonra 6 hasta kısmi yanıta ve 21 hasta hastalık stabilizasyonuna ulaşarak%26'lık genel klinik yanıt sonucunu vermiştir. Eldeki güvenlilik verilerinden yolaçıkılarak, 400 mg veya 600 mg daha düşük günlük dozlarında progrese olan hastalardadozun günde 800 mg'a çıkarılmasının, imatinibin güvenlilik profilini etkilemediğigörülmektedir. Adjuvan GIST için klinik çalışmalarAdjuvan tedavi koşullarında imatinib, 773 hasta ile yürütülen çok merkezli, çift kör, uzun süreli, plasebo kontrollü bir faz III çalışmada (Z9001) araştırılmıştır. Bu hastalarınyaşları 18-91 aralığında olmuştur. İmmünhistokimya ile KIT proteini eksprese edenprimer GIST yönünde histolojik tanısı bulunan ve en geniş yerinde >3 mm tümörbüyüklüğüne sahip olan, çalışmaya kayıt öncesindeki 14-70 gün içersinde primer GIST'itam gross rezeksiyon ile alınan hastalar dahil edilmiştir. Primer GIST rezeke edildiktensonra hastalar şu iki koldan birine randomize edilmiştir: bir yıl süreyle imatinib 400mg/gün veya plasebo. Çalışmanın birincil sonlanma noktası, randomizasyon tarihinden rekürense ya da herhangi bir nedene bağlı ölüme kadar geçen süre şeklinde tanımlanan rekürenssizsağkalım (RFS) olmuştur. İmatinib RFS'de anlamlı uzama sağlamış, imatinib grubunda hastaların %75'i 38. ayda rekürenssiz iken plasebo grubundaki hastaların %75'i 20. ayda rekürenssiz kalmıştır(sırasıyla %95 GA [30-hesaplanamaz]; [14-hesaplanamaz]); (tehlike oranı = 0,398[0,259-0,610], p<0,0001). Bir yıl sonunda genel RFS, plasebo (%82,3) karşısındaimatinib için anlamlı düzeyde daha iyi bulunmuştur (%97,7) (p<0,0001). Bu şekilderekürens riski plaseboya oranla %89 azaltılmıştır (tehlike oranı = 0,113 [0,049-0,264]). Primer GIST'lerine yönelik ameliyatları sonrasında hastalardaki rekürens riski, şu prognoz faktörleri esas alınarak retrospektif şekilde değerlendirilmiştir: tümörbüyüklüğü, mitotik indeks, tümör yeri. Mitotik indeks verileri, tedavi amaçlı (ITT)popülasyonu oluşturan 713 hastanın 556'sı için mevcut idi. Birleşik Devletler UlusalSağlık Enstitüleri (NIH) ve Silahlı Kuvvetler Patoloji Enstitüsü (AFIP) risksınıflandırmalarına göre yapılan alt grup analizlerinin sonuçları Tablo 6'dagösterilmektedir. Düşük ve çok düşük risk gruplarında herhangi bir faydagözlenmemiştir. Genel bir sağkalım faydası gözlenmemiştir. Belge Doama Kodu: lZW56aklUZlAxZlAxM0FySHY3M0FyQ3NR Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys
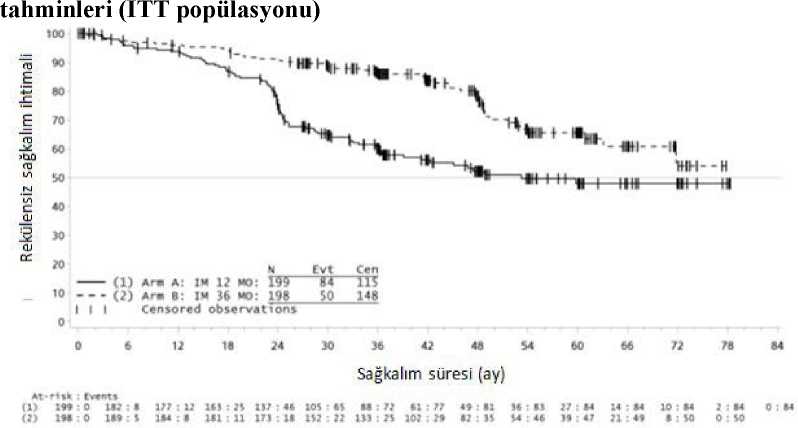
*Full takip periyodu- NE-Tahmin edilebilir değil İkinci bir çok merkezli, açık etiketli faz III çalışmada (SSG XV ni/AIO), cerrahi GIST rezeksiyonu sonrasında olan ve aşağıdaki durumlardan birinin bulunduğu hastalarda 400mg/gün imatinib ile 36 ay karşısında 12 aylık tedavi karşılaştırılmıştır: tümör çapı > 5cm ve mitotik sayım > 5/50 yüksek güç alanı (HPF); veya tümör çapı > 10 cm veherhangi bir mitotik sayım veya mitotik sayımı > 10/50 HPF olan herhangi birbüyüklükteki tümör ya da periton boşluğuna dou rüptüre olan tümörler. Toplam 397hastadan olur alınmış ve bu hastalar çalışmaya randomize edilmiştir (199 hasta 12 aykolunda ve 198 hasta 36 ay kolunda) medyan yaş 61 idi [aralık 22 ila 84 yaş]). Medyantakip süresi 54 ay olup (randomizasyondan veri kesme tarihine kadar) ilk hastanınrandomize edilişinden veri kesme tarihine kadar geçen medyan süre 83 aydır.Çalışmanın birincil sonlanma noktası, randomizasyon tarihinden nükse ya da herhangi bir nedene bağlı ölüme kadar geçen süre şeklinde tanımlanan nükssüz sağkalım (RFS)olmuştur. 36 aylık imatinib tedavisi, 12 aylık imatinib tedavisi ile karşılaştırıldığında RFS'de anlamlı ölçüde uzama sağlamıştır (genel tehlike oranı (HR) = 0,46 [0,32, 0,65],p<0,0001) (Tablo 7, Şekil 1). Buna ek olarak, 36 aylık imatinib tedavisi, 12 aylık imatinib tedavisi ile karşılaştırıldığında genel sağkalım (OS) süresini anlamlı ölçüde uzatmıştır (HR = 0,45[0,22, 0,89], p=0,0187) (Tablo 7, şekil 2). Daha uzun süreli tedavi (> 36 ay) yeni rekürenslerin oluşumunu geciktirebilmektedir; ancak, bu bulgunun genel sağkalım üzerindeki etkisi halen bilinmemektedir. Toplam ölüm sayısı 12 aylık tedavi kolu için 25 ve 36 aylık tedavi kolu için 12 şeklinde olmuştur. Belge Doma Kodu: lZW56aklUZl AxZl AxM0FySHY3M0FyQ3NR Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebysİmatinib ile 36 ay süreli tedavi, ITT analizinde, yani tüm çalışma popülasyonun dahil edildiği analizde, 12 aylık tedaviden daha üstün bulunmuştur. Mutasyon tipine göre yapılan planlı bir alt grup analizinde, ekson 11 mutasyonları olan hastalarda 36 aylıktedavide RFS için tehlike oranı 0.35 olmuştur [%95 GA: 0.22, 0.56]. Gözlemlenen olay sayısının düşük olması sebebiyle, daha az yaygın olan mutasyon alt grupları için herhangi bir sonuç çıkartılamamaktadır. 12 aylık ve 36 aylık İmatinib Tedavisi (SSGXVIII/AI0 Çalışması)Tablo 7
 Şekil 2Genel sağkalım için Kaplan-Meier tahminleri (ITT popülasyonu)Karaciğer yetersizliği olan hastalarda yapılan klinik çalışmalarÇeşitli derecelerde (hafif, orta şiddette veya şiddetli; karaciğer fonksiyon bozukluğunun sınıflandırılması için bkz. Tablo 8) karaciğer yetersizliği olan hastalarda yapılan birçalışmada imatinibe ortalama maruz kalım (doza göre normalize edilmiş EAA değeri),karaciğer fonksiyonu normal olan hastalara kıyasla artmamıştır. Bu çalışma sırasındahafif karaciğer bozukluğu olan hastalarda günde 500 mg, diğer hastalarda günde 300 mgimatinib, güvenle kullanılmıştır. Orta-ileri derecede şiddetli karaciğer yetersizliği olanhastalarda yalnızca 300 miligramlık doz kullanılmıştır ama farmakokinetik analiz bunun,400 miligramla güvenle yükseltilebileceğini göstermiştir (bkz. bölüm 4.2, 4.4, 4.8 ve5.2)
Böbrek yetmezliği olan hastalarda yürütülen klinik çalışmalarDeğişen derecelerde (hafif, orta ve şiddetli - böbrek fonksiyonu sınıflandırması için bkz. aşağıda Tablo 9) böbrek yetmezliği olan hastalarla yürütülen bir çalışmada, maruzkalınan ortalama imatinib (doz normalize EAA), böbrek fonksiyonları normal olanhastalarla karşılaştırıldığında 1,5-2 kat artmıştır, bu da, imatinibin güçlü bir biçimdebağlandığı bir protein olan AGP'nin plazma düzeyinde benzer bir artışa karşılık gelir.Maruz kalınan imatinib ile böbrek bozukluğunun şiddeti arasında bir hiçbir korelasyongözlemlenmemiştir. Bu çalışmada, hafif böbrek yetmezliği olan hastalarda günlük 800mg ve orta düzeyde böbrek yetmezliği olan hastalarda günlük 600 mg güvenlekullanılmıştır. Sınırlı sayıda hasta kaydedildiği için orta düzeyde böbrek yetmezliği olanhastalarda günlük 800 mg dozu test edilmemiştir. Aynı şekilde, şiddetli böbrekyetmezliği olan yalnızca 2 hasta düşük (100 mg) doza kaydedilmiş ve daha yüksekdozların hiçbiri test edilmemiştir. Çalışmaya hiçbir hemodiyaliz hastasıkaydedilmemiştir. Literatür verileri, son evre böbrek hastalığı olan ve hemodiyalizuygulanan bir kişide günlük 400 mg dozun çok iyi tolere edildiğini göstermiştir. Diyaliz,imatinibin plazma kinetiklerini engellememiştir. Böbrekler yoluyla atılım imatinib içinminör bir eliminasyon yolu olduğundan, şiddetli böbrek yetmezliği olan ve diyalizuygulanan hastalara 400 mg'lik başlangıç dozu ile tedavi uygulanabilmektedir. Ancak,bu hastalarda dikkatli olunması önerilmektedir. Tolere edilememesi halinde dozazaltılabilir ya da etki görülmemesi halinde doz artırabilir arttırılabilir (bkz. bölüm 4.2,4.4 ve 5.2).
5.2. Farmakokinetik özelliklerGenel özelliklerİmatinibin farmakokinetiği 25 - 1000 mg'lık bir doz aralığında değerlendirilmiştir. Plazma farmakokinetik profilleri 1. günde ve plazmada kararlı düzeylerin elde edildiği 7.ya da 28. günde analiz edilmiştir. Emilim:Tablet formülünün ortalama mutlak biyoyararlanımı %98'dir. Bir oral dozu takiben plazma imatinib ei altında kalan alan (EAA) değerlerinde, yüksek oranda hastalar arasıdeğişkenlik (%40-60) görülmüştür. Yüksek yağ içeren bir gıda ile birlikte verildiğinde,imatinibin emilim oranı minimal düzeyde azalmış (Cmaks'da %11 azalma ve tmaks'da 1,5saatlik uzama), açlık koşullarına göre EAA değerinde küçük bir azalma (%7,4) olmuştur. Dağılım:Klinik açıdan uygun konsantrasyonlarda kullanılan imatinibin plazma proteinlerine bağlanması yaklaşık %95 olmuş, in vitrodeneyler temelinde, daha çok albümin ve alfa-asit-glikoproteine, az miktarda da lipoproteine bağlanmıştır.Biyotransformasyon:İnsanlarda, dolaşımdaki temel metaboliti ana ilaç ile in vitrobenzer etki gücünde (potens) olduğu gösterilmiş N-demetillenmiş piperazin (CGP71588) türevidir. Bumetabolitin plazma EAA değerinin imatinibin EAA değerinin sadece %16'sı olduğubulunmuştur.N-demetile metabolitin plazma proteinlerine bağlanması, asıl bileşiğinkinebenzerdir.İmatinib ve N-demetil metaboliti birlikte, dolaşımdaki radyoaktivitenin yaklaşık %65'ini oluşturmuştur (EAA (0-48saat)). Dolaşımdaki radyoaktivitenin kalan kısmı bir diziminör metabolitten oluşmuştur. İn vitrosonuçlar CYP3A4'ün, imatinib biyotransformasyonunu katalize eden başlıca P450 enzimi olduğunu göstermiştir. Potansiyel eşzamanlı ilaçlardan (asetaminofen,asiklovir, allopurinol, amfoterisin, sitarabin, eritromisin, flulonazol, hidroksiüre,norfloksasin, penisilin V) oluşan bir panelde sadece eritromisin (IC50 50 ^M) veflukonazol (IC50 118 ^M) imatinib metabolizmasında klinik açıdan anlamlı olabilecekinhibisyon göstermiştir.İn vitrokoşullarda imatinibin CYP2C9, CYP2D6 ve CYP3A4/5'in markör substratlarının kompetitif bir inhibitörü olduğu gösterilmiştir. İnsan karaciğerimikrozomlarında Ki değerleri sırasıyla 27, 7,5 ve 7,9 ^mol/l bulunmuştur. Hastalardaimatinibin maksimal plazma konsantrasyonları 2-4 ^mol/l'dir, dolayısıyla bir aradauygulanan ilaçların CYP2D6 ve/veya CYP3A4/5 aracılı metabolizmasında inhibisyonolasıdır. İmatinib, 5-fluorourasil biyotransformasyonuna müdahale etmemiştir fakatkompetitif CYP2C8 inhibisyonu (Ki = 34,7 ^M) sonucu paklitaksel metabolizmasınıinhibe etmiştir. Bu Ki değeri, hastalarda beklenen imatinib plazma düzeylerinin çoküzerindedir, dolayısıyla 5-fluorourasil ya da paklitakselin imatinib ile bir aradauygulanması sonucu herhangi bir etkileşim beklenmemektedir.Eliminasyon:İmatinibin 14C-işaretli tek oral dozundan sonra, dozun yaklaşık %81'i 7 gün içinde feçesle (dozun %68'i) veJds|rlaXdezufto%^ı3'ü)eiitrâhedilmiştir. Değişmemiş durumdaki Belge DoDousallık / dousal olmayan durum:Sağlıklı gönüllülerde oral uygulamanın ardından, imatinibin t^ değeri yaklaşık 18 saat olması günde tek doz şeklindeki pozolojinin uygun olduğu izlenimini vermektedir. Oralolarak 25-1000 mg imatinib uygulandıktan sonra artan dozla birlikte ortalama EAA artışıdousal bir seyir izlemiştir. Tekrarlanan dozlarda imatinib kinetiğinde değişiklikolmamış ve günde bir kez uygulandığında birikim, kararlı ilaç konsantrasyonunun 1,52,5 katı olmuştur. Farmakokinetik / farmakodinamik ilişkiler:Popülasyon farmakokinetiğiKML hastalarındaki popülasyon farmakokinetiği analizlerine göre yaşın dağılım hacmi üzerinde küçük bir etkisi olmuştur (>65 yaşındaki hastalarda %12 artış). Bu değişiminklinik açıdan anlamlı olmadığı düşünülmüştür. Vücut ağırlığının imatinib klirensiüzerindeki etkisine bakıldığında, 50 kg ağırlığındaki bir kişide klirensin 8,5 l/s, olmasıbeklenirken, 100 kg ağırlığındaki bir kişideki klirens 11,8 l/s'e yükselmektedir. Budeğişiklikler vücut ağırlığına göre bir doz ayarlaması yapılması için yeterli olarak kabuledilmemiştir. Cinsiyetin imatinib kinetiği üzerinde etkisi olmamıştır. GIST hastalarında farmakokinetikGIST hastalarında kararlı durum maruziyeti, aynı dozajda (400 mg/gün) KML hastaları için gözlenenden 1,5 kat daha yüksek olmuştur. GIST hastalarındaki ön popülasyonfarmakokinetiği analizine dayalı olarak, üç değişkenin (albümin, WBC ve bilirubin)imatinib farmakokinetiği ile anlamlı ilişkiye sahip olduğu bulunmuştur. Daha düşükalbümin değerleri daha düşük klirense (CL/f) sebep olmuş ve daha yüksek WBCdüzeyleri CL/f azalmasına neden olmuştur. Ancak bu ilişkiler, doz ayarlamasınıgerektirecek ölçüde anlamlı şekilde ön plana çıkmamıştır. Bu hasta popülasyonundahepatik metastazların varlığı potansiyel olarak karaciğer yetmezliğine ve azalmışmetabolizmaya yol açabilir. Çocuklarda farmakokinetikBir Faz I ve Faz II çalışmasında oral imatinib, pediyatrik hastalarda da, erişkin hastalardaki gibi hızla emilmiştir. Çocuklarda 260 ve 340 mg/m2 imatinible elde edilenEAA değerleri, erişkinlerde sırasıyla 400 ve 600 mg imatinible elde edilenler gibidir. 340mg/m2 imatinibin birinci ve sekizinci günlerdeki EAA(0-24 saat) değerleri bu ilacın,tekrarlanan dozlardan sonra 1.7 kat biriktiğini göstermiştir. Hematolojik bozuklukları (KML, Ph+ALL ya da imatinib ile tedavi edilen diğer hematolojik bozukluklar) olan pediyatrik hastalarda birleştirilmiş popülasyonfarmakokinetiği analizine dayalı olarak imatinib klirensi vücut yüzey alanının (VYA)artmasına paralel olarak yükselmektedir. VYA etkisi için düzeltme yapıldıktan sonra,yaş, vücut ağırlığı ve vücut kitle indeksi gibi diğer demografik faktörler imatinibmaruziyeti üzerinde klinik açıdan anlamlı etkiler yapmamıştır. Yapılan analiz, günde birkere 260 mg/m2 (günde 400 mg'ı geçmemek üzere) ya da günde bir kere 340 mg/m2 alan(günde 600 mg'ı geçmemek üzere) pediyatrik hastalarda imatinib maruziyetinin, gündebir kere 400 mg ya da 600 mg imatinib alan yetişkin hastalardakine benzer olduğunudoamıştır. Organ fonksiyonu bozukluğuİmatinib ve metabolitleri böbrek yoluyla anlamlı miktarda atılmaz. Böbrek ^ ,1 1 r» r* Bu belge, güvenli elektronik İmza-İİ£ İmzalanmıştır.- ı ı ı r* ı ıfonksiyonlarında hafif ve orta şiddette bozukluk olan hastalar, böbrek fonksiyonları normal hastalardan daha yüksek plazma değerlerine sahip görünmektedir. Artış yaklaşıkolarak 1,5-2 kattır ve imatinibin güçlü bir biçimde bağlandığı plazma alfa asitglikoprotein (AGP) değerinde 1,5 katlık bir artışa karşılık gelir. Böbrek bozukluğu olanhastalarda imatinibin serbest ilaç klirensi muhtemelen böbrek fonksiyonları normalhastalardakinin bir benzeridir çünkü böbrekler yoluyla atılım imatinib için minör bireliminasyon yolunu oluşturmaktadır (bkz. bölüm 4.2, 4.4 ve 5.1). Farmakokinetik analiz sonuçlarının kişiden kişiye değişikliklerin söz konusu olduğunu göstermesine rağmen, değişik derecelerde karaciğer yetersizliği olan hastalardakiimatinibe ortalama maruz kalım, karaciğer fonksiyonları normal olan hastalara kıyaslayükselmemiştir (bkz. bölüm 4.2, 4.4, 4.8, 5.1 ve 5.2) 5.3. Klinik öncesi güvenlilik verileriİmatinibin klinik öncesi güvenliliği sıçanlarda, köpeklerde, maymunlarda ve tavşanlarda değerlendirilmiştir. Çoklu doz toksisite çalışmaları sıçanlarda, köpeklerde ve maymunlarda hafif ile orta dereceli hematolojik değişiklikler ortaya koymuş, sıçanlarda ve köpeklerde budeğişikliklere kemik iliği değişiklikleri eşlik etmiştir. Karaciğer, sıçanlarda ve köpeklerde hedef organ olmuştur. İki türde de transaminazlarda hafif ila orta dereceli artışlar ve kolesterol, trigliseritler, total protein ve albümindüzeylerinde hafif düşüşler gözlenmiştir. Sıçan karaciğerinde herhangi bir değişiklikgörülmemiştir. İki hafta süreyle tedavi edilen köpeklerde yükselmiş karaciğer enzimleri,hepatoselüler nekroz, safra kanalı nekrozu ve safra kanalı hiperplazisi ile şiddetlikaraciğer toksisitesi gözlenmiştir. İki hafta süreyle tedavi edilen maymunlarda fokal mineralizasyon ve renal tübüllerin dilatasyonu ve tübüler nekroz ile renal toksisite gözlenmiştir. Bu hayvanların birkaçındakan üre azotunda (BUN) ve kreatininde artış gözlenmiştir. 13 haftalık çalışmadasıçanlarda >6 mg/kg dozlarda serum veya idrar parametrelerinde değişiklikler olmaksızınmesane ve renal papilla transisyonel epitelyum hiperplazisi gözlenmiştir. Kronikimatinib tedavisi ile fırsatçı enfeksiyonların oranında artış gözlenmiştir. 39 haftalık maymun çalışmasında NOAEL (advers etkinin görülmediği düzey), 15 mg/kg olan en düşük dozda saptanmış olup bu doz, beden yüzeyi bazında 800 mg'lıkmaksimum insan dozunun yaklaşık üçte biridir. Tedavi, bu hayvanlarda normaldebaskılanmış olan malaryal enfeksiyonlarda kötüleşme ile sonuçlanmıştır. İmatinib, bir in vitroin vitroin vivoin vitromemeli hücre testinde (Çin hamsterı overi)imatinib için pozitif genotoksik etkiler elde edilmiştir. Üretim prosesinin, son üründe debulunan iki ara ürünü Ames testinde mutajenisite açısından pozitiftir. Bu ara ürünlerdenbiri ayrıca fare lenfoma testinde de pozitif sonuç vermiştir.Bir fertilite çalışmasında çiftleşmeden önce 70 gün süreyle dozlar uygulanan erkek sıçanlarda testiküler ve epididimal ağırlıklar ve hareketli sperm yüzdesi, beden yüzeyalanı bazında 800 mg/gün maksimum klinik dozu ile yaklaşık olarak eşit olan 60 mg/kgdozunda azalmıştır. Bu etkie^20ms/kgtdözlarda gfiSülfflemiştir. Köpekte >30 mg/kg oralBelge Do düzeyinin yaklaşık 0,3 ila 2katı düzeylerde, büyüme üzerinde geçici etkiler ve vaginal açılma ve prepusyal ayrılmadagecikme gözlenmiştir. Ayrıca, ortalama pediyatrik maruziyet olarak önerilen en yüksekdoz olan 340 mg/m2 düzeyinin yaklaşık 2 katı düzeylerde, juvenil hayvanlarda (yaklaşıkolarak sütten kesilme döneminde) mortalite gözlemlenmiştir. 2 yıllık sıçan karsinojenisite çalışmasında 15, 30 ve 60 mg/kg/gün olarak imatinib uygulanması, erkeklerde 60 mg/kg/gün dozunda ve dişilerde >30 mg/kg/gün dozundayaşam süresi üzerinde istatistiksel açıdan anlamlı azalmaya neden olmuştur. Ölenlerdeyapılan histopatolojik inceleme, ölümün temel nedeni ya da öldürülme nedeni olarakkardiyomiyopati (her iki cinsiyet), kronik ilerleyici nefropati (dişiler) ve prepusyal bezpapillomunu ortaya koymuştur. Neoplastik değişiklikler açısından hedef organlarböbrekler, mesane, üretra, prepusyal ve klitoral bez, ince bağırsak, paratiroid bezleri,adrenal bezler ve glandüler-olmayan mide olmuştur. Prepusyal/klitoral bezde papilloma/karsinoma sırasıyla 400 mg/gün veya 800 mg/gün dozlarında insan günlük maruziyetinin 0,5 veya 0,3 katına (EAA bazında) ya daçocuklarda 340 mg/m2/gün dozunda günlük maruziyetin 0.4 katına karşılık gelen (EAAbazında) 30 mg/kg/gün dozundan itibaren gözlenmiştir. Etki gözlenmeyen düzey(NOEL) 15 mg/kg/gün olmuştur. 400 mg/gün veya 800 mg/gün dozlarında insan günlükmaruziyetinin sırasıyla 1,7 veya 1 katına (EAA bazında) ya da çocuklarda 340mg/m2/gün dozunda günlük maruziyetin 1,2 katına karşılık gelen (EAA bazında) 60mg/kg/gün dozunda renal adenoma/karsinoma, mesane ve üretra papilloması, incebağırsak adenokarsinomaları, paratiroit bezleri adenomaları, adrenal bezlerde benign vemalign medüller tümörler ve glandüler olmayan mide papillomaları/karsinomalarıgörülmüştür. Etki gözlenmeyen düzey (NOEL) 30 mg/kg/gün olmuştur. Sıçan karsinojenisite çaJişmaJirısdankteldAmedilefflzahumbttlguların insanlar için anlamı bilinmemektedir. Erken dönem klinik çalışmalarda tanımlanmayan non-neoplastik lezyonlar kardiyovasküler sistem, pankreas, endokrin organlar ve dişlerle ilgili olmuştur. Enönemli değişiklikler bazı hayvanlarda kalp yetmezliği belirtilerine yol açan kardiyakhipertrofi ve dilatasyonu içermiştir. Etkin madde imatinib, tortul tabaka organizmaları için çevresel risk oluştur. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiPharmaburst 500 (mannitol,krospovidon, sorbitol,maltitol,silikon dioksit ve kopovidon) Povidon K30 (PVP K30) Magnezyum stearatFilm KaplamaOpadry KB Low viscosity White 310A180023(Makragol (PEG)Polivinilalkol graft kopolimeri, Titanyumdioksit, Kaolin, Kopolividon, Sodyumlauril sülfat) Opadry KB Low viscosity Yellow 310A120019(Makragol (PEG)Polivinilalkol graft kopolimeri, Kaolin,Sarı demir oksit, Titanyumdioksit, Kopolividon, Sodyumlauril sülfat) Opadry KB Low viscosity Red 310A150004(Makragol (PEG) Polivinil alkol graft kopolimeri, Kaolin, Kırmızı demir oksit, Titanyumdioksit, Kopolividon, Sodyumlauril sülfat) Opadry KB Low viscosity Black 310A177002(Makragol (PEG)Polivinilalkol graft kopolimeri,Kaolin,Siyah demir oksit, Titanyumdioksit, Kopolividon, Sodyumlauril sülfat) 6.2 GeçimsizliklerGeçerli değildir. 6.3 Raf ömrü24 aydır. 6.4 Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında saklayınız. 6.5 Ambalajın niteliği ve içeriğiŞeffaf PVC/PE/PVDC/Al blister Kutuda, 30 film kaplı tabletlik ambalajlarda bulunur. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklar Kontrolü Yönetmeliği'ne uygun olarakimha edilmelidir. 7. RUHSAT SAHİBİNOBEL İLAÇ SANAYİİ VE TİCARET AŞ. Saray Mah. Dr. Adnan Büyükdeniz Cad. No:14 34768 Ümraniye / İSTANBUL Tel: 0 216 633 00 00 Bu belge
8. RUHSAT NUMARASI2017/103 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 10.03.2017Ruhsat yenileme tarihi10. KÜB'ÜN YENİLENME TARİHİBelge Doama Kodu: lZW56aklUZlAxZlAxM0FySHY3M0FyQ3NR Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys1 İmatinib ile yapılan ilave klinik çalışmalardan ve pazarlama sonrası deneyimden bu reaksiyon türleri bildirilmiştir. Bunlar arasında, genişletilmiş erişim programlarından ve daha küçük veya devam etmekteolan klinik çalışmalardan bildirilen ciddi istenmeyen olayların yanı sıra kendiliğinden bildirilen vakaraporları da yer almaktadır. Bu reaksiyonların büyüklüğü bilinmeyen bir popülasyondan bildirilmesinedeniyle, sıklıklarının güvenilir bir biçimde belirlenmesi veya imatinibe maruz kalma ile nedensel birilişkinin kesinleştirilmesi her zaman mümkün olmamaktadır.1 Transforme KML hastalarında ve GIST hastalarında en sık pnömoni bildirilmiştir.2 GIST hastalarında en sık baş aısı görülmüştür.3 Bir hasta yılı esasında, konjestif kalp yetmezliği de dahil olmak üzere kardiyak olaylar transforme KMLhastalarında kronik KML hastalarından daha sık gözlemlenmiştir.4 GIST hastalarında en sık kızarma görülmüştür; GIST ve transforme KML (KML-AF ve KML-BK)hastalarında en sık görülen ise kanamadır (hematom, hemoraji).5 Plevral efüzyon GIST hastalarında ve transforme KML (KML- AF ve KML- BK) hastalarında kronikKML hastalarından daha yaygın olarak bildirilmiştir.6/7 Abdominal aı ve gastrointestinal kanama en sık GIST hastalarında görülmüştür.8 Bazı ölümcül hepatik yetmezlik ve hepatik nekroz vakaları bildirilmiştir.9 Pazarlama sonrasında, imatinib ile tedavi sırasında veya bırakılmasından sonra müsküloskeletal aıgözlenmiştir.10 T 11 |
İlaç BilgileriGlivon 400 Mg Film Kaplı TabletEtken Maddesi: İmatinib Mesilat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.