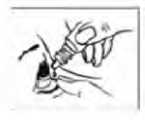
Eyestil %0,15 Göz Damlası, Çözelti Kısa Ürün BilgisiKISA ÜRÜN BILGISI1. BEŞERI TIBBI ÜRÜNÜN ADIEYESTİL %0,15 göz damlası, çözelti Steril 2. KALITATIF VE KANTİTATIF BILEŞIMEtkin madde:Sodyum hiyalüronat 1,5 mg/mLYardımcı maddeler:Benzalkonyum klorür 0,05 mg/mL Yardımcı maddeler için bölüm 6.1'e bakınız. 3. FARMASÖTIK FORMGöz damlası Renksiz, viskoz çözelti 4. KLİNIK ÖZELLIKLER4.1 Terapötik endikasyonlarKuru göz sendromunun semptomatik tedavisinde kullanılır. 4.2 Pozoloji ve uygulama şekliPozoloji:Doktor başka bir biçim önermediyse, günde 6 defaya kadar göze 1 damla damlatılması önerilir. Ürün bir aydan fazla süren tedavilerde kullanılmamalıdır. Uygulama sıklığı ve süresi:Tedaviye alınan yanıta bağlı olarak EYESTİL ile tedavinin süresi doktor tarafından belirlenmelidir. Uygulama şekli:Tedavi süreniz doktorunuz tarafından belirlenecektir. Yalnız göze uygulanır. Göze, konjunktiva kesesi denilen göz pınarının olduğu kısma damlatılarak uygulanır. Kullanmadan önce ambalajın zedelenmemiş olduğundan emin olunuz. 1. Ellerinizi yıkayın ve rahat bir şekilde oturun. 2. Şişenin ucunu delmek için kapağı sıkıca kapama yönünde çevirin. Kapağı çevirerek açın. 3. Hasta gözünüzün alt göz kapağını parmağınızla nazikçe aşağı çekin. 4. Şişeyi baş aşağı çevirin ve şişenin ucunu gözünüze değmeyecek kadar yaklaştırın. Damlalığın ucunu gözünüze veya göz kapağınıza değdirmeyin. 5. Şişeyi yalnız bir damla uygulayacak şekilde nazikçe sıkın ve ardından alt göz kapağınızıserbest bırakın. 6. Gözünüzü kapatın ve uygulanan gözünüzün buruna bitişik kısmına parmağınızı bastırarak,2 dakika bekleyin. 7. Kapağı tamamen aşağı doğru çevirip sıkıştırarak şişeyi kapatınız. Şişe açıldıktan sonra 28 gün içinde kullanılmalıdır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Böbrek/karaciğer yetmezliği olan hastalarda özel bir doz ayarlamasına gerek yoktur. Pediyatrik popülasyon:Pediyatrik yaş grubunda, EYESTİL gerçekten ihtiyaç olması halinde ve sıkı tıbbi kontrol altında kullanılmalıdır. Geriyatrik popülasyon:Yaşlılarda özel bir doz ayarlamasına gerek yoktur. 4.3 KontrendikasyonlarEYESTİL, içindeki maddelerden herhangi birine karşı aşırı duyarlılığı olanlarda kullanılmamalıdır. Benzalkonyum klorür içermesi nedeniyle yumuşak kontakt lensler ilebirlikte kullanımı kontrendikedir. 4.4 Özel kullanım uyarıları ve önlemleriDeterjan veya dezenfektan etki gösteren diğer göz çözeltileriyle birlikte aynı zamanda kullanımından kaçınılmalıdır. EYESTİL benzalkonyum klorür içerir, bu nedenle göz irritasyonuna neden olabilir. Yumuşak kontak lenslerle temasından kaçınınız. Uygulamadan önce kontak lensi çıkartınız ve lensitakmak için en az 15 dakika bekleyiniz. Yumuşak kontakt lenslerin renklerinin bozulmasınaneden olduğu bilinmektedir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriSodyum hiyalüronat, kuaterner amonyum tuzları mevcudiyetinde çökebilir. Bu bileşikleri içeren çözeltilerle birlikte kullanmaktan kaçınınız. Özel popülasyonlara ilişkin ek bilgilerHiçbir etkileşim çalışması yapılmamıştır. Pediyatrik popülasyonHiçbir etkileşim çalışması yapılmamıştır. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlarda kullanımına ilişkin herhangi bir veri yoktur. Gebelik dönemiEYESTİL'in gebelik döneminde kullanımına ait yeterli çalışma bulunmamaktadır. Gebelik sürecinde EYESTİL güvenliliği ile ilgili klinik veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum/ ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.Eyestil, gerekli olmadıkçagebelik döneminde kullanılmamalıdır. Laktasyon dönemiLaktasyonda etkisi bilinmemektedir. Üreme yeteneği/FertiliteÜreme yeteneği üzerine bilinen bir etkisi yoktur. 4.7 Araç ve makine kullanımı üzerindeki etkilerGeçerli değildir. 4.8 İstenmeyen etkilerKlinik çalışmalar sırasında elde edilen verilerde EYESTİL tedavisi ile bildirilen istenmeyen etkiler sıklığa bağlı olarak aşağıdaki şekilde sıralanmıştır; [Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); Çok seyrek (<1/10.000), bilinmiyor (eldeki verilerdenhareketle tahmin edilemiyor). Göz hastalıklarıYaygın: Tedavi sırasında göz kapağı veya konjunktiva inflamasyonu, kaşıntı, yanma, kızarıklık, lakrimasyon artışı veya yüzeyel keratit gibi alerjik reaksiyonlar gelişebilir. Bu reaksiyonlargenel olarak geçici, istenmeyen etkilerdir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr:[email protected] Doz aşımı ve tedavisiDoz aşımı vakası rapor edilmemiştir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özellikler:Farmakoterapötik grup: Oftalmolojikler, diğer oftalmolojikler ATC Kodu: S01XA 20 Etki Mekanizması:EYESTİL'in içerdiği sodyum hiyalüronat, yüksek molekül ağırlığı ile karakterize saf, doğal bir polisakkarittir ve bakteriyel fermentasyonla elde edilir. Polimerin psödoplastisitesi, yüksekviskozitesi ve yüksek su bağlama kapasitesi lakrimal filmin stabilize olmasına ve oküleryüzeyin nemlenmesine yol açar. 5.2 Farmakokinetik özelliklerGenel özellikler:Emilim:Konjunktival keseye verildikten sonra intraoküler emilimi olmaz. Dağılım:Polimer ön kamaraya enjekte edildiğinde, aköz hümörün akış sistemi aracılığıyla hızlıca elimine edilir. 0,2 mL işaretli sodyum hiyalüronatın tavşan ön kamarasına enjeksiyonundayarılanma ömrü 10,5 saat olarak bulunmuştur. 24 saat sonra platoya ulaşıldığında, sodyumhiyalüronat ve metabolitleri kanda saptanabilecektir. İntravenöz uygulandığında, yaklaşık 5dakika yarılanma ömrüyle sodyum hiyalüronat hızla kandan uzaklaşır. Biyotransformasyon:Sodyum hiyalüronatın büyük bölümü karaciğerde metabolize edilir. Bu polisakkarit burada başka metabolik süreçlerde yer alacak alt ünitelere metabolize olur. Eliminasyon:Sodyum hiyalüronat büyük oranda (%70) solunum sırasında CO2 olarak elimine edilirken, küçük bir kısmı (%22) idrarla atılır. 5.3 Klinik öncesi güvenlilik verileriOküler tolerabiliteyi kontrol etmek ve sistemik toksik etkileri göstermek üzere gerçekleştirilen çalışmalar, sodyum hiyalüronat bazlı göz damlasının 28 gün boyunca tekrarlananuygulamasından sonra tedavi edilen hayvanların gözlerinde anlamlı oküler irritasyon veyahistolojik değişiklik belirtileri gelişmediğini göstermiştir. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiDisodyum fosfat dodekahidrat Monobazik Sodyum fosfat Sodyum Klorür Benzalkonyum klorürSaf su k.m. 6.2 GeçimsizliklerSodyum hiyalüronat, kuaterner amonyum tuzları mevcudiyetinde çökebilir. Bu bileşikleri içeren çözeltilerle birlikte kullanmaktan kaçınınız. 6.3 Raf ömrü24 ay Şişenin ilk açılmasından sonra: 28 gün 6.4 Saklamaya yönelik özel tedbirler25° C'nin altındaki oda sıcaklığında ve çocukların ulaşamayacakları yerlerde ve ambalajında saklayınız. 6.5 Ambalajın niteliği ve içeriğiKarton kutu içinde kullanma talimatı ile birlikte 10 mL düşük yoğunlukta polietilen şişe içerisinde bulunur. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerGeçerli olduğu takdirde kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imhaedilmelidir. 7. RUHSAT SAHİBİSIFI İLAÇ ANONİM ŞİRKETİ Fatih Sultan Mehmet Mahallesi Poligon Cad. Buyaka 2 Sitesi 3 Blok No: 8C, İç Kapı No:79 Ümraniye, İstanbulTel: 0216 540 43 59Faks: 0216 771 20 95 8. RUHSAT NUMARASI2021/29 9. İLK RUHSAT TARIHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi : 11.02.2008 Ruhsat yenileme tarihi : 20.02.2021 10. KUB'UN YENILENME TARİHİ |
İlaç BilgileriEyestil %0,15 Göz Damlası, ÇözeltiEtken Maddesi: Sodyum Hiyalüronat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.