Oftamycin % 0.3 Steril Göz Damlası, Çözelti Kısa Ürün BilgisiKISA URUN BILGILERI1. BEŞERI TIBBI ÜRÜNÜN ADIOFTAMYCİN %0,3 göz damlası, çözelti Steril 2. KALITATIF VE KANTİTATIF BILEŞIMEtkin madde:Tobramisin 3 mg/mL Yardımcı maddeler:Benzalkonyum klorür 0,1 mg/mL Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTIK FORMGöz damlası, çözelti. Berrak ve renksiz çözelti. Partikül gözlenmemelidir. 4. KLİNIK ÖZELLIKLER4.1. Terapötik endikasyonlarDuyarlı patojenler nedeni ile gelişmiş göz ve adnekslerin eksternal infeksiyonlarının tedavisinde kullanılan topikal bir antibiyotiktir. 4.2. Pozoloji ve uygulama şekliOküler kullanım içindir. Pozoloji/uygulama sıklığı ve süresiYaşlılar dahil adolesan ve erişkinlerde kullanım: Hafif ila orta şiddetteki hastalıklarda hasta gözün/gözlerin konjunktival kesesine 7 gün boyunca her dört saatte bir veya iki damla damlatılarak uygulanır. Ağır infeksiyonlarda iyileşme elde edilene kadar her saat başı hasta gözün/gözlerin konjunktival kesesine düzelme görülünceye kadar iki damla damlatılır. Tedavi kesilmedenönce dozaj azaltılmalıdır. Diğer antibiyotiklerde olduğu gibi, tedaviye bakteriyel yanıt uygun bir şekilde gözlenmelidir. Tedavi süresi genellikle 7-10 gündür. Uygulama şekli:Sadece topikal kullanım içindir. Enjeksiyon yapılmamalı veya yutulmamalıdır. DU belge, güvenli eleKtronİK imza ile imzalanmıştır.Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebysBelge Do Damlalık ucunun ve çözeltinin kontaminasyonunu önlemek için, şişenin damlalık ucunun göz kapaklarına, göz çevresine ve diğer yüzeylere değmemesine özen gösterilmelidir. Damlatmadan sonra göz kapaklarının kapatılması veya nazolakrimal kanal üzerine hafifçe bastırılması önerilir. Bu oküler yolla uygulanan ilacın sistemik absorpsiyonunu azaltaraksistemik yan etkilerde azalma sağlayabilir. Diğer topikal oküler ilaçlarla eş zamanlı kullanılması durumunda, iki uygulama arasında 1015 dakika kadar beklenmelidir. Göz merhemleri en son uygulanmalıdır. 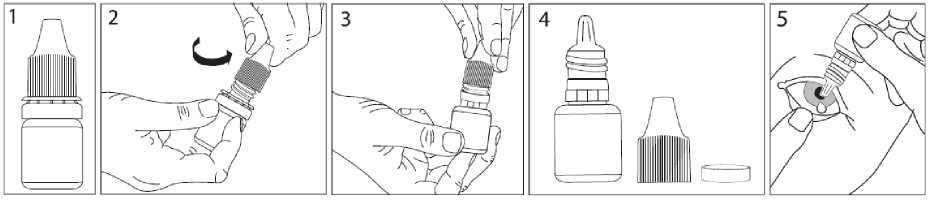 OFTAMYCİN'i sadece gözlerinize uygulayınız. OFTAMYCİN'in şişesini ve bir ayna alınız. Ellerinizi yıkayınız. Şişenin kapağını açınız (bkz. resim 2). Kapağın altında bulunan halkayı çıkarınız (bkz. Resim 3 ve Resim 4). 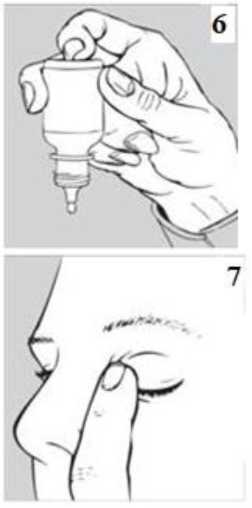 Şişeyi, başparmağınız ve orta parmağınız arasında ucu aşağıbakacak şekilde ters tutunuz. Başınızı arkaya yaslayınız. Temiz parmağınızla göz kapağınızı,göz kapağınız ile gözünüz arasında bir cep oluşana kadaraçınız. Damla buraya damlatılacaktır (bkz. resim 5). Şişenin ucunu gözünüze yakın bir noktaya getiriniz. Yardımıolacaksa aynayı kullanınız. Damlayı gözünüze veya göz kapağınıza, gözünüzün çevresineveya başka yüzeylere değdirmeyiniz. Damlaya mikropbulaşabilir. Her seferinde bir damla OFTAMYCİN damlatmak için tersşişenin dibine hafifçe basınız (bkz. resim 6). OFTAMYCİN'i kullandıktan sonra, göz kapağınızı serbestbırakınız, gözünüzü kapatınız ve bir parmağınızla burnunuzunyanından gözünüzün kenarına bastırınız. Bu OFTAMYCİN'invücudunuzun diğer bölgelerine geçmesini engellemeye yardımcı olur (bkz. resim 7). Eğer damlayı iki gözünüzde de kullanıyorsanız, diğer gözünüz için aynı uygulamayıtekrarlayınız. TyT1111Belge Doiüanım4an ihemensonrialişSS^k:kâSağını sı^ca ^IÇatİftlzhttps://www.turkiye.gov.tr/saglik-titck-ebys Diğer şişeyi açmadan önce, bir şişeyi tamamen kullanınız. Eğer damlayı gözünüzden dışarı damlatırsanız tekrar deneyiniz. Özel popülasyonlara ilişkin ek bilgiler Böbrek/Karaciğer yetmezliğiTobramisinin oküler kullanımı ile çok az sistemik maruziyet oluşur. Tobramisinin aminoglikozidler ile eş zamanlı olarak sistemik tedavide kullanılması halinde uygun birterapötik seviyeye ulaşıldığından emin olunana kadar total serum konsantrasyonununizlenmesine önem verilmelidir. Pediyatrik popülasyon1 yaş ve üzeri pediyatrik hastalarda yetişkinlerle aynı dozda (7-10 gün boyunca günde 2-3 kez) kullanılan OFTAMYCİN'in güvenliliği ve etkililiği gösterilmiştir. 1 yaşın altındaki çocuklar için etkililik ve güvenlilik bilgisi mevcut değildir. Geriyatrik popülasyonYaşlı hastalarda özel dozaj uygulaması gerekli değildir. 4.3. KontrendikasyonlarTobramisine veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olanlarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriTopikal olarak uygulanan aminoglikozidlere karşı bazı hastalarda hassasiyet gelişebilir. Aşırı duyarlılık reaksiyonlarının şiddeti; kaşıntı, ürtiker, deri döküntüsü, anafilaksi,anafilaktoid reaksiyonlar veya büllöz reaksiyonlar gibi lokal etkilerden genel reaksiyonlarakadar değişkenlik gösterebilir. Aşırı duyarlılık reaksiyonu görülmesi durumunda tedavikesilmelidir. Diğer aminoglikozidler ile çapraz reaksiyonlar oluşabilir ve topikal oküler tobramisine duyarlı olan hastaların ayrıca diğer topikal ve/veya sistemik aminoglikozidlere duyarlıolabileceği düşünülmelidir. Bu ilacı kullanırken aşırı duyarlılık gelişirse, tedavisonlandırılmalı ve diğer ilaçlar kullanılmalıdır (bkz. Bölüm 4.8). Sistemik aminoglikozid tedavisi alan hastalarda nörotoksisite, ototoksisite ve nefrotoksisiteyi içeren ciddi advers reaksiyonlar görülmüştür. Sistemik aminoglikozidlerleeş zamanlı kullanılacaksa dikkatli olunmalıdır ve toplam serum konsantrasyonunizlenmesine dikkat edilmelidir (bkz. Bölüm 4.8). Myasthenia gravis ya da Parkinson hastalığı gibi, bilinen ya da şüpheli nöromüsküler hastalıkları olan hastalara, OFTAMYCİN ..reçete edilirken dikkatli olunmalıdır. Bu Delge, güvemi elelaronık imza ile imzalanmıştır.Belge Do
zayıflığını şiddetlendirebilir. Diğer antibiyotiklerde olduğu gibi, uzun süre kullanım, mantarlar dahil tedaviye duyarlı olmayan organizmaların aşırı üremesiyle sonuçlanabilir. Süperinfeksiyon oluşursa, uygunbir tedavi hemen başlatılmalıdır. Oküler infeksiyon sırasında hastaların kontakt lens takmamaları tavsiye edilmelidir. OFTAMYCİN, koruyucu madde olarak göz iritasyonuna neden olabilen ve yumuşak kontakt lenslerin rengini bozduğu bilinen benzalkonyum klorür içermektedir. Yumuşak kontaktlenslerle temasından kaçınılmalıdır. Hastalar OFTAMYCİN uygulamasından önce kontaktlenslerini çıkarmalı ve uygulamanın ardından kontakt lenslerini takmadan önce 15 dakikabeklemelidirler. OFTAMYCİN göz damlası uygulamasından sonra, sistemik absorpsiyonu azaltmak için aşağıdaki önlemler alınmalıdır: -Göz kapağı 2 dakika kapalı tutulmalıdır; -Lakrimal kanal parmakla 2 dakika boyunca kapatılmalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriOFTAMYCİN ile özel bir etkileşim çalışması yapılmamıştır. OFTAMYCİN'in topikal oküler dozu ile klinik olarak anlamlı etkileşim tanımlanmamıştır. Tobramisin ile etkileşimler sistemik uygulamadan sonra bildirilmiştir. Ancak, tobramisinin topikal uygulamadan sonraki sistemik absorpsiyonu ile herhangi bir etkileşim riskininminimum düzeyde olduğu bulunmuştur. Bir aminoglikozid (OFTAMYCİN) ve nörotoksik, ototoksik veya nefrotoksik etkisi olan diğer oral, sistemik veya topikal ilaçların eş zamanlı ve/veya ardışık kullanımı toksisitedeartmaya neden olabilir, mümkün olduğunda kaçınılmalıdır. OFTAMYCİN ile kombine olarak kullanılan topikal kortikosteroidler bakteriyel, fungal veya viral infeksiyonların klinik belirtilerini maskeleyebilir ve aşırı duyarlılıkreaksiyonlarını baskılayabilir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: B Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Herhangi bir doğum kontrol yöntemi uygulamayan ve çocuk doğurma potansiyeli bulunan kadınlara için herhangi bir özel önlem tanımlanmamıştır. Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebysBelge DoGebelik dönemiGebe kadınlarda topikal oküler tobramisin kullanımına ilişkin veri yoktur veya sınırlı veri mevcuttur. Tobramisin, gebe kadınlarda intravenöz doz uygulamasının ardından plasentaüzerinden fötusa geçmemektedir. Tobramisinin rahim-içi maruziyette ototoksisiteye nedenolması beklenmemektedir. Hayvanlar üzerinde yapılan araştırmalar, sınırlı klinik ilgiye sahip olmak üzere, sistemik maruziyetten sonra ve tobramisin göz damlasından sağlanan terapötik kullanımdamaksimum insan dozundan yeterince fazla olduğu kabul edilen dozajlarda üreme toksisitesigöstermiştir. Tobramisinin sıçanlar veya tavşanlarda teratojenisiteye neden olmadığıkanıtlanmıştır (bkz. Bölüm 5.3). OFTAMYCİN gebelik döneminde kesinlikle gerekli olmadıkça kullanılmamalıdır. Laktasyon dönemiSistemik tedavide, tobramisin çocuğu etkileme riski taşıyacak miktarlarda (günde iki defa 150 mg'a kadar intravenöz veya intramüsküler uygulamadan sonra) anne sütüne geçer.Topikal oküler uygulama sonrasında tobramisinin insan sütüne atılıp atılmadığıbilinmemektedir. Emzirme dönemindeki bebekte risk göz ardı edilemese de, topikal olarakdamlatıldığında, sistemik maruziyet düşüktür ve OFTAMYCİN kullanırken risk düşükolarak değerlendirilmektedir. Bu ilaç emziren annelere reçete edildiğinde bu durum dikkatealınmalıdır. Çoğu ilaç anne sütüne geçtiği için, emzirmenin durdurulup durdurulmayacağına ya da tedavinin durdurulup durdurulmayacağına/tedaviden kaçınılıp kaçınılmayacağına ilişkinkarar verilirken, emzirmenin çocuk açısından faydası ve OFTAMYCİN tedavisinin emzirenanne açısından faydası dikkate alınmalıdır. Üreme yeteneği/FertiliteOFTAMYCİN'in topikal oküler kullanımının insan üremesi üzerine etkisini değerlendirmek üzere çalışmalar yapılmamıştır. 4.7. Araç ve makine kullanımı üzerindeki etkilerOFTAMYCİN'in araç ve makine kullanımına etkisi yoktur veya ihmal edilebilir düzeydedir. Diğer göz preperatlarıyla birlikte kullanımda geçici görme bulanıklığı veya diğer görmebozuklukları araç ya da makine kullanımını etkileyebilir. Eğer damlatma sırasında geçicigörme bulanıklığı ortaya çıkarsa, hasta araç veya makine kullanmadan önce görmenetleşinceye kadar beklemelidir. 4.8. İstenmeyen etkilerGüvenlilik profili özeti: Klinik çalışmalarda en sık bildirilen advers reaksiyonlar oküler hiperemi ve oküler Belge Do
Advers etkiler çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>l/1000 ila <1/100), seyrek (>1/10000 ila <1/1000), çok seyrek (<1/10000), bilinmiyor (eldekiverilerden hareketle tahmin edilemiyor) olarak listelenmiştir. Her sıklık grubunda, adversreaksiyonlar ciddiyet dereceleri azalacak şekilde listelenmiştir. Advers reaksiyonlar klinikçalışmalardan ve pazarlama sonrası spontan raporlardan elde edilmiştir. Aşağıdaki adversreaksiyonlar OFTAMYCİN göz damlasının ve/veya merheminin oftalmik kullanımınıtakiben gözlenmiştir: Bağışıklık sistemi hastalıkları:Yaygın olmayan: Hipersensitivite Bilinmiyor: Anafilaktik reaksiyon Sinir sistemi hastalıklarıYaygın olmayan: Baş ağrısı Göz hastalıklarıYaygın: Oküler rahatsızlık, oküler hiperemi, göz alerjisi, göz kapağı kaşıntısı Yaygın olmayan: Keratit, korneal aşınma, görme bozukluğu, bulanık görme, göz kapağıeritemi, konjunktival ödem, göz kapağında ödem, göz irritasyonu, göz ağrısı, kuru göz, gözakıntısı, gözyaşında artış, göz kaşıntısıBilinmiyor: Göz alerjisi, göz kapakları kaşıntısı Deri ve deri altı doku hastalıklarıYaygın olmayan: Ürtiker, dermatit, madarozis (kirpik dökülmesi), lökodermi (vitiligo), kaşıntı, deride kuruluk Bilinmiyor: Stevens-Johnson sendromu, döküntü, eritema multiforme, eritem Özel popülasyonlara ilişkin ek bilgiler:Bazı hastalarda topikal olarak uygulanan aminoglikozidlere karşı aşırı duyarlık oluşabilmektedir (bkz. Bölüm 4.4). Tobramisinin, aminoglikozid antibiyotiklerle sistemik tedavisinin eş zamanlı uygulandığı vakalarda, toplam serum konsantrasyonunun izlenmesine dikkat edilmelidir (bkz. Bölüm4.4). Sistemik tobramisin tedavisi alan hastalarda nörotoksisite, ototoksisite ve nefrotoksisite gibi ciddi advers reaksiyonlar ortaya çıkmıştır (bkz. Bölüm 4.4). Pediyatrik popülasyon:Çocuklarda advers reaksiyonların sıklığı, tipi ve ciddiyeti yetişkinlerde olduğu kadar beklenilir. OFTAMYCİN, 1 yaş ve üstü çocuklarda yetişkinlerde olduğu gibi aynı dozdakullanılabilir. 1 yaşından küçük çocuklarda güvenlik ve etkinlik tespit edilmemiştir ve
Şüpheli advers reaksiyonların raporlanması:Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın risk/yarar dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr:[email protected]:4.9. Doz aşımı ve tedavisiBu ürünün özelliklerine bağlı olarak oftalmik kullanımı veya şişe içeriğinin kazara içilmesi durumunda toksik etki beklenmemektedir. OFTAMYCİN' in aşırı doz klinik belirtileri (punktat keratit, eritem, gözyaşında artış, ödem ve göz kapağı kaşınması) bazı hastalarda görülen yan etkilere benzeyebilmektedir. OFTAMYCİN' in topikal doz aşımında göz(ler) ılık su ile yıkanabilir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Oftalmolojikler, antiinfektifler, antibiyotikler. ATC kodu: S01AA12 Tobramisin güçlü, geniş spektrumlu, hızlı bakterisidal etkili bir aminoglikozid antibiyotiktir. Başlıca etkisini bakteri hücreleri üzerinde polipeptid bağlanmasını ve ribozom üzerindesentezlenmesini engelleyerek gösterir. Direnç mekanizmasıTobramisine direnç, farklı mekanizmalarla oluşmaktadır. Bunlar şu şekildedir: (1) bakteri hücresi içerisindeki ribozomal alt biriminin değişiklikleri; (2) tobramisinin hücre içerisinetaşınması sırasında etkileşim (3) adenilleyici, fosforilleyici ve asetilleyici enzimleri dizisi iletobramisinin inaktivasyonu. İnaktive edici enzimlerin üretimi için genetik bilgiler, bakterikromozomu veya plazmidler aracılığıyla taşınabilir. Diğer aminoglikozitlere çapraz dirençoluşabilir. Sınır değerlerSınır değerler ve in vitro spektrum, aşağıda belirtildiği gibi sistemik kullanıma bağlıdır. Lokal olarak daha yüksek konsantrasyonlar elde edildiği ve lokal fiziksel/kimyasal koşullarürünün uygulama bölgesindeki aktivitesini etkileyebileceği için, bu sınır değerler tıbbiürünün topikal oküler kullanımı için geçerli olmayabilir. EUCAST'a göre, tobramisin içinaşağıdaki sınır değerler belirlenmektedir: EnterobacteriaceaeS < 2 mg/L, R > 4 mg/L Pseudomonas spp.S < 4 mg/L, R > 4 mg/L AcinetobactersppS, < 4 mg/L, R > 4 mg/L- ,.Bu b^ge, gu^^Tıâl^roniK ımz^ıl imzalanmıştır.BelgeT)oğm\?(m^^odStaphyioc&ccU'SSpp.l-mg/L^,-R-> 1 mg/L- Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys
Türle ilgili olmayan S < 2 mg/L, R > 4 mg/L Spesifik patojenlere karşı klinik etkinlik: Aşağıda listelenen bilgiler, mikroorganizmaların bu ilaçta tobramisine duyarlı olup olmayacağı hususundaki olasılıklar hakkında sadece tahmini bir kılavuz sunmaktadır.Konjonktivitte gözlemlenen gibi gözün dış enfeksiyonlarından izole edilen bakteri türleriburada sunulmaktadır. Edinilen direncin prevalansı, seçilen türler için coğrafi olarak ve zamanla değişiklik gösterilebilir; özellikle ciddi enfeksiyonları tedavi ederken direnç hakkında lokal bilgi arzuedilmektedir. Direncin lokal prevalansının, en azından bazı enfeksiyon tiplerinde tobramisinyararlılığının sorgulanabilir olduğu seviyede, gerekli olduğu üzere uzman tavsiyesialınmalıdır. YAYGIN OLARAK DUYARLI TÜRLER Aerobik Gram-pozitif mikroorganizmalar:Bacillus megaterium Bacillus pumilusCorynebacterium accolensCorynebacterium bovisCorynebacterium macginleyiCorynebacterium pseudodiphtheriticumKocuria kristinaeStaphylococcus aureus(metisiline duyarlı - MSSA)Staphylococcus haemolyticus(metisiline duyarlı- MSSH)Staphylococcus epidermidis(koagülaz pozitif ve negatif)StreptococciStreptococcuspnömoniadahil)Aerobik Gram-negatif mikroorganizmalar: Acinetobacter junii Acinetobacter ursingiiCitrobacter koseriEscherichia coliKlebsiella oxytocaKlebsiella pneumoniaeMoraxella catarrhalisMoraxella oslonensisMorganella morganiiNeisseria perflavaProteus mirabilisPseudomonas aerMgjinos^en\ielektronik imza ile imzalanmıştır.
Acinetobacter calcoaceticus Enterobacter aerogenes Escherichia coli H. Aegyptius Haemophilus influenzae Moraxella lacunataBirçok Proteus vulgaris türüDiğer ilgili patojenlere karşı anti-bakteriyel aktivite: EDİNİLEN DİRENCİN PROBLEM OLABİLECEĞİ TÜRLER Acinetobacter baumanii Bacillus cereus Bacillus thuringiensis Kocuria rhizophila Staphylococcus haemolyticus(metisiline duyarlı -MRSH) Staphylococcus,diğer koagülaz-negatif türler Serratia marcescensDOĞAL DİRENÇLİ ORGANİZMALAR Aerobik Gram-pozitif mikroorganizmalar: Enterococcus faecalis Staphylococcus auereus (methicillin resistant- MRSA) Streptococcus mitis Streptococcus pneumoniae Streptococcus pyogenes Streptococcus sanguis Aerobik Gram-negatif mikroorganizmalar: Chryseobacterium indologenes Haemophilus influenzae Stenotrophomonas maltophilia Burkholderia cepacia Anaerobik Bakteriler: Propionibacterium acnes
dirençli
Bakteriyel duyarlılık çalışmaları, bazı durumlarda, gentamisine mikroorganizmaların tobramisine duyarlılığını koruduğunu göstermektedir.  Pediyatrik popülasyon:Bakteriyel konjonktivit, blefarit veya blefarokonjonktivit tedavisi için tobramisin göz damlaları veya göz merhemi ile yürütülen 10 klinik çalışmaya 600'ün üzerinde pediyatrikhasta kaydedilmiştir. Bu hastaların yaşı 1 ile 18 arasında değişmiştir. Genelde pediyatrikhastalarda güvenlilik profili yetişkin hastalardakine benzerdir. 1 yaşın altındaki çocuklariçin, veri bulunmadığından pozoloji önerisinde bulunulamaz. Farmakokinetik /Farmakodinamik ilişkisi:OFTAMYCİN için belirli bir farmakokinetik/farmakodinamik ilişki kurulmamıştır. Yayınlanmış in vitroin vivoçalışmalarda tobramisinin, düşük serum konsantrasyonlarınarağmen bakteriyel büyümeyi etkili bir şekilde baskılayan uzun süre devam eden antibiyotiketkisi gösterilmiştir.Sistemik uygulama çalışmaları, çoklu günlük dozaj rejimlerine kıyasla günde bir kez doz rejimleri ile daha yüksek maksimum konsantrasyonlar bildirmiştir. Bununla birlikte, mevcutkanıtların ağırlığı, günde bir kez sistemik doz uygulamasının, çoklu günlük dozaj ile eşitderecede etkili olduğunu göstermektedir. Tobramisin konsantrasyona bağlı birantimikrobiyal öldürme etkisi gösterir ve MIC veya minimum bakteri öldürücükonsantrasyonun (MBC) üstünde artan antibiyotik düzeyleri ile daha yüksek etkinliğesahiptir. Yaşlı popülasyon:Yaşlılar ile diğer erişkin popülasyonlar arasında güvenlilik veya etkililik konusunda genel bir klinik fark gözlenmemiştir. 5.2. Farmakokinetik özelliklerGenel ÖzelliklerEmilimTobramisin tavşan korneası ve konjonktivada zayıf bir şekilde emilir ve topikal tobramisin uygulanmasından sonra göze minimal miktarlar absorbe olmaktadır. Ek olarak, OFTAMYCİN ile benzer konsantrasyona sahip tobramisin ürünlerinin topikal oküler uygulamasından sonra sistemik tobramisin absorpsiyonu klinik olarak zayıftır (%0.3).OFTAMYCİN'teki yüksek tobramisin konsantrasyonu, enfeksiyon bölgesinde (oküleryüzey) genellikle en dirençli izolatların konsantrasyonundan daha yüksek birkonsantrasyonda tobramisin sağlar (MlC'ler >64 pg/mL; insan gözündeki tek birOFTAMYCİN dozundan sonra tobramisin konsantrasyonu, dozdan 1 dakika sonra 848 ±674 pg/mL'dir). Sağlıklı insan gözyaşındaki tobramisin konsantrasyonu, OFTAMYCİN tedavisinde bir dozun uygulanmasından sonra en az 44 dakikaya kadar MIC90 üzerinde (oküler izolatlariçin tarif edildiği gibi 16 pg/ml) kalır. 6u belge
DağılımErkeklerde dağılım hacmi 0.26 l/kg'dır. _Tobramisinin insan plazma proteinine bağlanma oranı %10'dan daha düşük olduğu bulunmuştur. BiyotransformasyonTobramisin idrarla birincil olarak değişmemiş ilaç olarak atıldığı tespit edilmiştir. EliminasyonTobramisin, esasen değişmemiş ilaç olarak, glomerüler filtrasyon yoluyla idrarda hızla ve yaygın şekilde atılır. Plazma yarı ömrü yaklaşık iki saattir. Normal böbrek fonksiyonu olanerişkin bireylerde bildirilen sistemik klirensi 0.05-0.1 L/saat/kg arasında değişmiş ve böbrekfonksiyonlarında azalma ile düşüş göstermiştir. Doğrusallık/doğrusal olmama durumu:Topikal oküler uygulamadan sonra artan doz konsantrasyonları ile oküler veya sistemik absorpsiyon test edilmemiştir. Bu nedenle, oküler doz ile maruziyet arasındaki doğrusallıkilişkisi kurulamamıştır. Karaciğer ve böbrek yetmezliğinde kullanımBu hasta popülasyonlarında OFTAMYCİN göz damlaları ve göz merhemleri çalışılmamıştır. Bununla birlikte, bu ürünün topikal uygulamasından sonra düşük sistemiktobramisin emiliminden dolayı, doz ayarlaması gerekli değildir. Pediyatrik hastalarda kullanım:OFTAMYCİN, pediyatrik hastalarda (1 yaş ve üstü) erişkinlerle aynı dozda kullanılabilir. Diğer yandan, 1 yaşından küçük pediyatrik hastalarda sınırlı bilgi mevcuttur. 5.3. Klinik öncesi güvenlilik verileriTobramisin, gastrointestinal kanaldan çok az absorbe edilmektedir. Tobramisinin parenteral olarak uygulanan yüksek dozlarının sıçan ve köpeklerde renal toksisiteye, kedilerdeototoksisiteye neden olduğu raporlanmıştır. Klinik öncesi çalışmalar, majör organojenez periyotları esnasında sıçanlara 30 ve 60 mg/kg'de intra-peritoneal (IP) yolla tobramisinin yüksek sistemik dozlarının uygulandığınıve bunun fetüslerde ve yeni doğan sıçanlarda böbrekteki kortikal alanın kaybına veglomerüler yoğunlukta artışlara neden olduğunu göstermiştir. Diğer laboratuvarhayvanlarındakine benzer şekilde, aminoglikozid antibiyotiklerinin ototoksik olduğudüşünülmektedir. 30 hafta boyunca 20, 40 ve 80 mg/kg/gün şeklinde subkutan yollauygulama yapılan kedilerde uzatılmış sistemik tobramisin tedavisi, doza bağlı saçhücrelerinin ve kulaktaki destekleyici duyusal yapıların dejenerasyonu ile sonuçlanmıştır. Bununla birlikte, artık insan kulağının, hayvan modellerine göre anatomik olarak daha korumalı ve dolayısıyla aminoglikozid kaynaklı yaralanmalara karşı daha az hassas olduğu düşünülmektedir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiBenzalkonyum klorür TiloksapolSodyum klorürSusuz sodyum sülfatBorik asitSodyum hidroksitSülfürik asitEnjeksiyonluk su 6.2. GeçimsizliklerBilinen herhangi bir farmasötik geçimsizliği bulunmamaktadır. 6.3. Raf ömrü24 ay 6.4. Saklamaya yönelik özel uyarılar25°C altındaki oda sıcaklığında saklayınız. Şişe bir kez açıldıktan sonra ürünümüz 4 hafta (28 gün) içerisinde kullanılmalıdır. Bu süre içerisinde ürünümüz 25oC altındaki oda sıcaklığında saklanabilir. 6.5. Ambalajın niteliği ve içeriğiAmbalaj malzemesi olarak 5 mL'lik göz damlası içeren, opak, beyaz renkli, düşük yoğunluklu polietilen şişe (LDPE), LDPE damlalık ucu ve turuncu HDPE vidalı kapakkullanılmaktadır. Karton kutu içerisinde 1 adet şişe ve kullanma talimatı ile birlikte sunulur. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj Atıkları Kontrolü Yönetmeliği"ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİDeva Holding A.Ş. Halkalı Merkez Mah. Basın Ekspres Cad. No:1 34303 Küçükçekm ece/İSTANBUL Tel: 0212 692 92 92 Faks: 0212 697 00 24 E-mail: [email protected]
8. RUHSAT NUMARASI2015/93 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 07.02.2015 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriOftamycin % 0.3 Steril Göz Damlası, ÇözeltiEtken Maddesi: Tobramisin Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.




