Ziladone 10 Mg + 20 Mg + 40 Mg Tedaviye Başlama Paketi Kısa Ürün Bilgisi¡Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır?KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIZİLADONE 10 mg + 20 mg + 40 mg tedaviye başlama paketi 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:ZİLADONE 10 mg + 20 mg + 40 mg tedaviye başlama paketi içeriğinde bulunan; ZİLADONE 10 mg Film Kaplı Tablet 10 mg Vilazodon HCl içerir, ZİLADONE 20 mg Film Kaplı Tablet, 20 mg Vilazodon HCl içerir, ZİLADONE 40 mg Film Kaplı Tablet, 40 mg Vilazodon HCl içerir. Yardımcı maddeler:ZİLADONE 10 mg + 20 mg + 40 mg tedaviye başlama paketi içeriğinde bulunan; ZİLADONE 20 mg Film Kaplı Tablet, boyar madde olarak 0,0582 mg gün batımı sarısı FCFiçerir. Yardımcı maddeler için bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMFilm kaplı tablet ZİLADONE 10 mg Film Kaplı: Pembe renkli, oval, bombeli, bir tarafı 10 baskılı, bir tarafı çentikli film kaplı tabletler. ZİLADONE 20 mg Film Kaplı Tablet: Turuncu renkli, oval, bombeli, üstü 20 yazılı film kaplı tabletler. ZİLADONE 40 mg Film Kaplı Tablet: Mavi renkli, oval, bombeli, üstü 40 yazılı film kaplı tabletler. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarZİLADONE majör depresif atak belirtilerinin semptomatik olarak iyileştirilmesi için endikedir. ZİLADONE'nin majör depresif bozuklukta depreşme ve yinelemeleri önleme bakımından etkili olduğuna dair bir kanıt bulunmamaktadır. Bu nedenle majör depresif atak belirtilerigeriledikten sonra tedaviye devam edip etmeme kararı her hasta için periyodik olarak yenidendeğerlendirilmelidir. 4.2 Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:ZİLADONE için önerilen doz günde bir, kez ö,ğün ile birlikte 20-40 mg'dır. * öuböige, güvemi eleKironıK^za fle imzalanmıştır.^
Vilazodon, 7 gün boyunca günde bir kez 10 mg başlangıç dozu ile başlayıp, en az 7 gün boyunca günde bir kez 20 mg dozunda uygulanmalı, ve ardından günde bir kez 40 mg'a yükseltilmelidir. Açlık durumunda vilazodon kan konsantrasyonları (Eğri Altında kalan Alan-EAA), tokluğa göre yaklaşık %50 oranında azalabilir ve bu durum bazı hastalarda etkililiğin azalmasına nedenolabilir (bkz. Bölüm 5.2). İdame/Devam/Uzatılmış Tedavi Vilazodonun etkililiği 8 haftadan daha uzun süren klinik çalışmalarda araştırılmamıştır. Genelde MDB'ta akut ataklar için birkaç ay veya daha uzun süren ilaç tedavilerine ihtiyaçolduğu kabul edilir. İdame tedaviye olan ihtiyacı ve tedaviye uygun dozu belirlemek için hastalar periyodik olarak değerlendirilmelidir. Uygulama şekli:ZİLADONE gıdalarla birlikte alınmalıdır. Özel popülasyonlara ilişkin ek bilgiler:Gebe kadınlar:Üçüncü trimesterin sonlarında serotonerjik antidepresanlara maruz kalan yenidoğanlarda uzun süre hastanede kalma, solunum desteği ihtiyacı ve tüp ile beslenme gerektiren komplikasyonlarortaya çıkmıştır. Gebeler vilazodon ile tedavi edilirken, tedavinin potansiyel faydalarınıntedavinin potansiyel risklerine ağır basıp basmadığı göz önünde bulundurulmalıdır (bkz. Bölüm 4.6) . Emziren anneler:Vilazodonun süt üretimine ve emzirmeye olan etkisine ilişkin klinik veri yoktur (bkz. Bölüm 4.6) . Vilazodon ile tedavi edilen kadınlarda emzirme, yalnızca potansiyel faydaları potansiyelriskten ağır basarsa dikkate alınmalıdır. Pediyatrik popülasyon:Vilazodonun güvenliği ve etkinliği, Majör Depresif Bozukluk tedavisi için pediatrik hastalarda değerlendirilmemiştir (bkz. Bölüm 4.4). Yaşları 7 ila 17 arasında değişen MDB tanısı almış toplam 1002 pediyatrik hastayı içeren 8 haftalık kontrollü iki çalışmada etkinlik gösterilmemiştir. Antidepresanlar, çocuk hastalarda intihar düşüncesi ve davranışı riskini artırır. Geriyatrik popülasyon:Yaşa bağlı olarak doz ayarlaması önerilmez (bkz. Bölüm 4.4). Böbrek/Karaciğer yetmezliği:Karaciğer yetmezliği:Hafif veya orta dereceli karaciğer yetmezliği olan hastalarda doz ayarlaması önerilmez. Vilazodon, ciddi karaciğer yetmezliği konusunda çalışılmamıştır (bkz. Bölüm 4.4). Böbrek yetmezliği:Hafif, orta veya şiddetli böbrek yetmezliği olan hastalarda doz ayarlaması önerilmez (bkz. Belge DoBelge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebysBölüm 4 4) Bu belge  Cinsiyet:Cinsiyete göre doz ayarlaması gerekli değildir (bkz. Bölüm 4.4). Antidepresan Tedavinin DurdurulmasıVilazodon gibi serotonerjik ilaçların kesilmesi durumunda ilaç kesilme belirtileri ortaya çıktığı bildirilmiştir. İlacın aniden sonlandırılması yerine mümkün olduğunca kademeli olarak dozunazaltılarak kesilmesi önerilir. Vilazodon tedavisi kesilirken hastaların bu semptomlar içinizlenmesi gereklidir. Doz azaltılmasından sonra veya tedavinin kesilmesinden sonra tolereedilemeyen semptomlar ortaya çıkarsa, önceden verilen dozda tedaviye devam edilmesi vedozun daha kademeli bir oranda azaltılması düşünülmelidir (bkz. Bölüm 4.4). Monoamin Oksidaz İnhibitörleri (MAOI)MAOI'nin kesilmesi ve vilazodon ile tedavinin başlatılması arasında en az 14 gün geçmesi gerekir. Ayrıca, bir MAOI'ye başlamadan önce vilazodonu durdurduktan sonra en az 14 günara verilmelidir (bkz. Bölüm 4.3). 4.3 KontrendikasyonlarVilazodona ya da ilacın içeriğindeki yardımcı maddelere karşı aşırı duyarlılığı olduğu bilinen hastalarda kontrendikedir. Monoamin Oksidaz İnhibitörleriVilazodon, MAOI alan hastalarda veya önceki 14 gün içinde MAOI (linezolid ya da intravenöz metilen blue) almış olan hastalarda serotonerjik ilaçlarla ciddi, bazen ölümcül olan ilaçetkileşimi gelişmesi riski nedeniyle, birlikte kullanılmamalıdır. Bu etkileşimlerin içerdiği, nöroleptik malign sendromu andıran semptomlar şunlardır: titreme, miyoklonus, diyaforez, mide bulantısı, kusma, kızarma, baş dönmesi, hipertermi gibisemptomlarla, vital bulgularda muhtemel hızlı dalgalanmalarla birlikte otonom instabilite vedelirium ve komaya varabilen ileri derecede ajtasyon içeren zihinsel durum değişiklikleri gibiruhsal durumdaki değişikliklerdir. Vilazodonu durdurduktan sonra bir MAOI'ye başlamadan önce en az 14 gün ara verilmelidir. (bkz. Bölüm 4.5) 4.4 Özel kullanım uyarıları ve önlemleriUYARI: İNTİHAR EĞİLİMİ VE ANTİDEPRESAN İLAÇLAR Antidepresan ilaçların, çocuklar ve 24 yaşına kadar olan gençlerdeki kullanımlarının intihar düşünce ya da davranışlarını artırma olasılığı bulunmaktadır. Bu nedenle depresyonunkötüleşmesi ve intihar düşünce ya da davranışları yakından izlenmelidir. Ruh hali, davranış,düşünce veya duygularda herhangi bir yeni veya ani değişiklik olduğu fark edildiğinde derhaluzmana bildirilmelidir. ZİLADONE tedavisine yeni başlandığında veya doz değiştirildiğindeözellikle dikkat edilmelidir. ZİLADONE, 18 yaşın altındaki hastalarda kullanım için onaylanmamıştır.Klinik Kötüleşme ve İntihar Riski:Majör Depresif Bozukluğu (MDB) olan hem yetişkin hem de pediatrik hastalar, depresyonlarında kötüleşme ve/veya antidepresan ilaçlar alıp almadıklarına bakılmaksızın,intihar düşüncesi ve davranışının (intihar) ortaya çıkması veya davranışlarında olağandışı Belge DoşikloiklejıyaşaMbilirİ8r3vlltırilltlstlda 'anlamF£btSdüzrlLmepsolana. kradya.rgodervsaımsdee-bilİntihar depresyon ve diğer bazı psikiyatrik bozuklukların bilinen bir riskidir ve bu bozuklukların kendileri de intihar olaylarında en güçlü predispozandır. Bununla birlikte uzunzamandır, antidepresanların tedavinin erken evrelerinde bazı hastalarda depresyonunkötüleşmesine ve intihara yatkınlığın ortaya çıkmasında rol oynayabileceği konusunda devameden bir endişe bulunmaktadır. Antidepresan ilaçların (seçici serotonin geri alım inhibitörleri [SSRI'ler] ve diğerleri) kısa süreli plasebo kontrollü çalışmalarının havuzlanmış analizleri, bu ilaçların MDB ve diğer psikiyatrikbozuklukları olan çocuklarda, ergenlerde ve genç erişkinlerde (18-24 yaşlarındaki) intihardüşüncesi ve intihar davranışı riskini artırdığını göstermiştir. Yaklaşık 77.000 yetişkin hastayı ve 4.500'den fazla pediyatrik hastayı içeren antidepresan ilaçların (SSRI'lar ve diğer antidepresan sınıfları) plasebo kontrollü çalışma havuzununanalizine göre, 24 yaş ve altı antidepresanla tedavi edilen hastalarda intihar düşünceleri vedavranışlarının insidansı, plasebo verilen hastalara göre daha yüksekti. İlaçlar arasında intihar riski açısından önemli farklılıklar vardır, ancak çalışılan hemen hemen tüm ilaçlar için genç hastalarda artış eğilimi sözkonusudur. Farklı endikasyonlar arasındamutlak intihar riski açısından da farklılıklar vardı, en yüksek görülme sıklığı MDB tasaptanmıştır. Bununla birlikte, risk farklılıkları (ilaca karşı plasebo), yaş grupları içinde veendikasyonlar arasında nispeten kararlıdır. Bu risk farklılıkları (tedavi edilen 1000 hasta başınaintihar vakalarının sayısındaki ilaç-plasebo farkı) Tablo 1'de verilmiştir.
İntihar riskinin uzun süreli kullanıma, yani birkaç ayın ötesine geçip geçmediği bilinmemektedir. Bununla birlikte, depresyonlu yetişkinlerde plasebo kontrollü idameçalışmalarında, antidepresan kullanımının depresyonun tekrarlanmasını geciktirebileceğine vedepresyonun intihar düşünceleri ve davranışları için bir risk faktörü olduğuna dair önemlikanıtlar vardır. Herhangi bir endikasyon için antidepresanlarla tedavi edilen tüm hastalar, uygun şekilde takip edilmeli ve özellikle ilaç tedavisinin ilk birkaç ayında veya doz değişikliği (doz artışıya da azaltılması) zamanlarında, klinik durumda kötüleşme, intihara eğilim vedavranışlarda olağandışı değişiklikler açısından yakından izlenmelidir.
Anksiyete, ajitasyon, panik atak, uykusuzluk, sinirlilik, düşmanca duygular, saldırganlık, ataklık, akatizi (psikomotor huzursuzluk), hipomani ve mani, hem psikiyatrik hem depsikiyatrik olmayan diğer endikasyonlarda olduğu gibi majör depresif bozukluklar içinantidepresanlarla tedavi gören yetişkin ve pediyatrik hastalarda rapor edilmiştir. Her ne kadar bu semptomların ortaya çıkması ile depresyonun kötüleşmesi ve / veya intihar dürtülerinin ortaya çıkması arasında nedensel bir bağlantı kurulmamasına rağmen, busemptomların intihar olayının öncülleri olabileceği endişesi vardır. Depresyonu devamlı olarak daha kötüye giden hastalarda ya da depresyonu ya da intihara eğilimi kötüleştirmenin öncüsü olabilecek intihar girişimi/düşüncesi veya semptomlarıolanlarda, özellikle bu semptomlar şiddetli ise, ani başlangıçlı ya da hastanın semptomlarınınbir parçası değil ise ilacı kesmek de dahil olmak üzere terapötik rejimin değiştirilmesiseçenekleri göz önünde bulundurulmalıdır. Tedaviyi durdurma kararı verilmişse, ilaç mümkün olduğunca çabuk azaltılmalıdır, ancak ani durdurulan tedavinin belirli semptomlarla ilişkili olabileceği akılda tutulmalıdır (bkz. Bölüm4.2). Major depresif bozukluk ya da hem psikiyatrik hem de psikiyatrik olmayan diğer endikasyonlar nedeniyle antidepresanlarla tedavi edilen hastaların ailelerine ve bakıcılarına, ajitasyon,huzursuzluk, davranışlardaki alışılmadık değişiklikler ve yukarıda açıklanan diğersemptomların ortaya çıkması ile ilgili olarak hastaları izlemeleri gerektiği söylenmelidir. Ayrıcaintihar girişimlerini ve buna ait belirtileri derhal sağlık uzmanlarına bildirmeleri konusundauyarılmalıdırlar. Bu izleme ailelerin ve bakıcıların günlük gözlemlerini içermelidir. ZİLADONE reçetelerine, aşırı doz riskini azaltmak için iyi hasta yönetimiyle uyumlu en küçük dozaj formlarıyazılmalıdır. Bipolar bozukluğu olan hastaların araştırılmasıBir major depresif dönem, bipolar bozukluğun ilk belirtisi olabilir. Genellikle (kontrollü çalışmalarda değerlendirilmemiş olsa da), böyle bir epizotun tek başına bir antidepresanlatedavi edilmesinin, bipolar bozukluk riski taşıyan hastalarda mikst/manik epizotun aktifleşmeolasılığını artırabileceğine inanılır. Yukarıda sayılan semptomlardan herhangi birinin böyle bir dönüşümle ilgili olup olmadığı bilinmemektedir. Bununla birlikte, bir antidepresanla tedaviye başlamadan önce, depresifsemptomları olan hastalar, bipolar bozukluk için risk altında olup olmadıklarını belirlemek içinyeterince araştırılmalıdır; bu araştırma, ailede intihar hikayesi, bipolar bozukluk ve depresyonöyküsü dahil olmak üzere ayrıntılı bir psikiyatrik öykü içermelidir. ZİLADONE'nin bipolardepresyon tedavisinde kullanım için onaylanmadığı belirtilmelidir. Serotonin SendromuSerotonin ve norepinefrin geri alım inhibitörleri (SNRI'ler) ve vilazodon dahil selektif serotonin geri alım inhibitörleri (SSRI'lar), potansiyel olarak yaşamı tehdit eden bir durum olan serotoninsendromunu hızlandırabilir. Potansiyel olarak yaşamı tehdit edici serotonin sendromu veyaNöroleptik Malign Sendrom (NMS) benzeri reaksiyonlar, tek başına antidepresan kullananlardagörülmüştür, ancak özellikle serotonerjik ilaçlar (triptanlar, trisiklik antidepresanlar, fentanil, .....^m's Wort dahil) ile,, .serotonin Belge Takıp Adresı:https://www.turkiye.gov.tr/saglik-titck-ebysBd8.D.lİJyuffli.trraffi»d8l>,.tr!Sl8fâSıbusp>ro*'''İJyuffli.trraffi»d8l>,.tr!Sl8fâSıbusp>ro*'''QSNRS5K(3SirY3S3fcOZW56 metabolizmasını zayıflatan ilaçlar (MAO inhibitörleri dahil) ile veya antipsikotiklerle ya da diğer dopamin antagonistleriyle beraber kullanıldığında serotonin sendromu veya NMS riskiartar. Vilazodon ile tedavi edilen hastaların %0,1'inde serotonin sendromu belirtilerigörülmüştür. Serotonin sendromu semptomları, mental durum değişiklikleri (örneğin ajitasyon, halüsinasyon, koma), otonom değişkenlik (örn. taşikardi, değişken kan basıncı, hipertermi),nöromüsküler bozukluklar (örn. hiperrefleksi, koordinasyon bozukluğu) ve/veyagastrointestinal semptomlar (örn., mide bulantısı, kusma, ishal) içerebilir. Serotonin sendromu hipertermi, rijidite, vital bulgularda muhtemel hızlı dalgalanmalarla birlikte otonom değişkenlik ve mental durum değişiklikleri gibi semptomları içeren en şiddetlihali ile N^S e benzeyebilir. Hastalar SS veya N^S bulguları açısından takip edilmelidir. Vilazodonun depresyon tedavisi için MAOI'leri ile birlikte kullanılması kontrendikedir. (bkz. Bölüm 4.3). Vilazodon ile 5-hidroksitriptamin reseptör agonisti (triptan) birlikte kullanılacaksa, hastanın özellikle tedavinin başlangıcında ve doz artışları sırasında dikkatle takip edilmesi önerilir (bkz.Bölüm 4.5). Vilazodonun serotonin öncülleriyle (triptofan gibi) birlikte kullanılması tavsiye edilmez (bkz. Bölüm 4.5). Yukarıda belirtilen semptomların ortaya çıkması durumunda Vilazodon ve birlikte kullanılan serotonerjik (SSRI, serotonin-norepinefrin geri alım inhibitörü [SN^], triptan, buspirone,tramadol, vb.) veya antidopaminerjik ilaçlar (antipsikotikler dahil) derhal kesilmeli vedestekleyici semptomatik tedavi başlatılmalıdır. NöbetlerVilazodon, nöbet bozukluğu (epilepsi) olan hastalarda sistematik olarak değerlendirilmemiştir. Nöbet öyküsü olan hastalar klinik çalışmaların dışında bırakılmıştır. Diğer antidepresanlar gibi,Vilazodon de nöbet bozukluğu olan hastalarda dikkatli kullanılmalıdır. Anormal KanamaVilazodon dahil olmak üzere, serotonin geri alım inhibisyonu ile etkileşen ilaçların kullanımı, kanama riskini artırabilir. Aspirin, non-steroid antienflamatuar ilaçlar (NSAİİ), warfarin vediğer antikoagülanların birlikte kullanılması bu riske katkıda bulunabilir. Vaka raporları veepidemiyolojik çalışmalar (vaka-kontrol ve kohort tasarımı), serotonin geri alımı ile etkileşenilaçların kullanımı ile gastrointestinal kanama arasında bir ilişki olduğunu göstermiştir.SSRI'larla ilgili kanama olayları, ekimoz, hematom, burun kanaması ve peteşilerden hayatıtehdit eden kanamalara kadar değişebilir. Hastalar, vilazodon ile NSAİİ'lerin, aspirinin veya pıhtılaşmayı veya kanamayı etkileyen diğer ilaçların birlikte kullanılması ile ortaya çıkabilecek kanama riski konusunda uyarılmalıdır. Mani/Hipomani AktivasyonuKlinik çalışmalar sırasında Vilazodon ile tedavi edilen hastaların yaklaşık %0,1'inde mani/hipomani semptomları görülmüştür. Diğer antidepresanlarla tedavi edilen majör afektif -,.,ani aktivasyonu bildirilmiştir. elge laKıp /¥dresı:https://www.turkiye.gov.tr/saglik-titck-eDys
ç
.rın 'RG83Sfl?3§m
n
u Belge Do Tüm antidepresanlarda olduğu gibi, bipolar bozukluk, mani veya hipomani öyküsü olan hastalarda Vilazodon dikkatli kullanılmalıdır. Kesilme sendromuSerotonerjik antidepresanların kesilmesi üzerine ortaya çıkan olumsuz olaylar, özellikle ilaç aniden kesildiğinde: disforik ruh hali, huzursuzluk, ajitasyon, baş dönmesi, duyusalrahatsızlıklar (örneğin, parestezi, elektrik şoku duyusu gibi), endişe, kafa karışıklığı, baş ağrısı,uyuşukluk, duygusal değişkenlik, uykusuzluk, hipomani, kulak çınlaması ve nöbetler. Buolaylar genellikle kendi kendini sınırlarken, ciddi ileç kesilme belirtileri de bildirilmiştir. ZİLADONE tedavisi sonlandırılırken hastalar bu semptomlar için izlenmelidir. Doz mümkün olduğunca kademeli olarak azaltılmalıdır. Dozun azaltılmasının ya da tedavinin kesilmesininardından tolere edilemeyen semptomlar ortaya çıkarsa, önceden verilen dozda tedaviye devamedilmesi düşünülmelidir. Daha sonra, doz azaltılabilir, ancak bu azaltma daha kademeli biroranda yapılmalıdır (bkz. Bölüm 4.2). Kapalı Açılı GlokomVilazodon da dahil olmak üzere birçok antidepresanın kullanımını takiben görülen pupil genişlemesi, patent iridektomisi mevcut olmayan anatomik olarak dar açılı bir hastada açıkapanma atağını tetikleyebilir. Tedavi edilmemiş anatomik olarak dar açısı olan hastadavilazodon da dahil olmak üzere antidepresan kullanımından kaçınılmalıdır. HiponatremiKlinik çalışmalarda Vilazodon tedavisinden kaynaklanan hiçbir hiponatremi vakası bildirilmemesine rağmen, SSRI'ler ve SNRI'ler ile tedavilerde hiponatremi geliştiğibildirilmiştir. Pek çok durumda, hiponatremi uygunsuz antidiüretik hormon salgılanmasısendromunun (SIADH) bir sonucu olarak görünmektedir. Serum sodyumunun 110 mmol /L'den düşük olduğu vakalar bildirilmiştir. Yaşlı hastalarda SSRI'larla hiponatremi gelişme riski daha fazla olabilir. Ayrıca, diüretik kullanan ya da sıvı hacmi azalmış olan hastalar daha büyük risk altında olabilirler. Semptomatikhiponatremi hastalarında ZİLADONE kesilmeli ve uygun tıbbi müdahale yapılmalıdır. Hiponatreminin belirti ve semptomları arasında baş ağrısı, konsantre olma zorluğu, hafıza kaybı, konfüzyon, güçsüzlük ve düşmelere yol açabilecek dengesizlik sayılabilir. Daha ciddi ve/ veya akut vakalarla ilişkili belirti ve semptomlar, halüsinasyon, senkop, nöbet, koma, solunumdurması ve ölümdür. Cinsel İşlev BozukluğuVilazodon da dahil olmak üzere SSRI'ların kullanımı cinsel işlev bozukluğu semptomlarına neden olabilir (bkz. Bölüm 4.8). Erkek hastalarda, SSRI kullanımı boşalmada gecikme ya dabaşarısızlık, libidoda azalma ve erektil bozukluk ile sonuçlanabilir. Kadın hastalarda, SSRIkullanımı libidoda azalma ve orgazmda gecikme ya da hiç orgazm olamama ile sonuçlanabilir.Hekimin vilazodon tedavisine başlamadan önce ve özellikle tedavi sırasında cinsel işlevdekideğişiklikler hakkında bilgi almaları önemlidir, çünkü hastalar cinsel işlevlerindeki durumukendiliğinden bildirmeyebilirler. Cinsel işlevdeki değişiklikleri değerlendirirken, cinselsemptomların altta yatan psikiyatrik bozukluk da dahil olmak üzere başka nedenleriolabileceğinden ayrıntılı bir öykü alınması (semptomların başlama zamanlaması dahil)önemlidir. Hastaların tedavi hakkında bilinçli kararlar vermeleri için uygun şekilde
ile
ri Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebysBelge Do ZİLADONE 10 mg + 20 mg + 40 mg tedaviye başlama paketi içeriğinde bulunan ZİLADONE 20 mg film kaplı tablet günbatımı sarısı FCF içerdiğinden alerjik reaksiyonlara sebep olabilir. 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriKötüye Kullanma ve BağımlılıkVilazodon, sistemli olarak hayvanlarda araştırılmış ve kötüye kullanım veya bağımlılık potansiyeli göstermemiştir. Vilazodon, insanlarda kötüye kullanma potansiyeli açısındansistematik olarak çalışılmamış olmasına rağmen, klinik çalışmalarda ilaç arama davranışı içinherhangi bir kanıt bulunamamıştır. Bununla birlikte, klinik deneyime dayanarak, SSS üzerine etkili bir ilacın pazarlandığında ne kadar kötüye kullanılacağını tahmin etmek mümkün değildir. Sonuç olarak, doktorlar hastalarıilaç bağımlılığı öyküsü açısından dikkatlice değerlendirmeli ve bunları Vilazodonun kötüyekullanımı veya kötüye kullanımı belirtileri açısından gözlemleyerek bu tür hastaları yakındantakip etmelidir (örneğin, tolerans geliştirme, ilaç alma davranışı, doz artışları vb.). 
Santral Sinir Sistemi (SSS) üzerine etkili ilaçlarVilazodonun diğer SSS'nde etkili ilaçlarla kombine kullammınm oluşturacağı riskler sistematik olarak değerlendirilmemiştir. Sonuç olarak, Vilazodon diğer SSS'nde etkili ilaçlarla birliktekullanıldığında dikkatli olunmalıdır. Monoamin Oksidaz İnhibitörleri (MAOI)MAOI kullanmakta olan veya yakın zamanda MAOI kullanımı sonlandırılıp Vilazodona farmakolojik özellikleri açısından benzer olan antidepresan(lar) (örneğin SSRI'lara benzer)başlanan hastalarda veya bir MAOI başlatılmadan önce SSRI tedavisi sonlandırılmış hastalardabazıları ciddi veya ölümcül olan advers reaksiyonlar ortaya çıkabilir. Vilazodonu bir MAOI ile birlikte veya bir MAOI'yi durdurduktan veya başlattıktan sonraki 14 gün içinde reçete etmeyin (bkz. Bölüm 4.3). Serotonerjik İlaçlarVilazodonun etki mekanizması ve serotonin sendromu olarak da bilinen serotonin toksisitesi potansiyeli göz önüne alınarak, Vilazodon serotonerjik nörotransmitter sistemlerietkileyebilecek diğer ilaçlarla (örn. MAOI, SSRI'lar, SNRI'ler, triptan, buspirone, tramadol vetriptofan ürünleri vb.) birlikte kullanıldığında dikkatli olunması önerilir. Hemostazı Etkileyen İlaçlar (örneğin, NSAİİ'ler, Aspirin ve Varfarin)Trombositlerden serotonin salınımı hemostazda önemli rol oynar. Vaka kontrollü ve kohort tasarımlı epidemiyolojik çalışmalar, serotonin geri alımına müdahale eden psikotrop ilaçlarınkullanımı ile üst gastrointestinal kanama oluşumu arasında bir ilişki olduğunu göstermiştir. Bu çalışmalar aynı zamanda bir NSAİİ veya aspirin kullanımının bu kanama riskini artırabileceğini göstermiştir. SSRI'lar ve SNRI'lar warfarin birlikte kullanıldığında, kanama
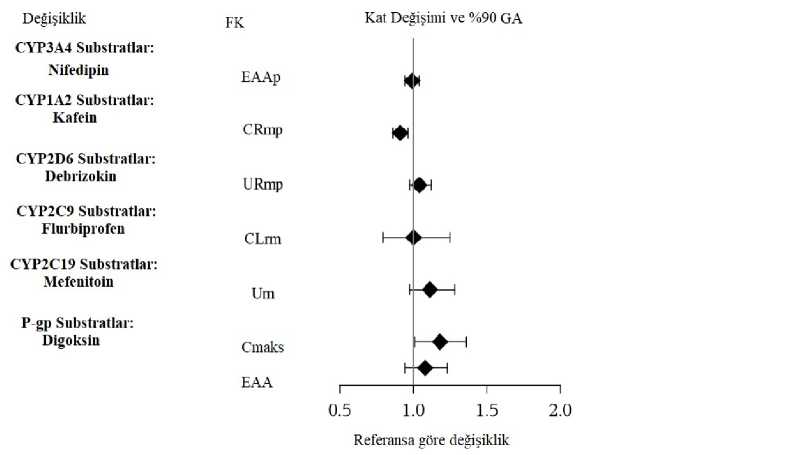
artışı da dahil olmak üzere, pıhtılaşma önleyici etkilerde değişiklikler bildirilmiştir. Varfarin kullanan hastalar, Vilazodon başlatıldığında veya kesildiğinde dikkatle izlenmelidir. Vilazodonu Etkileyen Diğer ilaçlar İçin PotansiyelŞekil 1. Diğer ilaçların vilazodon farmakokinetiği üzerindeki etkisi
Kat Değişini! ve %90 GA¦¦ I-1-1-10.5 1.01.52.0Referansa göre değişiklik:
EAAp= nifedipinin eğri altında kalan alanı; CRpm=paraxanthineye karşı kafein in 8. saatte plazma konsantrasyon oranı; URmp= 4-OH-debrisoquine nin debrisoquine ye karşı ürineratılım oranı; CLrm=4'-OH-flurbiprofenin renal klerensi; Um=4'-OH-mephenytoin in idrarlaatılımı; Cmaks=digoksinin maksimumıfilazmaiiksasantEâsyflnu; EAA =digoksinin EAA değeri; Belge D(g-gp=pa^^ycwprsiei^ 3k0RG83SHY3SHY3S3k0ZW56 Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys  CYP3A4 inhibitörleriVilazodon esas olarak CYP3A4 ile metabolize olur. Vilazodon ve güçlü CYP3A4 inhibitörlerinin(örneğin ketokonazol), birlikte kullanılması vilazodon plazma konsantrasyonlarını yaklaşık %50 arttırabilir (bkz. Şekil 1). Güçlü bir CYP3A4 inhibitörü ile birlikte uygulandığında, Vilazodon dozu 20 mg'a düşürülmelidir. Orta derecede güçlü CYP3A4 inhibitörleri (örn., Eritromisin) birliktealındığında, Vilazodon dozu, tolere edilemeyen yan etkiler gelişen hastalarda 20 mg'adüşürülmelidir. Vilazodon ve zayıf CYP3A4 inhibitörleri (örn., Simetidin) birlikte verildiğinde,doz ayarlaması önerilmez. CYP3A4 indükleyicilerVilazodon CYP3A4 indükleyicileriyle birlikte kullanıldığında, vilazodon sistemik maruziyeti azalabilir. Bununla birlikte, CYP3A4 indükleyicilerin vilazodon plazma konsantrasyonlarıüzerindeki etkisi değerlendirilmemiştir. Diğer CYP enzim inhibitörleriVilazodon CYP2C19 ve CYP2D6 inhibitörleriyle birlikte uygulandığında, vilazodonun plazma konsantrasyonlarının değişmesi beklenmez. Bu izoformlar, vilazodon metabolizmasındakiminör eliminasyon yollarıdır. İn vitroVilazodonun Diğer ilaçları Etkileme PotansiyeliCYP1A2, CYP2C9, CYP2D6, CYP3A4 veya CYP2C19 ile metabolize edilen ilaçlar.Vilazodonun CYP1A2, CYP2C9, CYP3A4 veya CYP2D6 substratlarıyla birlikte uygulandığında, CYP substratlarının konsantrasyonlarında klinik olarak önemli değişikliklereneden olması beklenmez. Sağlıklı deneklerdeki bir çalışma, Vilazodonun (8-10 gün boyunca20 mg/gün), kafein (CYP1A2), flurbiprofen (CYP2C9), nifedipin (CYP3A4) veya debrisokinin(CYP2D6) farmakokinetiğine etkisinin olmadığını göstermiştir. Sağlıklı gönüllülerde Vilazodon ile mefenitoin birlikte alındığında, hafif bir CYP2C19 indüksiyonunu düşündüren, mefentoin biyotransformasyonunda küçük bir (%11) artışgözlenmiştir. İn vitroCYP2C8 tarafından metabolize edilen ilaçlarVilazodon ile bir CYP2C8 substratının birlikte uygulanması, diğer ilacın konsantrasyonunda bir artışa yol açabilir. İn vitroin vivoCYP izoformlarının indüksiyonuBir in vitroPlazma Proteinine Yüksek Bağımlı İlaçlar
Vilazodon ve diğer yüksek oranda protein bağlı ilaçlar arasındaki etkileşim değerlendirilmemiştir. Vilazodon, plazma proteinine yüksek derecede bağlı olduğundan,Vilazodonun, proteinlere yüksek oranda bağlanan başka bir ilacı alan hastaya verilmesidurumunda, o ilacın serbest konsantrasyonlarının artmasına neden olabilir. Özel popülasyonlara ilişkin ek bilgiler:Pediyatrik popülasyonPediatrik hastalarda Vilazodon kullanımı ile ilgili klinik çalışmalar yapılmamıştır; Bu nedenle, çocuk popülasyonunda Vilazodon'un güvenliği ve etkinliği kanıtlanmamıştır. Vilazodon,pediatrik hastalarda kullanım için onaylanmamıştır. Bu gruptaki hastalarda etkileşim çalışması yapılmamıştır. Geriyatrik hastalarYaşa göre doz ayarlaması önerilmez (bkz. Şekil 2). Yaşlılarda (> 65 yaş) ve genç (24-55 yaş) bireylerde tek dozlu (20 mg) bir farmakokinetik çalışmanın sonuçları, farmakokinetiğingenellikle iki yaş grubu arasında benzer olduğunu göstermiştir. Vilazodonun klinikçalışmalarına, genç gastalardan farklı yanıt verip vermediklerini belirleyebilecek sayıda 65 yaşve üstü hasta katılmamıştır. Vilzodon ile yapılan klinik çalışmalarda 3.007 hastanın 65'i (%2,2)65 yaş veya üzerindeydi ve 378'i (%12,6) 55 ila 64 yaş arasındaydı. Genel olarak, yaşlı bir hastaiçin doz seçimi konservatif olmalıdır, genellikle doz aralığının alt ucundan başlayarakkaraciğer, böbrek veya kardiyak fonksiyonun azaldığı, eşlik eden hastalıkların varlığı veyadiğer ilaç tedavileri dikkate alınmalıdır. Bu gruptaki hastalarda etkileşim çalışması yapılmamıştır. Karaciğer yetmezliğiVilazodon öncelikle hepatik metabolizma tarafından elimine edilir. Hafif ve orta şiddette karaciğer yetmezliğinde, doz ayarlaması gerekli değildir (bkz. Şekil 3). Vilazodon, ağırkaraciğer yetmezliği olan hastalarda çalışılmamıştır (bkz. Bölüm 4.2). Bu gruptaki hastalarda etkileşim çalışması yapılmamıştır. Böbrek yetmezliğiHafif, orta ve ciddi böbrek yetmezliğinde, doz ayarlaması gerekli değildir (aşağıdaki Şekil 3'e bakın) (bkz. Bölüm 4.2). Bu gruptaki hastalarda etkileşim çalışması yapılmamıştır. CinsiyetVücut ağırlığına göre ayar yapıldıktan sonra, erkekler ve kadınlar arasındaki sistemik riskler benzerdir (bkz. Şekil 3). Şekil 3. İntrinsik faktörlerin vilazodon farmakokinetiği üzerine etkisi
0.5 1.01,52.0I1,5Referansa göre değiştklrk:Yaşlı gönüllüler için gösterilen veriler (> 65 yaş) gençlere (24-55 yaş) göredir. Kadın gönüllüler için gösterilen veriler erkek gönüllülere göredir. Böbrek ve karaciğer yetmezliği için gösterilen veriler, sırasıyla normal böbrek ve karaciğer fonksiyonuna sahip deneklerle ilgilidir. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Tedavi sırasında gebe kalan ya da gebe kalmayı planlayan hastaların bu durumu hekimlerine bildirmeleri önerilmelidir. Çocuk doğurma potansiyeli olan kadınlar doktorun tavsiye ettiği uygun doğum kontrol yöntemi kullanılmalıdır. Gebelik dönemiVilazodonun insanlarda hamilelik ve doğum üzerindeki etkisi bilinmemektedir. Vilazodon hamilelik ve doğum sırasında sadece potansiyel fayda potansiyel riskten ağır basarsakullanılmalıdır. Risk özeti Gebelerde yeterli ve iyi kontrollü Vilazodon çalışması yoktur. Belirtilen popülasyon için majör doğum kusurları ve düşük riskinin arka plan riski bilinmemektedir. Bununla birlikte, ABD degenel majör doğum defekti popülasyonundaki arka plan riski %2-4, düşük ise klinik olaraktanımlanmış gebeliklerde %15-20'dir. Hayvanlardaki üreme çalışmalarında, fareler ve tavşanlarda sırasıyla önerilen maksimum önerilen insan dozunun 48 ve ,17 katına .kadar dozlarda organogenez döneminde oral olarak
vHasodos: luyguJamasoRcfetölYsvücufekd
artfeş^e vepgecikmiş'/wiskelete.ossifikasyto^yla
Belge Do sonuçlandı. Teratojenik etkiler gözlendi. Azalan fetal vücut ağırlığı ve gecikmiş iskelet ossifikasyonu sırasıyla sıçanlarda ve tavşanlarda maksimum önerilen insan dozunun 10 ila 4katına kadar dozlarda gözlenmedi. Hastalıkla ilişkili maternal ve / veya embriyo / fetal risk Prospektif bir çalışmada, euthymic (doğal duygudurum) olan ve hamileliğin başında antidepresanlar alan majör depresif bozukluk öyküsü olan 201 gebe izlemiştir. Hamileliksırasında antidepresanları kesen kadınların, antidepresanları sürdüren kadınlara göre daha fazlamajör depresyon geçirme olasılığı vardı. Hamilelik ve doğum sonrası antidepresan ilaçlarlatedaviyi keserken ya da değiştirirken tedavi edilmeyen depresyon riskleri göz önündebulundurulmalıdır. Fetal / Yenidoğan yan etkileri Gebeliğin son dönemlerinde Vilazodon da dahil olmak üzere SSRI ve SNRI'lara maruz kalmak, uzun süre hastaneye yatış, solunum desteği ve tüp ile beslenme ve / veya yenidoğan persistanpulmoner hipertansiyonu (YD-PPH) gibi yenidoğan komplikasyonları için artmış riskoluşturabilir. YD-PPH ve ilaç bırakma sendromu açısından gebeliğin üçüncü trimesterindeVilazodona maruz kalan yenidoğanların izlenmesi önerilir. Üçüncü Trimester Maruziyeti Üçüncü trimesterde geç dönemde SSRI'lara veya serotonin ve norepinefrin geri alım inhibitörlerine (SNRI) maruz kalan yenidoğanlarda hastanede uzun süreli kalış, solunumdesteği ihtiyacı ve tüp ile beslenmeyi gerektiren komplikasyonlar gelişmiştir. Bu bulgularpazarlama sonrası raporlara dayanmaktadır. Bu tür komplikasyonlar doğumdan hemen sonraortaya çıkabilir. Rapor edilen klinik bulgular arasında solunum sıkıntısı, siyanoz, apne,nöbetler, vücut sıcaklığında dengesizlik, beslenme zorluğu, kusma, hipoglisemi, hipotoni,hipertoni, hiperrefleksi, titreme, titreme, sinirlilik ve sürekli ağlama sayılabilir. Bu özellikler,SSRI'ların ve SNRI'lerin doğrudan toksik etkisiyle veya muhtemelen bir ilaç sonlandırmasendromuyla tutarlıdır. Bazı durumlarda, klinik tablo serotonin sendromu ile uyumlu idi. Hamileliğin geç dönemlerinde SSRI'lara maruz kalma, YD-PPH için yüksek risk taşıyabilir. YD-PPH genel popülasyonda 1000 canlı doğumda 1-2'de görülür ve önemli neonatal morbiditeve mortalite ile ilişkilidir. YD-PPH ile doğmuş 377 kadının yeni doğan bebeği ile sağlıklı doğan 836 kadının yenidoğan bebeğinin karşılaştırıldığı retrospektif bir vaka-kontrol çalışmasında, 20. gebelik haftasındansonra antidepresan ilaçlara maruz kalmayan annelerden doğan bebeklere kıyasla SSRI'leremaruz kalan bebeklerde YD-PPH gelişme riski yaklaşık altı kat daha yüksekti. 1997-2005 yılları arasında İsveç'te doğan 831.324 bebekte yapılan bir çalışmada, SSRI'ların hasta tarafından bildirilen maternal kullanımıyla ilişkili olarak "erken gebelikte" PPHN riskoranı 2,4 (%95 GA 1,2-4,3) ve "Erken gebelikte" SSRI'ların hasta tarafından bildirilen maternalkullanımı ile ileriki gebeliklerde "doğum öncesi SSRI reçetesi" nin bir kombinasyonuyla ilişkiliPPHN risk oranı 3,6 (%95 GA 1,2-8,3) olarak hesaplanmıştır. Laktasyon dönemiVilazodon emziren dişi sıçanların sütüne geçtiği gösterilmiştir. Vilazodonun insanlarda laktasyon ve emzirme üzerindeki etkisi bilinmemektedir. Vilazodon ile tedavi edilen kadınlardaemzirmek, yalnızca potansiyel yarar çocuğun potansiyel riskinden daha ağır basarsa dikkatealınmalıdır )ama Kodu:IZW56Q3NRS3k0RG83SHY3SHY3S3k0ZW56Belge DoBelge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebysÜreme yeteneği/FertiliteVilazodon, sıçanlarda bazı gelişimsel olumsuz etkilere neden olmuştur, ancak sıçanlarda veya tavşanlarda teratojenik etkisi görülmemiştir. Gebe kadınlarda yeterli ve iyi kontrollü Vilazodonçalışması yoktur. Gebe kadınlarda Vilazodon tedavisi uygulanırken, potansiyel faydalarıntedavinin potansiyel risklerinden ağır basıp basmadığını dikkate alınmalıdır. Organogenez döneminde gebe sıçanlara veya tavşanlara sırasıyla 200 ve 36 mg/kg/gün oral dozlarda vilazodon verildiğinde, teratojenik etki görülmemiştir. Bu dozlar mg/m2 birimi olarakgözönüne alındığında 40 mg lık maksimum önerilen insan dozunun sırasıyla sıçanlar vetavşanlarda 48 ve 17 katıdır. Fötal vücut ağırlığı artışı azalmış ve bu dozlarda hem sıçanlardahem de tavşanlarda iskelet ossifikasyonu gecikmiştir; Bu etkiler, sıçanlarda maksimum önerileninsan dozunun 10 katına veya sıçanlarda maksimum önerilen insan dozunun 4 katına kadargözlenmemiştir. Vilazodon organojenez döneminde, maksimum önerilen insan dozunun 30 katı kadar olan oral dozda hamile sıçanlara uygulandığında, canlı doğan yavruların sayısı azalmıştır. Postnatalerken yavru ölümlerinde artış olmuştur ve hayatta kalan yavrular arasında vücut ağırlığındaazalma, olgunlaşmanın gecikmesi ve erişkinlikte doğurganlığın azalması gözlenmiştir. Budozda bazı maternal toksisiteler tespit edilmiştir. Bu etkiler maksimum önerilen insan dozunun6 katında görülmemiştir. 4.7 Araç ve makine kullanımı üzerindeki etkilerVilazodon tedavisinin araç-makine kullanma yeteneklerini olumsuz yönde etkilemeyeceğinden kesin olarak emin olana kadar, otomobiller de dahil olmak üzere tehlikeli makineleri kullanmakonusunda hastalar uyarılmalıdır. 4.8 İstenmeyen etkilerKlinik Çalışmalar DeneyimiVilazodon ile tedavi edilen MDB hastalarında plasebo kontrollü çalışmalarda en sık gözlenen advers reaksiyonlar (sıklığı >%5 ve plasebonun en az iki katı): ishal, bulantı, kusma veuykusuzluktur. Vilazodonun güvenliği, MDB tanısı almış, 522 hasta yılını temsil eden, 2.177 hastada (18-70 yaş) değerlendirilmiştir. Açık etiketli, 52 haftalık çalışmada, 599 hasta, günlük 40 mg doz iletoplam 348 hasta yılı olacak şekilde Vilazodon tedavisi aldı. Bu bölümlerde sunulan bilgiler, majör depresif bozuklukta günlük 40 mg Vilazodon çalışmalarından elde edilmiştir: 1) 2 plasebo kontrollü 8-haftalık, 861 hastada yapılan çalışmada 436 hastada;ve 2) açık etiketli, 52 haftalık, 599 hastada yapılan çalışmada vilazodon kullanıldı. Bu çalışmalarda, 7 gün boyunca günde 10 mg titrasyon periyodunu, 7 gün boyunca günde 20 mg doz uygulaması takip etmiştir. Bu klinik çalışmalarda Vilazodon gıdalarla birlikteuygulanmıştır. Klinik denemeler, çok çeşitli koşullar altında ve değişken zaman sürelerinde yapıldığından, bir
ilacın klinik deneylerinde g igralama Kodu: lZW56Q3NRS3k0RG83SrfBelge Do_ i* 'ladvers 'reaksiyonoranları, , başka bir ilacın, klinik SHY3S3kOZW56 Belge*Takıp Adresı:https://www.Turkiye.gov.tr/saglik-titck-ebys çalışmalarındaki oranlarla doğrudan karşılaştırılamaz ve pratikte gözlenen oranları yansıtmayabilir. Tedavinin kesilmesine neden olan advers reaksiyonlarMDB olan hastalarda yapılan plasebo-kontrollü çalışmalarda, hastaların >% 1'inde ilacın kesilmesine neden olan tek bir advers reaksiyon yoktu. Genel olarak bu çalışmalarda,Vilazodon alan hastaların %7,1'i, plasebo alan hastaların %3,2'sine kıyasla, olumsuz birreaksiyon nedeniyle tedaviyi kesmiştir. Plasebo kontrollü MDB çalışmalarında yaygın advers reaksiyonlarTablo 3, plasebo kontrollü çalışmalarda Vilazodon ile tedavi edilen MDB hastalarının >%2'sinde (ve plasebo ile tedavi edilen hastalardan daha büyük oranda) meydana gelen yaygınadvers reaksiyonların insidansını göstermektedir. Tablo 3: Vilazodon ile Tedavi Edilen Hastaların >%2 ve Plasebo ile Tedavi Edilen

Cinsel advers reaksiyonlarTablo 4, plasebo kontrollü Major Depresif Bozukluk çalışmalarında en yaygın cinsel advers reaksiyonları göstermektedir.
Laboratuvar testleriVilazodon tedavisi sırasında, plasebo kontrollü çalışmalarda, ölçülen biyokimyasal değerler (karaciğer fonksiyon testleri dahil), hematoloji ve idrar tahlilini içeren laboratuvar testparametrelerinde klinik olarak önemli değişiklikler gözlenmemiştir. Bu çalışmalar (1)başlangıçtan itibaren ortalama değişimin ve (2) başlangıçtan itibaren potansiyel olarak klinikolarak anlamlı değişiklikler için kriterlere uyan hastaların oranını içerir. 52 haftalık açık etiketliçalışmanın sonuçları, plasebo kontrollü çalışmaların bulgularıyla tutarlılık gösteriyordu. EKGVilazodon, QT, QTc, PR ve QRS aralıkları dahil olmak üzere EKG parametreleri üzerindeki herhangi bir klinik etki ile veya herhangi bir aritmojenik potansiyel ile ilişkilendirilmemiştir.EKG'ler, günlük olarak 80 mg'a kadar dozlarda ve plasebo kontrollü çalışmalarda kapsamlı birQTc çalışmasında değerlendirildi (bkz. Bölüm 5.1). Vital bulgularVilazodon, plasebo kontrollü çalışmalarda ölçüldüğü gibi sistolik ve diyastolik kan basıncı ve kalp atım hızı dahil vital bulgular üzerindeki klinik olarak önemli bir etki ileilişkilendirilmemiştir. Bu çalışmalar (1) başlangıçtan itibaren olan değişikliklerin analizini ve(2) başlangıçtan itibaren potansiyel olarak klinik olarak anlamlı değişiklikler için kriterlereuyan hastaların oranını içerir-bâ^ ,hfallkk§çik ietiketlizöaiısmanın sonuçları, plasebo kontrollü Vücut ağırlığıVilazodon, plasebo-kontrollü çalışmalarda 8 haftada, başlangıçtaki ortalama ölçülen vücut ağırlığını etkilememiştir. Ortalama ağırlık değişimi Vilazodon grubunda +0,16 kg ve plasebogrubunda +0,18 kg idi. Kilo artışı >%7 olan hastaların oranı, Vilazodon grubunda % 0,9 ikenplasebo grubunda % 1,2 idi. Kilo kaybı >%7 olan hastaların oranı, Vilazodon grubunda % 1,4buna karşılık plasebo grubunda % 1,4 idi. Klinik çalışmalarda, vilazodon tedavisinden sonra aşağıdaki advers ilaç reaksiyonları bildirilmiştir. Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek >1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahminedilemiyor). Metabolizma ve beslenme bozukluklarıYaygın: İştah azalması Psikiyatrik hastalıklarYaygın olmayan: panik atak, mani Sinir sistemi hastalıklarYaygın: Sedasyon, migren Yaygın olmayan: Disguzi (tad alma bozukluğu) Göz hastalıklarYaygın: Bulanık görme, göz kuruluğu Yaygın olmayan: Katarakt Kardiyak hastalıklarYaygın olmayan: Ventriküler ekstrasistoller. Deri ve derialtı doku hastalıklarYaygın: Hiperhidroz, gece terlemeleri Böbrek ve idrar yolu hastalıklarYaygın olmayan: Sık idrara çıkma Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın olmayan: Anormal hissetmek Özel popülasyonlara ilişkin ek bilgiler:Pediyatrik popülasyon:Aşağıdaki advers reaksiyonlar, vilazodon ile tedavi edilen pediyatrik hastaların en az %5'inde rapor edilmiştir ve plasebo alan pediyatrik hastalardakinin en az iki katı oranda meydanagelmiştir: mide bulantısı, kusma, diyare, karın ağrısı/rahatsızlığı ve baş dönmesi. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine Belge Doama Ko'fiiğlar.!§ağ}ıfeme<ştlll;tinslpjarı?l®''hefhln|Çbti1SEhelj.:advırâbreft¥.iyo.au;iârlti?e  Farmakovijilans Merkezi (TUFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99) 4.9 Doz aşımı ve tedavisiVilazodon ile insanlarda doz aşımı konusunda klinik deneyim sınırlıdır. Dört hastada ve 1 hastanın çocuğunda Vilazodon ile doz aşımı gerçekleşmiş; tüm vakalar tedavi edilmiştir. Klinikçalışmalar sırasında, 200-280 mg dozlarında Vilazodon doz aşımı ile ilişkili advers reaksiyonlarolarak serotonin sendromu, uyuşukluk, huzursuzluk, halüsinasyonlar ve oryantasyonbozukluğu gözlenmiştir. Vilazodon için spesifik bir antidot bilinmemektedir. Doz aşımı durumunda, yakın tıbbi gözetim ve izleme dahil olmak üzere destekleyici tedavi sağlanmalıdır. Tedavi, herhangi bir ilacın dozaşımı doz yönetiminde kullanılan genel uygulamalardan oluşmalıdır. Birden fazla ilaç ile dozaşımı olasılığı göz önünde bulundurulmalıdır. Yeterli bir hava yolu, oksijenasyon veventilasyon sağlanmalıdır. Kalp ritmi ve yaşamsal belirtiler izlenmalidir. Genel destekleyici vesemptomatik önlemlerin alınması da önerilir. Gerekirse, uygun hava yolu korumasına sahipbüyük delikli orogastrik tüp ile gastrik lavaj düşünülebilir. Vilazodonun diyaliz ile vücuttanuzaklaştırılması konusunda çalışma yapılmamıştır; Bununla birlikte, yüksek dağılım haciminesahip olması, vilazodonun plazma konsantrasyonunun azaltılmasınında diyalizin etkiliolmayacağını göstermektedir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Antidepresanlar, diğer antidepresanlar ATC kodu: N06AX24 Etki mekanizmasıVilazodonun antidepresan etkisinin mekanizması tam olarak anlaşılmamıştır, ancak etkisinin serotonin geri alımının seçici inhibisyonu ile SSS'deki serotonerjik aktivitenin arttırılması ileilgili olduğu düşünülmektedir. Vilazodon ayrıca serotonerjik 5-HT1A reseptörlerinin deparsiyel agonistidir; Bununla birlikte, bu etkisinin serotonerjik iletime ilişkin net sonucu vevilazodonun antidepresan etkisindeki rolü bilinmemektedir. Vilazodon serotonin geri alım bölgesine yüksek afinite ile bağlanır (Ki = 0,1 nM), ancak norepinefrin (Ki = 56 nM) veya dopamin (Ki = 37 nM) gerialım bölgelerine afinitesi çokdüşüktür. Vilazodon, serotoninin gerialımını güçlü ve seçici bir şekilde önler (IC50 = 1,6 nM).Vilazodon ayrıca, 5-HT1A reseptörlerine yüksek afinite ile seçici olarak (IC50 = 2,1 nM)bağlanır ve bir 5-HT1A reseptör parsiyel agonisti olarak etki gösterir. Kapsamlı QT Çalışması: Vilazodon ile tedavi QTc aralığını uzatmamıştır. Vilazodonun (20, 40, 60 ve 80 mg) QTc aralığı üzerindeki etkisi, 157 sağlıklı denekte randomize, plasebo-kontrollü ve aktif-kontrollü (moksifloksasin 400 mg), paralel-grup şeklindedizayn edilmiş kapsamlı QTc çalışmasında değerlendirildi. Çalışma küçük etkileri saptayacakşekilde tasarlanmıştır. En geniş plasebo-ayarlanmış, başlangıçta düzeltilmiş QTc aralığı için, %90 güven aralığının üst sınırı, bireysel düzeltme yöntemine (QTcI) dayalı olarak 10 msn'nin altındaydı. Bu değer
klinik olarak anlamlı eşiğin altındadır. Bununla birlikte, 80 mg'ın yüksek klinik dozlama durumunu temsil etmesi için yeterli olup olmadığı bilinmemektedir. Klinik deneyimVilazodonun majör depresif bozukluğun tedavisindeki etkinliği, MDB için (DSM-IV-TR kriterlerini karşılayan yetişkin (18-70 yaş arası) poliklinik hastalarında 2 ayrı 8-hafta süren çokmerkezli, randomize, çift-kör klinik çalışmada gösterilmiştir. Üç tane 8 haftalık çalışma, Vilazodon 40 mg'ın (Çalışmalar 1-3) etkinliğini değerlendirdi ve bir 10 haftalık çalışma (Çalışma 4), Vilazodon 20 mg ve 40 mg'nın etkinliğini değerlendirdi(bakınız Tablo 5). Bu çalışmalarda, hastalar günde bir kez 20 mg veya 40 mg veya plaseboyarandomize edildiler. Hastalar ya 1 hafta boyunca günlük 20 mg dozda veya 2 haftadan fazla günde bir kez Vilazodon 40 mg dozda titre edildi (tok karna). Vilazodon, her iki doz için Montgomery-AsbergDepresyon Derecelendirme Ölçeği (MADRS) toplam puanında başlangıçtan son haftaya kadarölçülen depresif semptomların iyileştirilmesinde plaseboya üstündü. MADRS, depresif belirtilerin ciddiyetini değerlendirmek için kullanılan on maddelik, klinisyen dereceli bir skaladır. MADRS skorları 0 ile 60 arasında değişmekte olup, yüksek skorlar dahaşiddetli depresyonu göstermektedir. Clinical Global Impression - Severity (CGI-S) 3. ve 4. çalışmalarda değerlendirildi. Vilazodon 20 mg ve 40 mg CGI-S puanı plaseboya göre üstünlük gösterdi. 
a Çalışma ilacı alan ve bazal ve bazal sonrası MADRS değerlendirmeleri olan hastalara dayanarak b fark (ilaç eksi plasebo) en az kareli ortalama taban çizgisinden uç noktaya değişim* Tüm Vilazodon tedavi dozu grupları, çoğunluğa ayarlandıktan sonra plaseboya kıyasla istatistiksel olarakanlamlı kaldı. Temel demografik bilgiler genel olarak tüm tedavi gruplarında benzerdi. Nüfus alt grupları yaşa (65 yaşın üzerinde çok az sayıda hasta vardı), cinsiyete ve ırka göre incelendiğinde aralarındaherhangi bir belirgin farklılık bulunmadı. 5.2 Farmakokinetik özelliklerGenel özelliklerVilazodon aktivitesi esas olarak ana ilaca bağlıdır. Vilazodonun farmakokinetiği (5 mg - 80 mg) doz orantılıdır. Vilazodonun birikimi, tek doz verilerinden tahmin edilebilir, doza göredeğişmez ve kan seviyeleri yaklaşık 3 günde kararlı duruma ulaşılır. Vilazodonun eliminasyonu esas olarak hepatik metabolizma yolu iledir. Yaklaşık 25 saatlik bir terminal yarı ömre sahiptir. Kararlı durumda, tok karna günlük Vilazodon 40 mg dozundan sonra, ortalama Cmaks değeri 156 ng / mL'dir ve ortalama EAA (0-24 saat) değeri 1645 ng s / mL'dir. Emilim:Vilazodonun doruk konsantrasyonu, uygulamadan ortalama 4-5 saat (Tmaks) sonra oluşur ve yaklaşık 25 saatlik bir terminal yarı ömrü ile azalır. Vilazodonun mutlak biyoyararlanımı gıdalarla birlikte alındığında %72'dir. Vilazodonun gıda ile verilmesi (yüksek yağlı veya hafif öğün) oral biyoyararlanımı arttırır (Cmaks yaklaşık %147-160, EAA yaklaşık %64-85 artmıştır). Vilazodonun etanol veya proton pompası inhibitörü (pantoprazol) ile birlikte uygulanması, vilazodon absorpsiyon hızını ve miktarını etkilememiştir (bkz. Bölüm 4.5 Diğer tıbbi ürünlerleetkileşimler ve diğer etkileşim şekilleri, Şekil 1). Ayrıca, vilazodonun ne Tmaks ne de terminaleliminasyon hızı, pantoprazol veya etanol ile birlikte uygulandığında değişmemiştir. Oralalımdan sonraki 7 saat içinde kusma olursa, emilim yaklaşık %25 oranında azalır; ancak dozunyenilenmesine gerek yoktur. Dağılım:Vilazodon vücutta yaygın olarak dağılır ve yaklaşık %96-99 oranında proteine bağlanır. Biyotransformasyon:Vilazodon, hem CYP yolağı ile hem de CYP olmayan yolaklar üzerinden (muhtemelen karboksilesterazyoluyla) metabolize edilir. CYP yolakları arasında CYP3A4 metabolizmasından esas olarak sorumlu olan enzimdir, CYP2C19 ve CYP2D6 daha düşük oranda metabolizmasından sorumludurlar. İnsan mikrozomları ve insan hepatositleri ile yapılan in vitroin vivoçalışmada, vilazodon, bu prob substratlarmın farmakokinetiğini değiştirmemiştir.Bununla birlikte, CYP2C19 için prob substratı ile yapılan in vivobir çalışmada, CYP2C19aktivitesinde hafif bir artış ıgö§lenmi§tiiffekGüçiüzCYpn344nÂnfeibitörleri (örneğin, ketokonazol)
Belge Do
Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys  vilazodonun in vivometabolizmasını azaltabilir ve maruziyeti artırabilir. Bunun aksine, CYP3A4 indükleyicileri vilazodona maruziyeti azaltabilirler (bkz. Bölüm 4.5).Eliminasyon:Uygulanan dozun sadece %1 i idrarda ve %2'si dışkıda değişmemiş vilazodon olarak atılır. Hastalardaki karakteristik özelliklerKaraciğer yetmezliği:Hafif veya orta şiddette karaciğer yetmezliği, hastalarda vilazodonun görünür klerensini etkilememiştir. Böbrek yetmezliği:Hafif veya orta şiddette böbrek yetmezliği, hastalarda vilazodonun görünür klerensini etkilememiştir. 5.3 Klinik öncesi güvenlilik verileriKarsinogenez, Mutajenez, Fertilite BozukluğuKarsinojenezB6C3F1 farelerine ve Wistar sıçanlarına 2 yıl boyunca sırasıyla 135 ve 150 mg / kg / gün oral vilazodon dozlarının verildiği karsinogenez çalışmaları yapılmıştır. Bu dozlar, maksimumönerilen insan dozu 40 mg'ın mg/m2 bazında sırasıyla, yaklaşık 16,5 ve 36 katıdır. Farelerde,hepatoselüler karsinom insidansı, erkeklerde maksimum önerilen insan dozunun 16,5 katındaartmıştır; bu bulgu maksimum önerilen insan dozunun 5,5 katında gözlenmemiştir. Malignmeme bezi tümörlerinin görülme sıklığı, dişi hayvanlarda maksimum önerilen insan dozunun5,5 ve 16,5 katında sayısal olarak artmıştır, bu artış maksimum önerilen insan dozunun 16,5katında istatistiksel olarak anlamlıdır; bu bulgu maksimum önerilen insan dozunun 1,8 katındagözlenmemiştir. Yükselmiş prolaktin düzeyleri, maksimum önerilen insan dozunun 5,5 ve 33katı doz uygulanan 2 haftalık bir vilazodon çalışmasında gözlendi. Prolaktin seviyelerindekiartışların, kemirgenlerde meme tümörlerine neden olduğu bilinmektedir. Sıçan çalışmasındavilazodon, her iki cinsiyette maksimum önerilen insan dozunun 36 katına kadar dozlardakanserojen etki göstermemiştir. Mutajenez Vilazodon, in vitroin vitroin vitroin vivoin vivo/in vitroprogramlanmamış DNA sentez (Unscheduled DNA Synthesis,UDS) analizinde negatifti.Üreme yeteneği/Fertilite Sıçanlara mg/m2 bazında maksimum önerilen insan dozu 40 mg'ın 30 katına eşdeğer seviyede 125 mg/kg dozda vilazodon uygulandığında, dişilerin doğurganlığı üzerinde hiçbir etkisiolmazken, erkek fertiltesinde azalmaya neden olmuştur. Maksimum önerilen insan dozu nun 6katında erkek fertilitesinde bozulma gözlenmemiştir. Jüvenil Hayvan Toksisite Verileri
Bir jüvenil hayvan çalışmasında, erkek ve dişi sıçanlara, doğum sonrası 21 ila 90. günden başlayarak vilazodon (10, 50 ve 200 mg/kg/gün) verilmiştir. 50 mg/kg/gün dozu uygulanan dişisıçanlarda vajinal açıklığa ulaşma yaşında (yani cinsel olgunlaşma) gecikme gözlendi; OlumsuzEtki Gözlenmeyen Düzeyi (NOAEL) 10 mg/kg/gün idi. Bu NOAEL, pediatride test edilenmaksimum dozda (30 mg) ölçülenlere benzer EAA seviyelerinde idi. Hem ilaç tedavisi hem deiyileşme dönemlerinde 200 mg/kg'da erkek hayvanlarda ve 50 mg/kg'da dişi hayvanlardaadvers davranışsal etkiler (akustik irkilme testinde alışkanlık eksikliği) gözlendi. Bu bulgu içinNOAEL, erkekler için 50 mg/kg ve dişiler için 10 mg/kg idi; bu pediyatrik hastalarda test edilenmaksimum doza göre daha yüksek (erkekler hayvanlar) veya benzer (dişi hayvanlar) EAAseviyeleri ile ilişkili bulunmuştur. Dişi sıçanlarda 200 mg/kg'da kontrol grubuna kıyasla femurmineral yoğunluğunda %8'lik bir azalma gözlendi. Bu bulgu için NOAEL 50 mg/kg'dır ve bu,pediatride test edilen maksimum dozda ölçülenlerden daha yüksek bir EAA seviyesi ileilişkilidir. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiZİLADONE 10 mg + 20 mg + 40 mg tedaviye başlama paketi içerisinde bulunan, ZİLADONE 10 mg film kaplı tablet için; Hidroksi propil selüloz- SL Mannitol Parteck Delta MPoliplasdon UltraMikrokristalin selüloz PH 102Kolloidal silika 200 susuzMagnezyum stearate Opadry II Pink 85F240214 (Polivinil alkol, titanyum dioksit, makrogol/PEG, talk, FD&C Red#40/Allura Red AC Alüminyum Lak) ZİLADONE 20 mg film kaplı tablet için; Hidroksi propil selüloz- SL Mannitol Parteck Delta MPoliplasdon UltraMikrokristalin selüloz PH 102Kolloidal silika 200 susuzMagnezyum stearate Opadry II Orange 85F230139 (Polivinil alkol, titanyum dioksit, makrogol/PEG, talk, FD&C Yellow#6/Sunset Yellow FCF Alüminyum Lak) ZİLADONE 40 mg film kaplı tablet için; Hidroksi propil selüloz- SL Mannitol Parteck Delta MPoliplasdon UltraMikrokristalin selüloz PH 102Kolloidal silika 200 susuzMagnezyum stearate Opadry II Blue 85F205128 (Polivinil alkol, titanyum dioksit, makrogol/PEG, talk, FD&C Blue#1/Brilliant Blue FCF Alüminyum Lak) 6.2 GeçimsizliklerGeçerli değildir.
6.3 Raf ömrü24 ay 6.4 Saklamaya yönelik özel tedbirler25°C'nin altında oda sıcaklığında saklanmalıdır. 6.5 Ambalajın niteliği ve içeriğiŞeffaf PVC/PE/PVDC/Al blister Kutuda; 7 adet ZİLADONE 10 mg Film Kaplı Tablet, 7 adet ZİLADONE 20 mg Film Kaplı Tablet, 16 adet ZİLADONE 40 mg Film Kaplı Tablet, olmak üzere 30 film tabletlik ambalajlarda. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİNOBEL İLAÇ SANAYİİ ve TİCARET A.Ş. Saray Mah. Dr. Adnan Büyükdeniz Cad. No: 14 34768 Ümraniye İSTANBUL / TÜRKİYETel: +90 (216) 633 60 00Fax: +90 (216) 633 60 01 8. RUHSAT NUMARASI2023/326 9. İLK RUHSAT TARİHİ/ RUHSAT YENİLEME TARİHİİlk ruhsat tarihi:23.08.2023 Ruhsat yenileme tarihi: - 10. KÜB'ÜN YENİLENME TARİHİ
|
İlaç BilgileriZiladone 10 Mg + 20 Mg + 40 Mg Tedaviye Başlama PaketiEtken Maddesi: Vilazodon Hidroklorür Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.