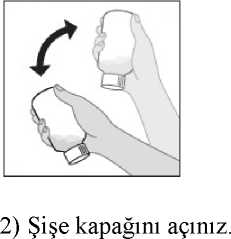
Augmentin-bid 400 Mg+57 Mg/5 Ml Fort Oral Süspansiyon Hazırlamak İçin Kuru Toz Kısa Ürün BilgisiKISA URUN BILGISI1. BEŞERI TIBBİ ÜRÜNÜN ADIAUGMENTİN-BID 400 mg+57 mg/5 ml fort oral süspansiyon hazırlamak için kuru toz 2. KALİTATİF VE KANTİTATİF BİLEŞİMİEtkin madde:Her 5 ml'de: Amoksisilin (459,17 mg amoksisilin trihidrat olarak)................................400 mg *Klavulanik asit (67,90 mg potasyum klavulanat olarak)............................57 mg *Üretiminde inek sütünden elde edilen hammadde kullanılmaktadır. Yardımcı maddeler:Her 5ml'de: Golden şurup esansı (1283 052927/Ap0551)................................................ 23,75 mg Yardımcı maddeler için Bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMSüspansiyon hazırlamak için kuru toz. Beyaz-kirli beyaz serbest akışlı toz içeren berrak cam şişe. Bekledikçe yavaşça beyaz bir çökelti oluşturan beyaz-kirli beyaz bir süspansiyon meydana gelir. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarAUGMENTİN, lokal resmi antibiyotik reçeteleme kılavuzları ve duyarlılık verilerine uygun olarak kullanılmalıdır. AUGMENTİN, aşağıdaki sistemlerde amoksisiline dirençli beta laktamaz üreten suşların neden olduğundan şüphelenilen bakteriyel enfeksiyonların kısa süreli tedavisinde endikedir. Diğerdurumlarda sadece amoksisilin düşünülmelidir. Üst Solunum Yolu Enfeksiyonları (KBB dahil): Tekrarlayan tonsillit, akut bakteriyel sinüzit, akut otitis media. Alt Solunum Yolu Enfeksiyonları: Kronik bronşitin akut alevlenmeleri, lobar pnömoni ve bronkopnömoni, toplum kökenli pnömoni. Üriner Sistem Enfeksiyonları: Sistit, üretrit, piyelonefrit ve kadın genital sistem enfeksiyonları, gonore. Deri ve Yumuşak Doku Enfeksiyonları: Özellikle selülit, hayvan ısırmaları. Dental enfeksiyonlar: Yaygın selülit ile birlikte şiddetli diş apseleri. Kemik ve Eklem Enfeksiyonları: Özellikle osteomiyelit AUGMENTİN'e duyarlılık, coğrafya ve zamana göre değişecektir. Mevcut ise lokal duyarlılık verilerine danışılmalı ve gerektiğinde mikrobiyolojik örnekleme ve duyarlılık testleriyapılmalıdır. Duyarlı organizmaların listesi Farmakodinamik Özellikler bölümünde verilmiştir (bkz. Bölüm 5.1). Amoksisiline duyarlı organizmaların AUGMENTİN'e duyarlı beta-laktamaz üreten organizmalar ile birlikte neden olduğu karma enfeksiyonlar AUGMENTİN-BID 400+57 Fortoral süspansiyon ile tedavi edilebilir. Bu enfeksiyonlar beta laktamazlara dirençli başka birantibiyotiğin ilave edilmesini gerektirmez. 4.2 Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Dozlar, her bir bileşen olarak belirtilen dozlar dışında, amoksisilin/klavulanik asit içeriğine göre tanımlanır. Bir enfeksiyonu tedavi etmek için seçilen AUGMENTİN dozu için aşağıdaki maddeler dikkate alınmalıdır: Beklenen patojenler ve bu patojenlerin antibakteriyel ajanlara karşı olası duyarlılıkları(bkz. Bölüm 4.4) Enfeksiyonun ciddiyeti ve bölgesi Aşağıda belirtildiği gibi hastanın yaşı, ağırlığı ve böbrek fonksiyonu Gerektiğinde AUGMENTİN'in alternatif formlarının (örn. daha yüksek dozlarda amoksisilin sağlayan ve/veya farklı amoksisilin/klavulanik asit oranları içerenlerin) kullanılmasıdüşünülmelidir (bkz. Bölüm 4.4 ve 5.1). 40 kg altı olan çocuklar için bu AUGMENTİN formülü, aşağıda önerildiği gibi uygulandığında günlük toplam 1000-2800 mg amoksisilin/143-400 mg klavulanik asitsağlamaktadır. Eğer günlük daha yüksek amoksisilin dozunun gerekli olduğu düşünülürse,yüksek günlük klavulanik asit dozlarının uygulanmasından kaçınmak için başka birAUGMENTİN formunun seçilmesi önerilmektedir (bkz. Bölüm 4.4 ve 5.1). Tedavinin süresi hastanın yanıtına göre belirlenmelidir. Bazı enfeksiyonlar (örn. osteomiyelit) daha uzun tedavi süreleri gerektirir. Tedavi, inceleme yapılmadan 14 gündenfazla uzatılmamalıdır (uzatılmış tedavi için bölüm 4.4'e bakınız). Yetişkinler ve 40 kg veya üzerinde olan çocuklar AUGMENTİN'in yetişkinler için olan formülasyonu ile tedavi edilmelidir. < 40 kg olan çocuklarda İkiye bölünmüş dozlar halinde verilen 25 mg/3,6 mg/kg/gün ile 45 mg/6,4 mg/kg/gün; Bazı enfeksiyonlarda (otitis media, sinüzit ve alt solunum yolu enfeksiyonları) ikiyebölünmüş dozlar halinde verilen 70 mg/10 mg/kg/gün'e kadar uygulama düşünülebilir. Çocuklar AUGMENTİN tabletleri veya süspansiyonları ile tedavi edilebilir. 6 yaş ve altı çocuklar tercihen süspansiyon ile tedavi edilmelidir. 2 yaşın altındaki çocuklarda günde 45 mg/6,4 mg/kg'dan daha yüksek dozlarla ilgili AUGMENTİN 7:1 formülasyonları için klinik veri bulunmamaktadır. 2 aylıktan küçük hastalar için AUGMENTİN 7:1 formülasyonları hakkında klinik veri mevcut değildir. Bu nedenle bu popülasyon için doz önerisinde bulunulmamalıdır. Uygulama sıklığı ve süresi:Günde 2 kez alınır. Tedavi süresi, endikasyona uygun olmalı ve tedavi gözden geçirilmeden 14 günü aşmamalıdır. Uygulama şekli:Oral kullanım içindir. Gastrointestinal intolerans potansiyelini en aza indirmek ve amoksisilin/klavulanik asit absorpsiyonunu optimize etmek için yemek başlangıcındaalınmalıdır.
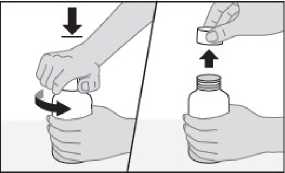
AUGMENTİN-BID 400+57 Fort oral süspansiyonu hazırlamak için önce tüm toz dağılıp serbestçe akana kadar şişe sallanmalıdır. Daha sonra, şişe kapağı açılmalıdır ve emniyet bandıçıkarılmalıdır. Gerekli su miktarının yaklaşık 2/3'ü koyularak, şişe iyice çalkalanmalıdır. İlksulandırılışta tam bir dağılma sağlamak için 5 dakika di^lendirilmelidir. Daha sonra kalan sumiktarı şişe üzerindeki sulandırma çizgisine kadar doldurulup yeniden çalkalanmalıdır. Her kullanımdan önce şişeyi iyice çalkalayınız. Hekimin her uygulama için önerdiği miktarda ilaç, şişe ile birlikte bulunan 5 mL'lik ölçü kaşığı kullanılarak hastaya verilir. Sulandırılmamış toz 25°C'nin altındaki oda sıcaklığında ve kuru bir yerde saklanmalıdır. Sulandırılan süspansiyon buzdolabı içinde (2-8 °C) saklanmalı ve 70 mL süspansiyon 7 gün,100 mL süspansiyon 10 gün içinde kullanılmalıdır. Dondurulmamalıdır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Kreatinin klerensi (CrCl) 30 ml/dak üzerinde olan çocuklarda doz ayarlamasına gerek yoktur. Kreatinin klerensi (CrCl) 30 ml/dak altında olan çocuklarda AUGMENTİN-BID 400+57 Fortoral süspansiyon kullanımı tavsiye edilmemektedir çünkü doz ayarlaması için herhangi biröneri mevcut değildir. Böbrek fonksiyonu gelişmemiş olan bebeklerde AUGMENTİN-BID 400+57 Fort oral süspansiyon kullanımı tavsiye edilmemektedir. Karaciğer yetmezliği:Karaciğer bozukluğu olan hastalarda doz ayarlaması dikkatli yapılmalı ve düzenli aralıklarla karaciğer fonksiyonları izlenmelidir (Bkz. Bölüm 4.3 ve 4.4). Henüz doz ayarlamasına temelteşkil edecek yeterli veri bulunmamaktadır. Pediyatrik popülasyon:2 yaşın altındaki çocuklarda günde 45 mg/6,4 mg/kg'dan daha yüksek dozlarla ilgili klinik veri bulunmamaktadır. 2 aylıktan daha küçük hastalar için klinik veri bulunmamaktadır. Dolayısıyla bu popülasyonda doz önerilerinde bulunulamamaktadır. Geriyatrik popülasyon:Herhangi bir doz ayarlamasının gerekli olduğu düşünülmemektedir. 4.3 KontrendikasyonlarEtkin maddelere, penisilinlerden herhangi birine ya da bölüm 6.1'de listelenen yardımcı maddelerin herhangi birine aşırı duyarlılığı olanlarda kontrendikedir. AUGMENTİN, diğer beta-laktam ajanlara karşı (örn. sefalosporin, karbapenem veya monobaktam) aşırı duyarlılık hikayesi (örn. anafilaksi) olanlarda kontrendikedir. Geçmişinde AUGMENTİN'e bağlı sarılık/karaciğer fonksiyon bozukluğu hikayesi olan hastalarda kontrendikedir (bkz. Bölüm 4.8). 4.4 Özel kullanım uyarıları ve önlemleriAUGMENTİN ile tedaviye başlanmadan önce geçmişinde penisilin, sefalosporin veya diğer beta laktam ajanlara karşı aşırı duyarlılık hikayesi varlığı dikkatlice sorgulanmalıdır (bkz.Bölüm 4.3 ve 4.8). Penisilin tedavisi alan hastalarda ciddi ve bazen öldürücü aşırı duyarlılık reaksiyonları (anafilaktoid ve şiddetli kutanöz advers reaksiyonlar dahil) bildirilmiştir. Aşırı duyarlılıkreaksiyonları, miyokard enfarktüsü ile sonuçlanabilecek ciddi bir alerjik reaksiyon olanKounis sendromuna da ilerleyebilir (bkz. Bölüm 4.8). Bu reaksiyonların geçmişindepenisiline karşı aşırı duyarlılık hikayesi olan ve atopik bireylerde görülmesi dahaolasıdır.İlaca bağlı enterokolit sendromu (DIES) çoğunlukla amoksisilin/klavulanik asit alançocuklarda bildirilmiştir (bkz. Bölüm 4.8). DIES, alerjik deri veya solunum semptomlarınınyokluğunda, başlıca semptomu uzun süreli kusma (ilaç uygulamasından 1-4 saat sonra) olanalerjik bir reaksiyondur. Diğer semptomlar karın ağrısı, diyare, hipotansiyon veya nötrofili ilebirlikte lökositozdan oluşabilir. Şoka kadar ilerleyen ciddi vakalar görülmüştür. Bir alerjikreaksiyon meydana gelirse AUGMENTİN tedavisi sonlandırılmalı ve uygun alternatif birtedaviye başlanmalıdır. Bir enfeksiyonun amoksisiline duyarlı organizma/organizmalara bağlı olduğu kanıtlanırsa, resmi kılavuzlara göre amoksisilin/klavulanik asitten amoksisiline geçiş göz önündebulundurulmalıdır. AUGMENTİN'in bu formu, klavulanik asit inhibisyonuna duyarlı beta laktamazların aracılık etmediği beta laktam ajanlara dirençli, olası patojenlerin yüksek riski söz konusu isekullanıma uygun değildir. Bu form penisiline dirençli S. pneumoniaetedavisindekullanılmamalıdır.Böbrek fonksiyonunda bozukluk olan veya yüksek dozlar alan hastalarda konvülsiyonlar görülebilir (bkz. Bölüm 4.8). Amoksisilin kullanımını takiben görülen kızamık benzeri döküntü enfeksiyöz mononükleoz ile ilişkili olabileceğinden, eğer enfeksiyöz mononükleoza ilişkin bir şüphe var iseAUGMENTİN tedavisinden kaçınılmalıdır. Amoksisilin ile eşzamanlı olarak allopurinol kullanılması alerjik cilt reaksiyonu olasılığını arttırabilir. Uzun süreli kullanım zamanla duyarlı olmayan organizmaların aşırı çoğalmasına neden olabilir. Tedavinin başında püstüllerle birlikte ateşli bir genel eritemin oluşması akut jeneralize eksantematöz püstülozun (AGEP) bir semptomu olabilir (bkz. Bölüm 4.8). Bu reaksiyonAUGMENTİN'in tedavisinin sonlandırılmasını gerektirir ve daha sonraki amoksisilinkullanımını kontrendike hale gelir. Amoksisilin/klavulanik asit karaciğer fonksiyon bozukluğu bulgusu olan hastalarda dikkatle kullanılmalıdır (bkz. Bölüm 4.2, 4.3 ve 4.8). Karaciğer olayları daha çok erkeklerde ve yaşlı hastalarda bildirilmiştir ve uzun süreli tedaviyle ilişkili olabilir. Bu olaylar çocuklarda nadiren bildirilmiştir. Tüm popülasyonlardabelirti ve semptomlar, genellikle tedavi sırasında ya da tedaviden kısa süre sonra ortaya çıkarancak bazı vakalarda tedavinin kesilmesinin ardından birkaç haftaya kadar belirgin halegelmeyebilir. Bunlar genellikle geri dönüşlüdür. Hepatik olaylar ciddi olabilir ve son derecenadir koşullarda ölümler bildirilmiştir. Bunlar hemen her zaman altta yatan ciddi hastalığıolanlarda ya da eşzamanlı olarak karaciğer üzerinde etkili olma potansiyeli bilinen ilaçlarıkullananlarda meydana gelmiştir (bkz. Bölüm 4.8). Amoksisilin dahil neredeyse tüm antibakteriyel ajanlarla, antibiyotiğe bağlı kolit bildirilmiştir ve şiddeti hafiften yaşamı tehdit edici boyuta kadar değişebilir (bkz. Bölüm 4.8). Bu nedenle,herhangi bir antibiyotik tedavisi sırasında veya sonrasında ishal olan hastalarda bu teşhisindeğerlendirilmesi önemlidir. Antibiyotiğe bağlı kolit gözlendiğinde, amoksisilin/klavulanikasit tedavisi derhal kesilmeli, bir doktor tarafından değerlendirilmeli ve uygun tedavibaşlatılmalıdır. Bu durumda anti-peristaltik ilaçlar kontrendikedir. Uzun süreli tedavi sırasında renal, hepatik ve hematopoetik fonksiyon dahil, organ sistem fonksiyonlarında periyodik değerlendirme tavsiye edilir. Amoksisilin/klavulanik asit alan hastalarda protrombin zamanında uzama nadiren bildirilmiştir. Antikoagülanlar ile birlikte reçete edildiğinde uygun şekilde izlenmesi gerekir.İstenilen antikoagülasyon düzeyini sürdürebilmek için oral antikoagülan dozunda ayarlamayapılması gerekebilir (Bkz. Bölüm 4.5 ve 4.8). Böbrek bozukluğu olan hastalarda doz, böbrek bozukluğunun derecesine uygun şekilde ayarlanmalıdır (bkz. Bölüm 4.2). Azalmış idrar çıkışı olan hastalarda, özellikle parenteral tedavide çok seyrek olarak kristalüri (akut renal hasarı da içeren) görülmüştür. Yüksek doz amoksisilin tedavisi sırasında,amoksisilin kristalüri olasılığını azaltmak için uygun miktarda sıvı alınması ve idrarmiktarının düzenlenmesi tavsiye edilebilir Mesane kateteri olan hastalarda düzenli olarakaçıklık kontrolü yapılmalıdır (bkz. Bölüm 4.8 ve 4.9). Amoksisilinle tedavi sırasında idrarda glukozun arandığı testler yapıldığında, enzimatik glukoz oksidaz yöntemleri kullanılmalıdır, çünkü enzimatik olmayan yöntemlerde yalancıpozitif sonuçlar görülebilir. AUGMENTİN içindeki klavulanik asit varlığı, kırmızı hücre membranlarınca IgG ve albüminin spesifik olmayan bağlanmasına neden olarak yalancı pozitif Coombs testine yolaçabilir. Amoksisilin/klavulanik asit alan ve daha sonra AspergillusAspergillusAspergillusAspergillus-dışıpolisakkaridler ve polifuranozlar arasında çapraz reaksiyonlar bildirilmiştir.Bu nedenle amoksisilin/klavulanik asit alan hastalardaki pozitif test sonuçları dikkatliyorumlanmalı ve başka tanı yöntemleriyle doğrulanmalıdır.AUGMENTİN-BID 400+57 Fort oral süspansiyon 5 ml'de 12,5 mg aspartam içerir ve bu nedenle fenilketonürili hastalarda dikkatli kullanılmalıdır. 12 haftadan küçük bebeklerdeaspartam kullanımını değerlendirmek için ne klinik veriler ne de klinik olmayan verilermevcut değildir. AUGMENTİN-BID 400+57 Fort oral süspansiyon'un formülasyonunda yer alan tatlandırıcı benzil alkol içerir. Benzil alkol alerjik reaksiyonlara neden olabilir. AUGMENTİN-BID 400+57 Fort oral süspansiyon'un formülasyonunda yer alan tatlandırıcılar maltodekstrin (glukoz) içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktozyetmezliği ya da glukoz - galaktoz malabsorpsiyon problemi olan hastaların bu ilacıkullanmamaları gerekir. 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriProbenesidProbenesid ile birlikte kullanımı önerilmemektedir. Probenesid amoksisilinin renal tübüler sekresyonunu azaltır. Probenesidin AUGMENTİN ile birlikte kullanımı amoksisilinin kanseviyelerinin artışına ve kanda bulunma süresinin uzamasına neden olabilirken, bu durumklavulanik asit için görülmez. AllopurinolAmoksisilin tedavisi sırasında allopurinol kullanımı alerjik cilt reaksiyonları olasılığını artırabilir. Allopurinol ve AUGMENTİN'in birlikte kullanımına ait veri bulunmamaktadır. Oral kontraseptiflerDiğer antibiyotiklerde de olduğu gibi AUGMENTİN, bağırsak florasını etkileyebilir. Bu durum östrojen reabsorpsiyonunun azalmasına yol açar ve kombine oral kontraseptiflerinetkililiğini azaltır. Oral antikoagülanlarOral antikoagülanlar ve penisilin antibiyotikleri etkileşim raporlanmadan pratikte yaygın olarak kullanılmıştır. Buna karşın, literatürde, asenokumarol veya varfarin kullanan ve bir küramoksisilin tedavisi verilen bazı hastalarda uluslararası normalleştirilmiş oran (INR)değerinde seyrek olarak yükselme görülen vakalar bildirilmiştir. Eğer birlikte kullanılmasıgerekli ise, amoksisilin kullanımının başlatılması veya bırakılması sürecinde protrombinzamanı veya INR değeri dikkatle takip edilmelidir. Ayrıca, oral antikoagülanların dozundaayarlamalar gerekebilir (bkz. bölüm 4.4 ve 4.8). MetotreksatPenisilinler metotreksatın atılımını azaltabilir ve bu durum toksisitede potansiyel bir artışa neden olur. Mikofenolat mofetilMikofenolat mofetil alan hastalarda, oral amoksisilin ve klavulanik asit başlatılmasını takiben aktif metabolit mikofenolik asidin doz öncesi konsantrasyonunda yaklaşık %50'lik bir azalmabildirilmiştir. Doz öncesi düzeydeki değişim, genel metabolik mikofenolik asitmaruziyetindeki değişimleri doğru şekilde temsil etmeyebilir. Bu nedenle, mikofenolatmofetil dozunda bir değişiklik graft fonksiyon bozukluğuna ilişkin klinik kanıt yokluğundanormalde gerekli olmamalıdır. Bununla birlikte, kombinasyon sırasında ve antibiyotiktedavisinden kısa süre sonra yakın klinik takip yürütülmelidir. Özel popülasyonlara ilişkin ek bilgiler:Veri bulunmamaktadır. Pediyatrik popülasyon:Yukarıda verilen bilgiler pediyatrik popülasyon için geçerlidir. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik Kategorisi: B Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Diğer antibiyotiklerde de olduğu gibi AUGMENTİN, bağırsak florasını etkileyebilir, östrojen reabsorpsiyonunun azalmasına yol açar ve kombine oral kontraseptiflerin etkililiğini azaltır.Bu nedenle tedavi süresince alternatif, etkili ve güvenilir bir doğum kontrol yöntemiuygulanmalıdır. Gebelik dönemiGebe kadınlara verilirken dikkatli olunmalıdır. Hayvanlar üzerinde yapılan çalışmalar gebelik, embriyonal/fetal gelişim, doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da zararlı etkiler olduğunugöstermemektedir (bkz. Bölüm 5.3). İnsanlarda gebelik sırasında amoksisilin/klavulanik asitkullanımına ilişkin kısıtlı veriler, artmış konjenital malformasyonlar riskine işaretetmemektedir. Preterm, prematüre fetal membran yırtılması (pPROM) olan kadınlarda yapılan bir çalışmada, AUGMENTİN'in profilaktik kullanımının yeni doğanlarda nekroze enterokolit riskininartması ile ilişkili olabileceği bildirilmiştir. Tüm ilaçlarda olduğu gibi, doktor tarafındangerekli görülmedikçe gebelik esnasında özellikle gebeliğin ilk üç ayında kullanılmamalıdır. Laktasyon dönemiAUGMENTİN'in iki etkin maddesi de anne sütüne geçer (klavulanik asitin anne sütü alan süt çocukları üzerindeki etkisi ile ilgili herhangi bir bilgi yoktur). Dolayısıyla anne sütüylebeslenen süt çocuklarında ishal ve mukoz mebranlarda mantar enfeksiyonu olasılığı vardır,bu nedenle emzirmenin kesilmesi gerekebilir. Sensitizasyon olasılığı göz önüne alınmalıdır.Emzirme döneminde amoksisilin/klavulanik asit sadece tedaviyi uygulayan hekiminfayda/risk değerlendirmesinden sonra kullanılmalıdır. Üreme yeteneği / FertiliteOral ve parenteral yolla verildiği hayvanlar (fare ve sıçanlar) üzerinde yapılan reprodüktif çalışmalarda, AUGMENTİN teratojenik etki göstermemiştir. 4.7 Araç ve makine kullanımı üzerindeki etkilerAUGMENTİN'in araç ve makine kullanımı üzerindeki etkileriyle ilgili bir çalışma yapılmamıştır. Buna karşın, araç ve makine kullanımım etkileyebilecek istenmeyen etkiler(örneğin; alerjik reaksiyonlar, sersemlik hali, konvülsiyonlar) oluşabilir (bkz. Bölüm 4.8). 4.8 İstenmeyen etkilerEn çok bildirilen advers ilaç reaksiyonları ishal, bulantı ve kusmadır. AUGMENTİN ile yapılan klinik çalışmalardan ve pazarlama sonrası gözetimden elde edilen ve MedDRA sistem organ sınıfına göre ayrılan advers ilaç reaksiyonları aşağıda listelenmektedir. İstenmeyen etkilerin meydana gelme sıklıklarına göre sınıflandırılması için aşağıdaki terminolojiler kullanılmıştır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketletahmin edilemiyor). Enfeksiyonlar ve enfestasyonlarYaygın: Mukokutanöz kandidiyazis. Bilinmiyor: Duyarlı olmayan organizmaların aşırı çoğalması Kan ve lenf sistemi hastalıklarıSeyrek: Geri dönüşümlü lökopeni (nötropeni dahil) ve trombositopeni. Bilinmiyor: Geri dönüşümlü agranülositoz ve hemolitik anemi, kanama ve protrombin zamanında uzama1 Bağışıklık sistemi hastalıkları8Bilinmiyor: Anjiyonörotik ödem, anafilaksi, serum hastalığı benzeri sendrom, aşırı duyarlılık vasküliti Sinir sistemi hastalıklarıYaygın olmayan: Baş dönmesi, baş ağrısı. Bilinmiyor: Geri dönüşümlü hiperaktivite, konvülsiyonlar1, aseptik menenjit Kalp hastalıkları
Kounis sendromu
Bilinmiyor: Gastrointestinal hastalıklarıYaygın: Yaygın olmayan: Bilinmiyor: Diyare, bulantı2, kusma Sindirim güçlüğüAntibiyotiğe bağlı kolit3İlaca bağlı enterokolit sendromuAkut pankreatit Siyah tüylü dil (dildeki papillaların belirginleşip siyah renk alması) Dişte renk değişikliği9 Hepato-bilier hastalıklarıYaygın olmayan: AST ve/veya ALT değerlerinde yükselme4Bilinmiyor: Hepatit5 ve kolestatik sarılık5 Deri ve derialtı doku hastalıkları6Yaygın olmayan: Deride döküntü, kaşıntı, ürtiker. Seyrek: Eritema multiforme. Bilinmiyor: Stevens-Johnson sendromu, toksik epidermal nekrolizis, bülloz döküntülü dermatit, akut generalize ekzantemöz püstüller (AGEP)1, eozinofili ve sistemik semptomların eşlik ettiği ilaç reaksiyonu (DRESS), Linear IgArahatsızlığı Böbrek ve idrar hastalıklarıBilinmiyor: İnterstisyel nefrit, kristalüri (akul renal hasarı da içeren)7 1 bkz. Bölüm 4.4 2 Bulantı çoğu kez daha yüksek oral dozlarla ilişkilendirilir. Gastrointestinal reaksiyonlarbelirginse, bunlar amoksisilin/klavulanik asit yemekle birlikte alınarak azaltılabilir.3Psödomembranöz kolit ve hemorajik kolit dahil (bkz. Bölüm 4.4). 4Beta-laktam sınıfı antibiyotikler ile tedavi edilmiş hastalarda AST ve/veya ALT'de orta düzeyde artış bildirilmekle birlikte bu bulguların anlamı bilinmemektedir. 5Bu olaylar diğer penisilinler ve sefalosporinler ile not edilmiştir (bkz. Bölüm 4.4). 6Herhangi bir aşırı duyarlılık dermatit reaksiyonu meydana gelirse tedavi bırakılmalıdır (bkz. Bölüm 4.4). 7bkz. Bölüm 4.9 8bkz. Bölüm 4.3 ve 4.4 9Çocuklarda çok nadir olarak yüzeysel dişte renk değişikliği bildirilmiştir. Genellikle fırçalama ile giderilebildiğinden, iyi bir ağız hijyeni dişte renk değişimini önlemeye yardımcı olabilir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99) 4.9 Doz aşımı ve tedavisiDoz aşımı belirtileri ve bulguları:Gastrointestinal semptomlar ve sıvı ve elektrolit dengesinin bozulması açıkça görülebilir. Bazı olgularda böbrek yetmezliğine yol açan amoksisilin kristalürisi görülmüştür (bkz. Bölüm 4.4.). Böbrek fonksiyonunda bozukluk olan veya yüksek dozlar alan hastalarda konvülsiyonlar görülebilir. Amoksisilinin, çoğunlukla yüksek dozların intravenöz uygulamasından sonra, mesane kateterlerinde yoğunlaştığı bildirilmiştir. Düzenli açıklık kontrolü sürdürülmelidir (bkz. Bölüm 4.4). Entoksikasyon tedavisi: Gastrointestinal semptomlar, su/elektrolit dengesine dikkat edilerek, semptomatik olarak tedavi edilebilir. AUGMENTİN dolaşımdan hemodiyaliz ile uzaklaştırılabilir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Beta-laktamaz inhibitörlerini de içeren penisilin kombinasyonları ATC kodu: J01CR02 Etki mekanizması:Amoksisilin bakteriyel hücre çeperinin integral yapısal bir bileşeni olan bakteriyel peptidoglikan biyosentetik yolağında bir ya da daha fazla enzimi (sıklıkla penisilin bağlayanproteinler, PBP'ler olarak adlandırılan) inhibe eden yarı sentetik bir penisilindir (beta-laktamantibiyotik). Peptidoglikan sentezinin inhibisyonu hücre çeperinin zayıflamasına yol açar kibunu genellikle hücre lizisi ve ölümü takip eder. Amoksisilin dirençli bakteriler tarafından üretilen beta-laktamazlar tarafından parçalanmaya duyarlı olduğundan tek başına amoksisilin aktivitesinin spektrumu bu enzimleri üretenorganizmaları içermez. Klavulanik asit yapısal olarak penisilinlerle ilişkili bir beta-laktamdır. Bazı beta-laktamaz enzimlerini inaktive ederek amoksisilinin inaktivasyonunu önler. Tek başına klavulanik asitklinik açıdan faydalı antibakteriyel etki göstermez. F armakokinetik/F armakodinamik ilişki: Minimum inhibisyon konsantrasyonu üzerindeki zamanın (T>MİK) amoksisilinin etkililiğinin majör belirleyici faktörü olduğu düşünülmektedir. Direnç mekanizmaları:Amoksisilin/klavulanik aside direnç için başlıca iki mekanizma şunlardır: Antibakteriyel ajanın hedef için afinitesini azaltan PBP'lerde değişiklik.
özellikle gram-negatif
Bakterilerin impermeabilitesi veya atım pompası mekanizmaları, bakterilerde, bakteriyel dirence yol açabilir veya neden olabilir. Kesim noktalarıAmoksisilin/klavulanik asit için MİK kesim noktaları Avrupa Antimikrobiyal Duyarlılık Testi (EUCAST) kesim noktalarıdır.
5 Ampisilin, amoksisilin ve piperasilin duyarlılığı (beta-laktamaz inhibitörlü veya bir beta-laktamazinhibitörü olmadan) çıkarımı ampisilin temel alınarak yapılabilir. Ampisiline direnç E. faecalis'teE. faecium'dayaygındır.6 Beta-laktam direnç mekanizmalarını dışlamak için oksasilin 1 ^g disk tarama testi veyabenzilpenisilin MİK testi kullanılmalıdır. Tarama negatif olduğunda (oksasilin inhibisyon zonu >20mm veya benzilpenisilin MİK <0.06 mg/L), klinik kesim noktaları mevcut olan tüm beta-laktamajanları, daha fazla test yapılmadan duyarlı olarak bildirilebilir. 7 Enterokoklardaki aminopenisilin kesim noktaları, intravenöz uygulamaya dayanmaktadır. Oraluygulama sadece üriner sistem enfeksiyonlarında geçerlidir 8Beta-laktamaz inhibitörü eklenmesi ek klinik yarar sağlamaz. 9 Benzilpenisilin (MİK veya disk difüzyon), viridans grubu streptokoklarda beta-laktam direncini taramak için kullanılabilir. Tarama negatif olarak kategorize edilen izolatların, klinik kesimnoktalarının listelendiği beta-laktam ajanlara duyarlı olduğu bildirilebilir. Tarama pozitif olaraksınıflandırılan izolatlar, her bir ajana duyarlılık açısından test edilmelidir. Benzilpenisilin taramasınegatif izolatlar için (MİK <0.25 mg/L), benzilpenisilin veya ampisilin temel alınarak duyarlılıkçıkarımı yapılabilir. Benzilpenisilin taraması pozitif izolatlar için (MİK >0.25 mg/L), duyarlılık çıkarımı için ampisilin temel alınır._Direnç prevalansı seçili türler için coğrafik açıdan ve zamanla çeşitlilik gösterebilir ve dirence ilişkin yerel bilgiler özellikle şiddetli enfeksiyonlar tedavi edilirken arzu edilir. Gerektiğindeyerel direnç prevalansı enfeksiyonların en azından bazı tiplerinde ajanın faydasından şüpheedilmesine yol açacak şekilde olduğunda uzman tavsiyesi alınmalıdır. Genellikle duyarlı türlerAerobik Gram-pozitif mikroorganizmalarEnterococcus faecalisGardnerella vaginalisStaphylococcus aureus(metisiline duyarlı) £Koagülaz negatif stafilokoklar (metisiline duyarlı) Streptococcus agalactiaeStreptococcus pneumoniae^StreptococcuspyogenesStreptococcus viridansgrubuAerobik Gram-negatif mikroorganizmalarCapnocytophaga spp.Eikenella corrodens Haemophilus influenzae2Moraxella catarrhalisPasteurella multocidaAnaerobik mikroorganizmalarBacteroides fragilisFusobacterium nucleatumPrevotellatürleriEdinilmiş direncin bir sorun oluşturabileceği türlerAerobik Gram-negatif mikroorganizmalarEscherichia coliKlebsiella oxytocaKlebsiella pneumoniaeProteus mirabilisProteus vulgarisAerobik Gram-pozitif mikroorganizmalarEnterococcus faecium $Doğası gereği dirençli organizmalarAerobik Gram-negatif mikroorganizmalarAcinetobactertürleriCitrobacter freundiiEnterobactertürleriLegionella pneumophilaMorganella morganiiProvidenciatürleriPseudomonastürleriSerratiatürleriStenotrophomonas maltophiliaDiğer mikroorganizmalarChlamydophila pneumoniaeChlamydophila psittaciCoxiella burnetiiMycoplasma pneumoniae
$Edinilmiş direnç mekanizmasının yokluğunda orta düzeyde doğal duyarlılık £ Metisiline dirençli tüm stafilokoklar amoksisilin/klavulanik asite dirençlidir. 1 Penisiline dirençli olan Streptococcuspneumoniaeamoksisilin/klavulanik asitin busunumuyla tedavi edilmemelidir (bkz. Bölüm 4.2 ve 4.4).2 Bazı AB ülkelerinde duyarlılığı azalmış suşlar, %10'dan daha yüksek bir sıklıktabildirilmiştir. 5.2 Farmakokinetik özellikler:Genel özellikler:Emilim:AUGMENTİN'in her iki bileşeni, hem amoksisilin hem de klavulanik asit, fizyolojik pH'da sulu çözeltilerde tamamen dissosiye olurlar. İki bileşik de oral uygulama sonrası hızla ve iyiabsorbe olur. Amoksisilin/klavulanik asidin emilimi, yemeğin başlangıcında alındığında optimize edilir. Oral uygulamayı takiben, amoksisilin ve klavulanik asit yaklaşık %70 oranındabiyoyararlanımına sahiptir. Her iki bileşenin plazma profilleri benzer olmakla birlikte, pikplazma konsantrasyonlarına ulaşma süresi (Tmaks) her durumda yaklaşık bir saattir. Yapılan bir çalışmanın sonuçlarına göre, sağlıklı erişkinlerde aç karnına amoksisilin/klavulanik asit 875/125 mg tabletin günde iki kere uygulanması sonucunda aşağıdaki sonuçlar elde edilmiştir.
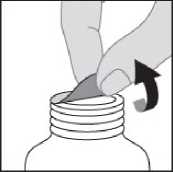
Amoksisilin/klavulanik asit ile elde edilen amoksisilin ve klavulanik asit serum konsantrasyonları, amoksisilin ve klavulanik asitin tek başlarına oral yolla verilişi ile eldeedilen konsantrasyonlarla benzerlik göstermektedir. Dağılım:Toplam plazma klavulanik asitinin %25 ve toplam plazma amoksisilinin %18 kadarı proteine bağlanır. Görünürdeki dağılım hacmi amoksisilinde 0,3-0,4 l/kg ve klavulanik asitte 0,2/ l/kgdolayındadır. İntravenöz uygulamadan sonra safra kesesinde; abdominal dokularda; deri, yağ, kas dokularında; sinoviyal ve peritoneal sıvılarda; safra ve iltihapta hem amoksisilin hem deklavulanik asit bulunmuştur. Amoksisilinin beyin omurilik sıvısına dağılımı yeterli değildir. Hayvan çalışmalarında, bileşenlerden herhangi biri için ilaçtan kaynaklanan materyallerle önemli doku tutulumuna ilişkin kanıt yoktur. Penisilinlerin çoğu gibi amoksisilin de annesütünde saptanabilir. Anne sütünde eser miktarda klavulanik asit de saptanabilmektedir (bkz.Bölüm 4.6). Hem amoksisilin hem de klavulanik asitin plasenta bariyerini geçtiği gösterilmiştir (bkz. Bölüm 4.6). Biyotransformasyon:Amoksisilin kısmen idrarla, başlangıç dozunun yaklaşık %10-25'i oranında inaktif penisiloik asit şeklinde atılır. Klavulanik asit insanda büyük oranda metabolize olur, idrar ve feçesiçinde ve karbondioksit şeklinde hava ile atılır. Eliminasyon:Amoksisilinin başlıca eliminasyon yolu böbreklerdir. Buna karşılık klavulanik asit hem renal hem de renal olmayan mekanizmalarla atılır. Amoksisilin/klavulanik asitin ortalama eliminasyon yarılanma ömrü yaklaşık bir saattir ve ortalama total klerens sağlıklı kişilerde yaklaşık 25 l/saattir. 250 mg/125 mg ya da 500mg/125 mg'lık tek bir AUGMENTİN tabletinin uygulanmasından sonraki ilk 6 saatteamoksisilinin yaklaşık %60-70'i ve klavulanik asitin yaklaşık %40-65'i idrarla değişikliğeuğramadan atılır. Çeşitli çalışmalarda, 24 saatlik bir dönemde amoksisilinin idrarla atılımmiktarının %50-85 ve klavulanik asitin %27-60 arasında olduğu bulunmuştur. Klavulanikasitte, ilacın en büyük miktarı uygulamadan sonraki ilk 2 saatte atılmaktadır. Eşzamanlı probenesid kullanımı, amoksisilin atılmasını geciktirmekle birlikte klavulanik asitin böbreklerden atılmasını geciktirmez (bkz. Bölüm 4.5). Hastalardaki karakteristik özelliklerBöbrek yetmezliği:Böbrek işlevinin azalmasıyla doğru orantılı olarak amoksisilin/klavulanik asitin total serum klerensi de azalır. İlaç klerensindeki azalma, amoksisilinin daha büyük bir bölümünün böbrekyoluyla atılması nedeniyle, amoksisilinde klavulanik asitten daha belirgindir. Bu yüzden,böbrek yetmezliğinde dozlar, amoksisilinin fazla birikmesini önlerken, yeterli klavulanik asitdüzeylerinin sürdürülmesini sağlamalıdır (bkz. Bölüm 4.2). Karaciğer yetmezliği:Karaciğer yetmezliği bulunan hastalarda doz dikkatle belirlenmeli ve karaciğer işlevleri düzenli aralıklarla izlenmelidir. Yaş:Amoksisilinin eliminasyon yarılanma ömrü 3 aylıktan 2 yaşına kadar olan çoçuklarda ve daha büyük çocuklarda ve yetişkinlerde aynıdır. Preterm doğanlar da dahil olmak üzere yaşamınilk haftasındaki çok küçük çocuklarda uygulama zaman aralığı, renal eliminasyon yolununolgunlaşmamış olması nedeniyle, günde iki kez uygulamayı geçmemelidir. Yaşlı hastalardaböbrek işlevlerinde azalma olasılığı daha fazla olduğundan, doz seçiminde dikkatliolunmalıdır ve böbrek işlevinin izlenmesi yararlı olabilir. Cinsiyet:Sağlıklı erkek ve kadınlara oral yoldan amoksisilin/klavulanik asit uygulanmasından sonra cinsiyetin amoksisilin ya da klavulanik asitin farmakokinetikleri üzerinde önemli bir etkisigörülmemiştir. Doğrusallık/Doğrusal olmayan durum:Amoksisilin, terapötik doz aralığında doğrusal farmakokinetiğe sahiptir. 5.3 Klinik öncesi güvenlilik verileriKlinik öncesi veriler, güvenlilik farmakolojisi, genotoksisite ve üreme toksisitesine yönelik çalışmalar temelinde insanlar açısından özel bir tehlike ortaya koymamıştır. Köpeklerde amoksisilin/klavulanik asitle yapılan tekrarlanan doz toksisitesi çalışmalarında, gastrik tahriş, kusma ve dilde renk bozukluğu görülmüştür. Amoksisilin/klavulanik asit ile karsinojenisite çalışmaları yapılmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiKsantan sakızı AspartamSüksinik asitAerosil 200 Hidroksipropilmetilselüloz Portakal esansı 1281 (61027E) (üretiminde kunduz koku bezi kullanılmaktadır) Portakal esansı 1282 (9/027108) (üretiminde kunduz koku bezi kullanılmaktadır) Ahududu esansı (07943 1286) Golden şurup esansı (1283 052927/Ap0551) Silikon dioksit 6.2 GeçimsizliklerBilinen bir geçimsizliği bulunmamaktadır. 6.3 Raf ömrü24 ay. 6.4 Saklamaya yönelik özel tedbirlerSulandırılmamış toz 25°C'nin altındaki oda sıcaklığında ve kuru bir yerde saklanmalıdır. Sulandırılan süspansiyon buzdolabı içinde (2 - 8 °C) saklanmalı ve 70 mL süspansiyon 7 gün,100 mL süspansiyon 10 gün içinde kullanılmalıdır. Dondurulmamalıdır. 6.5 Ambalajın niteliği ve içeriğiKutuda, polipropilen yapıda, dış kısmı opak beyaz renkli, yanal tırtıklı, iç kısmı şeffaf renkli, şeffaf kısımda şişe ağzına yapışacak alüminyum folyo içeren çocuk emniyetli kapaklı;sulandırma çizgisi içeren tip III berrak cam şişede; üzerinde 0,5 ml, 1,25 ml, 2,5 ml, 5 ml'likişaretli çizgiler bulunan 5 ml'lik kaşık ile birlikte. Sulandırıldığında 70 ml ve 100 ml süspansiyon elde edilir. Sulandırıldığında kirli beyaz renkte bir süspansiyon oluşur. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi atıkların kontrolü yönetmeliği ve Ambalaj atıklarının kontrolü yönetmeliğine uygun olarak imha edilmelidir. AUGMENTİN süspansiyonun hazırlanması:Şişenin kapağını açınız. Şişenin ağzında yer alan emniyet bandının bozulmamış olduğundan emin olunuz. Şişenin kapağını kapatınız. 1) Tüm toz dağılıp serbestçe akana kadar şişeyi sallayınız.
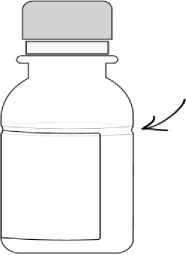
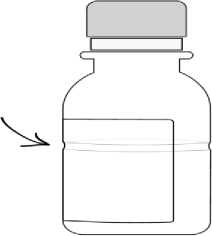
 AUGMENTİN süspansiyonlarda sulandırma çizgisi, şişesinin etrafını çevreleyen şeffaf bir girinti şeklinde gösterilmiştir. Sulandırma çizgisi (şeffaf girinti) 70 ml ve 100 ml şişelerde farklıseviyelerde bulunmaktadır.
Sulandırma Çizgisi Sulandırma Çizgisi 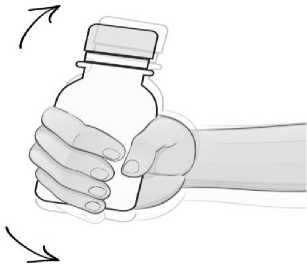 4. Şişe üzerinde sulandırma çizgisinin yaklaşık 2/3'üne denk gelecek kadar su ekleyiniz veşişeyi iyice çalkalayınız (Süspansiyon hazırlamak için önceden kaynatılmış ve soğutulmuş sutercih edilmelidir). 5. İlk sulandırılışta tam bir dağılma sağlamak için 5 dakika dinlendiriniz. 6. Daha sonra şişe üzerindeki sulandırma çizgisine gelecek kadar (kalan 1/3) su ekleyerekşişeyi yeniden çalkalayınız (Süspansiyon hazırlamak için önceden kaynatılmış ve soğutulmuşsu tercih edilmelidir). 7. Doktorunuzun her uygulama için önerdiği miktarda ilacı 5 ml'lik ölçü kaşığını kullanarakhastaya veriniz. AUGMENTİN'in rengi, kullanımı sırasında sararma gösterebilir. Bu durumun ilacın etkililiği üzerinde herhangi bir etkisi yoktur. 7. RUHSAT SAHİBİGlaxoSmithKline İlaçları San. ve Tic. A.Ş. Büyükdere Cad. No.173, 1. Levent Plaza B Blok 34394 1.Levent/İstanbulTelefon: 0212 339 44 00Faks: 0212 339 45 00 8. RUHSAT NUMARASI2019/186 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi:27.03.2019 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriAugmentin-bid 400 Mg+57 Mg/5 Ml Fort Oral Süspansiyon Hazırlamak İçin Kuru TozEtken Maddesi: Amoksisilin, Klavulanik Asit Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.