Erivedge 150 Mg Sert Kapsül Kısa Ürün BilgisiAntineoplastik ve İmmünomodülatör Ajanlar » Antineoplastik İlaçlar (Kanser İlaçları) » Diğer Kanser İlaçları » Diğer Antineoplastik (Kanser) İlaçlar KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIERIVEDGE 150 mg sert kapsül2. KALİTATİF VE KANTİTATİF BİLEŞİMBir ERIVEDGE sert kapsül için;Etkin madde:Vismodegib 150 mgYardımcı madde(ler):Laktoz monohidrat 71.5 mgYardımcı maddeler için bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMSert kapsülSiyah mürekkeple 150 mg baskılı pembe renkli opak gövde ve siyah mürekkeple VISMO baskılı gri renkli opak kapak. Kapsül boyu no:1'dir (19.0 x 6.6 mm boyutlarında). 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarERIVEDGE, cerrahi, radyoterapi ve diğer lokal tedaviler sonrası progresyon göstermiş ve tekrar bu tedavilerin uygulanamadığı veya başlangıçta bu tedavilerin uygun olmadığı sağlık kurulu raporuyla tespit edilen (sağlık kurulu bir medikal onkolog, bir dermatolog, bir radyasyon onkoloğu ve lokalizasyonuna göre ilgili bir cerrahi branş uzmanından oluşmalıdır) progresif, semptomatik lokal ileri veya metastatik cildin bazal hücreli kanserlerinde monoterapi olarak progresyona kadar kullanımı endikedir. Progresyon sonrası monoterapi veya başka tedavilerle kombinasyon şeklinde kullanılamaz.4.2. Pozoloji ve uygulama şekliERIVEDGE, 4.1 Terapötik Endikasyonlar bölümünde belirtilen hastalık alanında uzmanlaşmış bir hekim tarafından reçete edilmeli ve bu hekimin gözetimi altında kullanılmalıdır.Pozoloji:Önerilen doz günde bir kez alınan 150 mg kapsüldür.Uygulama sıklığı ve süresi:Klinik çalışmalarda, ERIVEDGE tedavisine, hastalık progresyonuna veya kabul edilemez toksisite görülene kadar devam edilmiştir. Hastanın toleransına göre 4 haftalık tedavi kesintilerine izin verilmiştir.Her hastaya göre optimum tedavi süresi değiştiğinden tedaviye devam etmenin faydaları düzenli olarak değerlendirilmelidir. Uygulama şekli:ERIVEDGE oral kullanım içindir. Kapsüller günde bir kez, aç veya tok karnına suyla bütün halde yutularak alınmalıdır (bkz. bölüm 5.2). . Hastalara veya Sağlık Mesleği Mensuplarına istenmeyen maruziyeti engellemek için hiçbir durumda kapsüller açılmamalıdır.ERIVEDGE dozunu almayı unutan veya atlayan hastalar, unutulan dozu dengelemek için çift doz almamaları konusunda uyarılmalıdır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek ve karaciğer yetmezliği olan hastalar:ERIVEDGE'in böbrek veya karaciğer yetmezliği olan hastalardaki güvenliliği ve etkililiği üzerinde çalışılmamıştır (bkz. bölüm 5.2). Bu hastalar için herhangi bir doz önerisi bulunmamaktadır. Ciddi böbrek yetmezliği ve orta veya ciddi karaciğer yetmezliği olan hastalarda yan etkiler dikkatle izlenmelidir.Pediyatrik popülasyon:ERIVEDGE'in 18 yaşından küçük çocuklarda ve adolesanlardaki güvenliliği ve etkililiği üzerinde çalışılmamıştır. Bu konuda herhangi bir veri yoktur.ERIVEDGE, 18 yaşından küçük çocuklarda ve adolesanlarda güvenlilik sebebiyle kullanılmamalıdır (bkz. bölüm 4.4 ve 5.3). Geriyatrik popülasyon:65 yaş ve üzerindeki hastalar için doz ayarlaması gerekmemektedir (bkz. bölüm 5.2). İleri evre bazal hücreli karsinomu olan ve ERIVEDGE ile yapılan 4 klinik çalışmaya katılan toplam 138 hastanın yaklaşık %40'ı 65 yaş ve üzerindedir ve bu hastalarla daha genç hastalar arasında güvenlilik ve etkililik açısından genel bir fark görülmemiştir.4.3. Kontrendikasyonlar Etkin maddeye veya bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine aşırı duyarlılığı olan kişilerde kontrendikedir. Gebe ve emziren kadınlarda kontrendikedir (bkz. bölüm 4.4 ve 4.6). ERIVEDGE Gebelik Önleme Programına (bkz. bölüm 4.4. ve 4.6) uymayan çocuk doğurma potansiyeli olan kadınlarda kontrendikedir. Sarı kantaron (St. John's wort veya Hypericum perforatum)isimli bitkisel ürünle birlikte kullanılması kontrendikedir.4.4. Özel kullanım uyarıları ve önlemleriEmbriyo-fetal ölüm veya ciddi doğum kusurlarıERIVEDGE gebe kadınlara uygulandığında embriyo-fetal ölüme veya ciddi doğum kusurlarına neden olabilir (bkz. bölüm 4.6). Vismodegib gibi Hedgehog yolu inhibitörlerinin (bkz. bölüm 5.1) çeşitli hayvan türlerinde embriyotoksik ve/veya teratojenik olduğu ve gelişmekte olan embriyoda veya fetüste kraniyofasyal anomaliler, orta hat kusurları ve uzuv bozuklukları gibi ciddi şekil bozukluklarına neden olabileceği kanıtlanmıştır (bkz. bölüm 5.3). ERIVEDGE gebelik sırasında kullanılmamalıdır. Çocuk doğurma potansiyeli bulunan kadınlar için kriterler:ERIVEDGE Gebelik Önleme Programı'nda çocuk doğurma potansiyeli bulunan kadınlar şöyle tanımlanmaktadır: - Cinsel olgunluğa sahip bir kadın o 12 ardışık ay boyunca menstrüel periyot yaşamıştır, o Histerektomi veya bilateral ooferektomi geçirmemiştir veya tıbbi olarak doğrulanmış kalıcı prematüre over yetmezliği bulunmamaktadır, o XY genotipine sahip değildir, Turner sendromu veya uterin agenezisi yoktur. o Kanser tedavisi sonrasında amenoreiktir. DanışmanlıkÇocuk doğurma potansiyeli bulunan kadınlar içinERIVEDGE Gebelik Önleme Programı'na katılmayan çocuk doğurma potansiyeli bulunan kadınlarda kontrendikedir. Çocuk doğurma potansiyeli bulunan bir kadın aşağıdaki konularda uyarılmalıdır: - ERIVEDGE doğmamış bir çocuk için teratojenik risk taşımaktadır. - Eğer gebeyse veya gebe kalmayı planlıyorsa ERIVEGDE kullanmamalıdır. - ERIVEDGE tedavisi başlamadan önceki 7 gün içinde, bir Sağlık Mesleği Mensubu tarafından yapılan gebelik testi sonucu negatif olmalıdır. - ERIVEDGE tedavisi boyunca, amenoreik olsa bile, ayda bir kez gebelik testi yaptırmalı ve testin sonucu negatif olmalıdır. - ERIVEDGE kullanırken ve son dozun tamamlanmasını takiben 24 ay süreyle gebe kalmamalıdır. - Efektif kontrasepsiyon yöntemlerine uyabilmelidir. - ERIVEDGE kullanırken, cinsel ilişkiye girmeyeceğini taahhüt etmediği sürece (mutlak perhiz) iki farklı kabul edilebilir doğum kontrol yöntemi kullanmalıdır (bkz. aşağıdaki kontrasepsiyon bölümü ve bölüm 4.6). - ERIVEDGE tedavisi boyunca veya son dozun tamamlanmasını takiben 24 ay süreyle aşağıdaki durumlardan biriyle karşılaştığı takdirde doktoruna başvurmalıdır: o Eğer gebe kalırsa veya herhangi bir nedenden dolayı gebe olabileceğini düşünüyorsa o Beklenen menstrüel periyodunu atlarsa o Cinsel ilişkiye girmeyeceğini taahhüt etmediği sürece (mutlak perhiz) kontrasepsiyon yöntemlerini kullanmayı bırakırsa o Tedavi sırasında kontrasepsiyon yöntemini değiştirmek zorunda kalırsa - ERIVEDGE tedavisi boyunca veya son dozun tamamlanmasını takiben 24 ay süreyle emzirmemelidir. Erkekler İçinVismodegib sperme geçmektedir. Gebelik sırasında muhtemel fetüs maruziyetini önlemek için erkek hastalar aşağıdaki konularda uyarılmalıdır: - Gebe bir kadınla korunmasız cinsel ilişkiye girerse, doğmamış çocuk için teratojenik risk yaratmaktadır. - Her zaman tavsiye edilen kontrasepsiyon yöntemini kullanmalıdır (bkz. aşağıdaki kontrasepsiyon bölümü ve bölüm 4.6). - ERIVEDGE tedavisi süresince ve son dozu takip eden 2 ay içinde, kadın partneri gebe kalırsa doktoruna bu konuyu bildirmelidir. Sağlık Mesleği Mensupları İçinSağlık Mesleği Mensupları, hastalarının ERIVEDGE Gebelik Önleme Programı'nın tüm koşullarını anlamasını sağlayacak şekilde hastalarını eğitmelidirler. KontrasepsiyonÇocuk doğurma potansiyeli olan kadınlarÇocuk doğurma potansiyeli olan kadınlar tedavi süresince ve son dozun tamamlanmasını takip eden 24 ay süreyle, biri yüksek ölçüde efektif bir yöntem, İkincisi bariyer yöntemi olmak üzere iki farklı kabul edilir kontrasepsiyon yöntemi kullanmalıdır. ErkeklerErkek hastalar vazektomi sonrasında dahi, tedavi boyunca ve son dozun tamamlanmasını takiben 2 ay süreyle kadınlarla cinsel ilişki sırasında her zaman (mümkünse spermisitli) prezervatif kullanmalıdır (bkz bölüm 4.6). Gebelik TestiÇocuk doğurma potansiyeli olan kadınlarda, tedavi başlamadan önceki 7 gün içinde ve tedavi süresince ayda bir kez Sağlık Mesleği Mensubu tarafından gebelik testi yapılmalıdır. Gebelik testlerinin minimum hassaslık değeri 25 mIU/mL olmalıdır. ERIVEDGE tedavisi sırasında amenore yaşayan hastalar, tedavi devam ettiği sürece ayda bir kez gebelik testi yaptırmalıdır. Çocuk Doğurma Potansiyeli Olan Kadınlar için Reçeteleme ve İlaç Verme KısıtlamalarıERIVEDGE'in başlangıç reçetesi ve ilk uygulanması, negatif gebelik sonucunun alındığı testten sonraki 7 gün içinde olmalıdır. ERIVEDGE reçeteleri, 28 günle sınırlı olmalı ve tedavinin devamı yeniden reçetelemeyi gerektirmelidir.Eğitim Materyali Sağlık Mesleği Mensuplarına ve hastalara, embriyo ve fetüste ERIVEDGE maruziyetini önlemek için yardımcı olmak amacıyla, ERIVEDGE kullanımı ile ilgili potansiyel riskleri anlatan eğitim materyali (ERIVEDGE Gebelik Önleme Programı) ruhsat sahibi tarafından sağlanacaktır. Postnatal Gelişim Üzerindeki EtkilerHayvanlarda, vismodegibin diş gelişimi üzerinde geri döndürülemez ciddi değişikliklere (odontoblastların dejenerasyonu/nekrozu, diş pulpasında sıvı dolu kist oluşumu, diş kanalında osifikasyon ve hemoraj) ve epifiz büyüme plağının erken kapanmasına yol açtığı gözlenmiştir. Bu bulgular infantlar ve çocuklar için boyun kısa kalması ve diş bozuklukları riski olduğunu göstermektedir (bkz. bölüm 4.6 ve 5.3). Kan BağışıHastalar ERIVEDGE alırken ve ERIVEDGE'in son dozunu takip eden 24 ay süreyle kan veya kan ürünleri bağışlamamalıdır. Sperm BağışıErkek hastalar ERIVEDGE alırken ve ERIVEDGE'in son dozunu takip eden 2 ay süreyle sperm bağışlamamalıdır. EtkileşimlerVismodegib için plazma konsantrasyonlarında ve etkililikte düşüş riski ortadan kaldırılamadığı için CYP indükleyicileriyle (örn.; rifampisin, karbamazepin veya fenitoin) eş zamanlı tedaviden kaçınılmalıdır (bkz. bölüm 4.5). Kutanöz skuamöz hücreli karsinom (SHK)İleri evre bazal hücreli karsinom (BHK) hastalarında kutanöz skuamöz hücreli karsinom (SHK) gelişme riski artar. ERIVEDGE ile tedavi gören ileri evre BHK hastalarında SHK vakaları raporlanmıştır. SHK'nin ERIVEDGE tedavisiyle ilişkili olup olmadığı saptanmamıştır. Dolayısıyla, ERIVEDGE alan tüm hastalar rutin olarak izlenmeli ve SHK tedavi standartlarına göre tedavi edilmelidir. İlave TedbirlerHastalar, bu ilacı hiçbir durumda başka bir kişiye vermemeleri konusunda uyarılmalıdır. Tedavi sonunda kullanılmayan kapsüller derhal uygun şekilde atılmalıdır (örneğin uygun olan durumlarda kapsüller hekime veya eczacıya geri götürülebilir). Yardımcı MaddelerERIVEDGE laktoz monohidrat içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glikoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. Bu tıbbi ürün her dozunda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani esasında sodyum içermez. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBir arada kullanılan diğer ilaçların vismodegib üzerindeki etkileri |
MedDRA Sistem Organ Sınıfı |
Çok yaygın |
Yaygın |
|
Laboratuvar bulguları |
|
Hepatik enzimlerde yükselme ** |
|
Metabolizma ve beslenme bozuklukları |
İştahta azalma |
Dehidratasyon Hiponatremi |
|
Sinir sistemi hastalıkları |
Disguzi Aguzi |
Hipoguzi |
|
Gastrointestinal hastalıklar |
Bulantı Diyare Konstipasyon Kusma |
Dispepsi Üst abdominal ağrı Abdominal ağrı |
|
Deri ve derialtı doku bozuklukları |
Alopesi Pruritus |
Döküntü Madarosis Anormal tüylenme |
|
Kas iskelet sistemi ve bağ dokusu hastalıkları |
Kas spazmları |
Artralji Uzuvlarda ağrı Sırt ağrısı Miyalji Yan ağrısı Kas iskelet sistemi ağrısı |
|
Üreme sistemi ve meme hastalıkları |
Amenore* |
|
|
Genel bozukluklar ve uygulama bölgesi rahatsızlıkları |
Kilo kaybı Halsizlik |
Ağrı Astenya |
* Yapılan klinik çalışmalarda, ileri evre bazal hücreli karsinomu olan 138 hastadan 10'u
çocuk doğurma potansiyeli bulunan kadındır. Bu kadınlardan 3'ünde (%30) amenore görülmüştür.
** Bu terimleri içerir; yükselmiş aspartat aminotransferaz, yükselmiş alkalin fosfataz, yükselmiş karaciğer enzimleri.
4.9. Doz aşımı ve tedavisi
ERIVEDGE, önerilen 150 mg günlük dozdan 3.6 kat daha yüksek dozlarda uygulanmıştır. Bu klinik çalışmalar sırasında plazma ilaç düzeyleri veya toksisitede artış görülmemiştir.5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: Antineoplastik ajanlar;ATC kodu: L01XX43
Etki mekanizması
Vismodegib, Hedgehog yolunun oral olarak uygulanan küçük moleküllü inhibitörüdür. Smoothened transmembran protein (SMO) üzerinden Hedgehog yolu sinyal iletimi, GLI transkripsiyon faktörlerinin aktivasyonuna ve nükleer lokalizasyonuna ve Hedgehog hedef genlerinin indüklenmesine neden olur. Bu genlerin birçoğu çoğalma, sağkalım ve farklılaşmada rol oynar. Vismodegib, SMO proteinine bağlanıp inhibe ederek Hedgehog sinyal transdüksiyonunu bloke eder.
Klinik etkililik ve güvenlilik
Pivotal ERIVANCE (SHH4476g) çalışması, uluslararası, tek kollu, çok merkezli, açık etiketli, 2 kohortlu bir çalışmadır. mBHK, deriden lenf nodları, akciğer, kemikler ve/veya iç organlar gibi vücudun diğer kısımlarına yayılmış BHK olarak tanımlanır. liBHK, kutanöz lezyonları cerrahi için uygun olmayan (ameliyat edilemeyen, küratif rezeksiyonun muhtemel gözükmediği birden çok kez rekürans görülen veya cerrahi işlemin önemli deformiteye veya morbiditeye neden olacağı) ve radyoterapinin başarısız veya kontrendike olduğu veya uygun olmadığı hastalardaki BHK için tanımlanmıştır. Çalışmaya kaydedilmeden önce BHK tanısı histoloji yoluyla doğrulanmıştır. En az bir ieBHK lezyonu olan ve çalışmaya dahil etme kriterlerini karşılayan Gorlin sendromu hastaları da çalışmaya alınmıştır. Hastalara günlük 150 mg oral ERIVEDGE dozuyla tedavi uygulanmıştır.
Etkililiğin değerlendirilebileceği popülasyonda medyan yaş 62'dir (hastaların %46'sı en az 65 yaşındadır), %61'i erkektir ve %100'ü beyazdır. mBHK kohortu için (n=33), cerrahi (%97), radyoterapi (%58) ve sistemik tedaviler (%30) dahil olmak üzere hastaların %97'sine daha önce tedavi uygulanmıştır. liBHK kohortu için (n=63), cerrahi (%89), radyoterapi (%27) ve sistemik/topikal tedaviler (%11) dahil olmak üzere hastaların %94'üne daha önce tedavi uygulanmıştır. Tüm hastalar için medyan tedavi süresi 12.9 aydır (aralık, 0.7 ila 36.6 aydır).
Birincil sonlanım noktası, bağımsız inceleme merkezi (IRF) tarafından Tablo 2'de açıklanan şekilde değerlendirilen objektif yanıt oranıdır. Objektif yanıt, en az 4 hafta arayla iki ardışık değerlendirmeyle belirlenen tam veya kısmi yanıt olarak
tanımlanmıştır. mBHK kohortunda, tümör yanıtı Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST) versiyon 1.0 uyarınca değerlendirilmiştir. liBHK kohortunda tümör yanıtı, harici tümörün ve ülserasyonun görsel değerlendirmesi, tümör görüntüleme (uygun ise) ve tümör biyopsisi temel alınarak değerlendirilmiştir. liBHK kohortundaki hasta şu kriterlerin en az birini karşılıyorsa ve hastada progresyon görülmediyse yanıt veren olarak kabul edilir: (1) hedef lezyonlarda başlangıca göre radyolojik olarak ölçülen lezyon boyutunda >%30 azalma [en uzun çap toplamı]; (2) gözle görülebilen hedef lezyonların boyutunda başlangıca göre en uzun çap toplamında >%30 azalma; (3) tüm hedef lezyonlarda tam ülserasyon kaybı. Ana veriler Tablo 2'de özetlenmiştir.
Tablo 2 SHH4476g Objektif Yanıt Oranı (çalışmaya son hasta alımından sonra 21 aylık takip): Etkililik-Değerlendirilebilir Hastalar*'"
|
|
IRF Değerlendirmesi ile mBHK (n = 33) |
IRF Değerlendirmesi ile liBHK (n =63) |
Araştırmacı Değerlendirmesi ile mBHK (n = 33) |
Araştırmacı Değerlendirmesi ile liBHK (n =63) |
|
Yanıt Verenler Genel Yanıt için %95 GA |
11 (% 33.3 ) (%19.2, % 51.8) |
30 (% 47.6) (% 30.5, % 56.0) |
16 (% 48.5) (% 30.8, % 66.2) |
38 (% 60.3) (% 47.2, % 71.7) |
|
Tam Yanıt Kısmi Yanıt Stabil Hastalık Progresif Hastalık * |
0 11 (% 33.3) 20 1 |
14 (% 22.2) 16 (% 25.4) 22 8 |
0 16 (% 48.5) 14 2 |
20 (% 31.7) 18 (% 28.6) 15 6 |
|
Medyan Yanıt Süresi (ay) (%95 GA) |
7.6 (5.5, 9.4) |
9.5 (7.4, 21.4) |
14.7 (5.5, DS) |
20.3# (7.4, DS) |
|
Medyan Progresyonsuz Sağkalım (ay) (95 % GA) |
9.5 (7.4, 11.1) |
9.5 (7.4, 14.8) |
9.3 (7.4, 16.6) |
12.9 (10.2, DS) |
|
Medyan Genel Sağkalım (ay) (%95 GA) |
|
|
30.9# (18.1, DS) # |
DS (DS, DS) |
|
1-yıl sağkalım oranı (%95 GA) |
|
|
% 78.0 (63.6, 92.4) |
% 93.1 (86.6, 99.6) |
* Etkililiğin değerlendirilebileceği hasta popülasyonu, arşiv doku veya temel biyopsisi bağımsız bir patolog tarafından BHK ile tutarlı olarak yorumlanan, araştırılmakta olan ilaçtan herhangi bir miktarda alan, çalışmaya katılmış tüm hastalar olarak tanımlanmıştır.
" Değerlendirilemez/kayıp veriler, 1 mBHK hastası ve 4 liBHK hastasını içermektedir.
* liBHK kohortu, aşağıdaki kriterlerden herhangi birinin karşılanması olarak tanımlanmıştır:
1) Hedef lezyonların ucundaki en uzun boyutların toplamındaki (SLD) artışın >%20 olması (radyolojik veya harici olarak görsel değerlendirme ile)
2) Hedef lezyonlarda en az iki hafta boyunca iyileşme görülmeksizin yeni ülserasyon oluşumu
3) Radyolojik veya fiziksel muayene ile yeni lezyon saptanması
4) RECIST'e göre hedef olmayan lezyonların progresyonu
* Çalışmaya son hasta alımından sonra 27 aylık takibe göre saptanan değer
** liBHK hastalarının %54'ünde, 24. haftada histopatolojik değelendirmede BHK'ye rastlanmamıştır.
Şekil 1 ve 2'deki her hasta için hedef lezyon boyutundaki maksimum azalmayı ifade eden grafiklerde (waterfall plot analizi) görüldüğü gibi, her iki kohorttaki hastaların çoğunluğunda IRF ile değerlendirildiği üzere tümör küçülmesi görülmüştür.
Şekil 1 SHH4476g Metastatik Bazal Hücreli Karsinom Kohortu
40
20
I
1
1
1
i
i
-20
I,
-40
-60
-80
I_PR
-ZZ, S D ¦ PD
-100
Not: Tümör büyüklüğü hedef lezyonların en uzun boyutlarının toplamına bağlıdır. PD: progresif hastalık, SD: stabil hastalık, PR: kısmi yanıt. Tümör büyüklüğü 0 olan üç hasta, en iyi değişim yüzdesine sahiptir; bu hastalar şekilde minimal pozitif barlarla gösterilmiştir. Dört hasta şekilden çıkarılmıştır: stabil hastalığı olan 3 hasta yalnızca hedef olmayan lezyonlarla değerlendirilmiştir ve 1 hasta değerlendirilemez durumdadır.
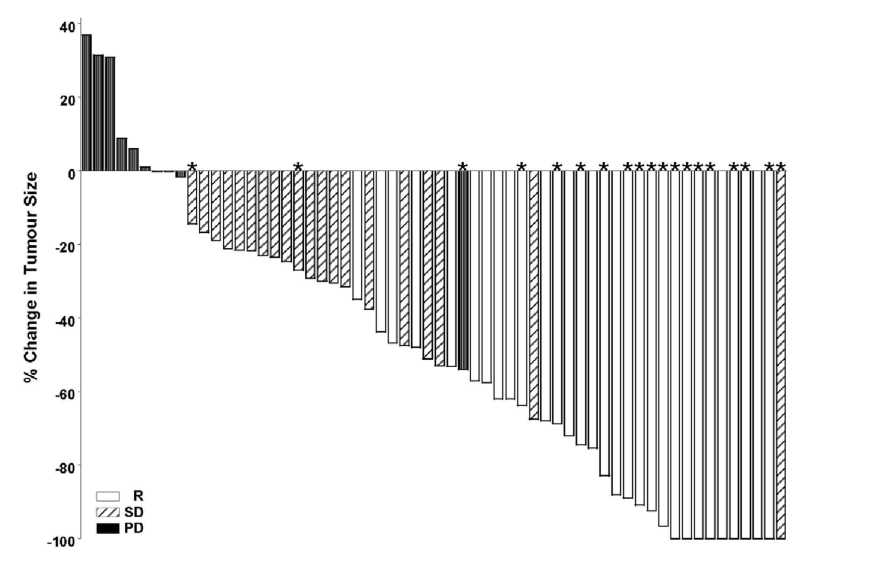 Not: Tümör büyüklüğü hedef lezyonlann en uzun boyutlarının toplamına bağlıdır. PD: progresif hastalık, SD: stabil hastalık, R: yanıt, *: ülserasyon(lar)ın tamamının kaybolması. Yanıt değerlendirmesi yukarıda anlatıldığı gibi bileşik sonlanım noktasına dayanmaktadır. Dört hastanın lezyon ölçümü yoktur ve şekle dahil edilmemiştir.
Not: Tümör büyüklüğü hedef lezyonlann en uzun boyutlarının toplamına bağlıdır. PD: progresif hastalık, SD: stabil hastalık, R: yanıt, *: ülserasyon(lar)ın tamamının kaybolması. Yanıt değerlendirmesi yukarıda anlatıldığı gibi bileşik sonlanım noktasına dayanmaktadır. Dört hastanın lezyon ölçümü yoktur ve şekle dahil edilmemiştir.Maksimum tümör azalması için süre
IRF değerlendirmesine göre, tümör küçülmesi yaşayan hastalarda, maksimum tümör küçülmesine kadar geçen medyan süre liBHK hastalarında 5.6 ay ve mBHK hastalarında 5.5 aydır. Araştırıcı değerlendirmesine göre maksimum tümör küçülmesine kadar geçen medyan süre liBHK hastalarında 6.7 ay ve mBHK hastalarında 5.5 aydır.
Kardiyak Elektrofizyoloji
60 sağlıklı gönüllüde yapılan kapsamlı bir QTc çalışmasında, ERIVEDGE terapötik dozlarının QTc aralığı üzerine etkisi görülmemiştir.
Pediyatrik popülasyon
Pediyatrik hastalarda veri bulunmamaktadır.
5.2. Farmakokinetik özellikler
Emilim:
ERIVEDGE suda çözünürlüğü düşük, oldukça geçirgen bir bileşiktir (BCS Sınıfı 2). ERIVEDGE'in tek doz mutlak biyoyararlanımı %31.8 (14.5)'dir. Tek doz 270 mg ve 540 mg ERIVEDGE sonrasında maruziyette dozla orantılı artış görülmemesinden anlaşıldığı üzere, absorpsiyon doyurulabilirdir. Klinik olarak ilgili koşullarda (kararlı durum), vismodegibin farmakokinetiği gıdalardan etkilenmez. Bu nedenle, ERIVEDGE yemeklerden bağımsız olarak alınabilir.
Dağılım:
Vismodegib için dağılım hacmi düşüktür, 16.4 ila 26.6 L aralığında değişir. Vismodegibin insan plazma proteinlerine
in vitroin vitroeks vivo
plazma proteinine bağlanma >%99'dur. Vismodegib konsantrasyonları AAG düzeyleriyle büyük oranda korelasyon gösterir, AAG ve toplam ilaç tüketim süresi paralel dalgalanma gösterir ve bağlanmamış ilaç düzeyleri sürekli olarak düşüktür.Biyotransformasyon:
Vismodegib, metabolizma ve ana ilacın atılımının birleşimiyle yavaşça elimine edilir. Vismodegib plazmada baskındır, toplam dolaşımdaki ilaçla ilgili bileşenlerin %98'inden fazlasını temsil eden konsantrasyona sahiptir. Vismodegibin insanlardaki metabolik yolları oksidasyon, glukuronidasyon ve yaygın olmayan bir piridin halkası bölünmesini içerir. Dışkıda bulunan, en sık görülen iki oksidatif metabolit rekombinant CYP2C9 ve CYP3A4/5 tarafından
in vitro
üretilir.Eliminasyon:
Radyoaktif olarak işaretli ilacın oral uygulanmasını takiben vismodegib absorbe edilir ve metabolizma ile ana ilacın atılmasının birleşimiyle yavaşça elimine edilir; bunun çoğunluğu dışkıda geri kazanılır (uygulanan dozun %82'si) uygulanan dozun %4.4'ü idrarda geri kazanılır. Vismodegib ve ilişkili metabolik ürünleri esasen karaciğer yoluyla elimine edilir. Tek oral dozu takiben vismodegib, 12 günlük terminal yarı ömre sahiptir.
Vismodegibin kararlı halde gözle görülür yarılanma ömrünün, devamlı günlük dozlama ile 4 gün olduğu belirlenmiştir. Devamlı günlük dozlama ile, vismodegib toplam plazma konsantrasyonlarında 3 kat akümülasyon olmaktadır.
Vismodegib
in vitroin vivo
olarak gerçekleşebileceği ihmal edilemez.Doğrusallık/ doğrusal olmayan durum:
Sürekli günde bir kez dozlama sonrasında, vismodegib farmakokinetiğinin doğrusal olmadığı görülür. Tek doz yarı ömrü dikkate alındığında, hastalardaki kararlı durum plazma konsantrasyonları beklenenden hızlı elde edilir (genellikle sürekli günlük dozlamanın yaklaşık 7. gününe kadar) ve beklenenden düşük birikim görülür. Kararlı durumda vismodegibin görünen yarı ömrünün sürekli günlük dozlama durumunda 4 gün olduğu tahmin edilmektedir.
Özel popülasyonlara ilişkin ek bilgiler:
Geriyatrik hastalar
Geriyatrik hastalara ilişkin sınırlı veri mevcuttur. iBHK'lı hastalarda yapılan klinik çalışmalarda hastaların yaklaşık %40'ı geriyatrik yaştadır (65 yaşından büyük). Popülasyon farmakokinetik analizi, yaşın vismodegibin kararlı durum konsantrasyonu üzerinde klinik olarak anlamlı bir etkisi olmadığını göstermektedir (bkz. bölüm 4.2).
Cinsiyet
121 erkek ve 104 kadından alınan verilerin toplandığı popülasyon farmakokinetik analizine göre, cinsiyet vismodegib farmakokinetiğini etkilememektedir.
Irk
Beyaz ırk dışındaki hastalarda sınırlı veri mevcuttur. beyaz ırktanolmayan hastaların sayısı toplam popülasyonun (6 Siyahi, 219 Beyaz) %3'ünden azını kapsadığı için, popülasyon farmakokinetiğinde ırk bir alt kol olarak incelenmemiştir.
Böbrek yetmezliği olan hastalar
Ciddi böbrek yetmezliği olan hastalara ilişkin yeterli veri henüz bulunmamaktadır. Bu sebeple, ciddi böbrek yetmezliğinin etkisi göz ardı edilemez. Beş klinik çalışmadan elde edilen birleşik verilerin popülasyon farmakokinetik analizine göre, böbrek fonksiyonunun (kreatinin klerensi) vismodegib farmakokinetiğini etkilemediği görülmüştür (bkz. bölüm 4.2). Dolayısıyla, hafif veya orta şiddette renal yetmezlik etkisi beklenmemektedir.
Karaciğer yetmezliği olan hastalar
Sınırlı veriler, hafif karaciğer yetmezliği olan hastalarda vismodegib maruziyetinin artmadığını göstermektedir. Mevcut veriler orta ve ciddi karaciğer yetmezliği olan hastalarda bir sonuca varmak için yetersizdir.
Pediyatrik hastalar
Pediyatrik hastalara ilişkin farmakokinetik veriler yetersizdir.
5.3. Klinik öncesi güvenlilik verileri
ERIVEDGE'in klinik öncesi güvenlilik profili farelerde, sıçanlarda ve köpeklerde değerlendirilmiştir.Tekrarlı doz toksisitesi
Genel olarak, ERIVEDGE'in sıçanlarda ve köpeklerde yapılan tekrarlı doz toksisitesi çalışmalarındaki tolerabilitesi, vücut ağırlığı artışında ve yiyecek tüketiminde azalma dahil spesifik olmayan toksisite belirtileriyle kısıtlanmıştır. Klinik açıdan önemli maruziyetlerdeki ilave bulgular: dışkı değişimleri, iskelet kasının seğirmesi veya tremor; alopesi; patilerde şişme, foliküler hiperkeratoz ve enflamasyon ile LDL ve HDL kolesterol artışı olmuştur. Klinik açıdan önemli maruziyetlerde bazı köpeklerde hematokrit veya trombosit sayısında azalma gözlenmiştir; bununla birlikte, etkilenen hayvanların kemik iliğinde primer etkiye ilişkin bir kanıt saptanmamıştır.
Karsinojenite
Vismodegibin karsinojenitesini değerlendirmeye yönelik özel nonklinik çalışmalar gerçekleştirilmemiştir. Ancak, 26 haftalık sıçan toksisite çalışmasında pilomatriksoma (benign kutanöz neoplazma) gözlenmiştir. Pilomatriksoma ERIVEDGE klinik çalışmalarında bildirilmemiştir ve dolayısıyla bu bulgunun insanlar için önemi açık değildir.Mutajenite
İn vitroin vitro
sıçan kemik iliği mikronükleus testinde genotoksisiteye dair bir kanıt yoktur.Fertilite
ERIVEDGE'in doğurganlığı etkileme potansiyelini değerlendirmek için özel nonklinik çalışmalar yapılmamıştır. Ancak, sıçanlar ve köpekler üzerinde yapılan çalışmalardan elde edilen veriler, ERIVEDGE tedavisi sonucunda erkek ve kadın doğurganlığının geri döndürülemez bir şekilde etkilenebileceğini göstermektedir. Germ hücre dejenerasyonu ve hipospermi, 4 haftalık köpek toksisitesi çalışmasında gözlenmiş ancak daha yaşlı köpeklerde yapılan daha uzun süreli çalışmalarda gözlenmemiştir. 26 haftalık sıçan toksisitesi çalışmasında; overde corpus luteum sayısında azalmanın ve ortalama hareketli sperm oranında azalmanın 8 haftalık iyileşme dönemi sonunda geri döndürülebilir olduğu gösterilememiştir.
Teratojenite
Gebe sıçanlara organogenez sırasında vismodegib uygulanan bir embriyofetal gelişim çalışmasında, vismodegib plasentayı geçmiştir ve konseptüs için ciddi düzeyde toksiktir. Hastalarda tipik kararlı hal maruziyetinin %20'sine denk gelen bir dozda anne hayvanların fetüslerinde kraniyofasiyal anormallikler, açık perine ve eksik ve/veya birleşik parmak gibi şekil bozuklukları gözlenmiştir ve daha yüksek dozlarda %100 embriyoletalite vakası görülmüştür.
Postnatal gelişim
Vismodegibin postnatal gelişim üzerindeki potansyiel etkisini değerlendirmek için özel çalışmalar yapılmamıştır. Ancak, sıçan toksisite çalışmalarında, klinik maruziyetlerde postnatal gelişim risk ile ilişkili diş gelişimi üzerinde geri döndürülemez ciddi değişiklikler ve femoral epifiz plağının erken kapandığı gözlenmiştir.
6. FARMASÖTİK ÖZELLİKLERİ
6.1. Yardımcı maddelerin listesi
Kapsül içeriği
Mikrokristalin selüloz Laktoz monohidrat Sodyum lauril sülfat PovidonSodyum nişasta glikolat (Tip A)
Talk
Magnezyum stearat
Kapsül kılıfı
Demir oksit kırmızısı (E172)
Titanyum dioksit (E171)
Jelatin
Baskı mürekkebi
Şellak cilaSiyah demir oksit (E172)
6.2. Geçimsizlikler
Geçerli değildir.6.3. Raf ömrü
24 ay6.4. Saklamaya yönelik özel tedbirler
30 °C'nin altındaki sıcaklıklarda saklayınız.6.5. Ambalajın niteliği ve içeriği
28 kapsül içeren, çocuk korumalı çevirmeli kapağı olan HDPE şişe. Her bir kutuda bir şişe vardır.6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir.7. RUHSAT SAHİBİ
Roche Müstahzarlan Sanayi Anonim Şirketi,Güney Plaza Eski Büyükdere Caddesi No:13 34398 Maslak/İstanbul Tel: (0212) 366 9000 Faks: (0212) 285 2200
8. RUHSAT NUMARASI
2014/3359. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ
İlk ruhsat tarihi: 22 Nisan 2014 Ruhsat yenileme tarihi:
10. KÜB'ÜN YENİLENME TARİHİ
16
İlaç Bilgileri
Erivedge 150 Mg Sert Kapsül
Etken Maddesi: Vismodegib
Atc Kodu: L01XX43
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.