Clexane 8000 Anti-xa/0.8 Ml Kullanıma Hazie Enjek... Kısa Ürün BilgisiKan ve Kan Yapıcı Organlar » Antitrombotikler » Antitrombotik İlaçlar » Heparin » Enoksaparin Sodyum KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADICLEXANE 8000 anti-Xa IU/0.8 mİ kullanıma hazır enjektör2. KALİTATİF VE KANTİTATİF BİLEŞİMİ»Etkin madde:Enoksaparin sodyum: 80 mg (8000 anti-Xa IU'ya eşdeğer)Yardımcı madde:Yardımcı maddeler için 6.1 'e bakınız.3. FARMASÖTİK FORMKullanıma hazır enjektör Berrak, renksiz veya açık sarı çözelti4. KLİNİK ÖZELLİKLER4.1 TerapÖtik endikasyonlar Venöz tromboemboli profılaksisinde (venlerde pıhtı oluşumunun önlenmesi) özellikle bazı işlemler, örneğin ortopedik veya genel cerrahi sonrası Kalp yetmezliği, solunum yetmezliği, çeşitli enfeksiyonlar ve romatizmal hastalıklan içeren akut medikal hastalıklar nedeniyle yatağa bağlı hastaların venöz tromboembolisinin profılaksisinde Hemodiyaliz sırasında ekstrakorporeal dolaşımda tromboz oluşumunun önlenmesinde Beraberinde pulmoner emboli gelişmiş veya gelişmemiş derin ven trombozunun tedavisinde Kararsız angina ve Q dalgasız (miyokard nekrozu bulunmasına karşın EKG de Q dalgasının gelişmediği) miyokard infarktüsü tedavisinde aspirin ile birlikte verilmelidir. Medikal olarak tedavi edilen ya da daha sonra Perkütan Koroner Girişim uygulanan hastalar da dahil olmak üzere, akut ST-segment Yükselmeli miyokard infarktüsünün (STEMI) tedavisi. 4.2 Pozoloji ve uygulama şekli Pozoloj i/uygula m a sıklığı ve süresi:- Cerrahi hastalarında venöz tromboz profilaksisi:Orta derecede tromboemboli riski olan hastalarda (örn. abdominal cerrahi), önerilen enoksaparin sodyum dozu subkütan enjeksiyon yoluyla günde bir kez 20 mg ya da 40 mg'dır. Genel cerrahi girişimlerinde, ilk doz operasyondan 2 saat önce uygulanmalıdır.Yüksek derecede tromboemboli riski olan hastalarda (öm. ortopedik cerrahi) subkütan enjeksiyon yoluyla verilmesi önerilen enoksaparin sodyum dozu, cerrahiden 12 saat önce başlatılan ve cerrahiden 12-24 saat sonra devam edilen günde bir kez 40 mg'dır. Enoksaparin tedavisi genellikle, ortalama 7-10 gün süreyle uygulanır. Bazı durumlarda daha uzun süreli tedavi gerekebilir ve tedaviye hasta trombo-emboli riski altında olmaya devam ettiği ve yatağa bağlı kaldığı sürece devam edilmelidir. İlk tedaviyi takiben günde bir kez 40 mg ile 3 hafta süreyle devam ettirilen tedavinin ortopedik cerrahide yararlı olduğu kanıtlanmıştır. Spinal/Epidural Anestezi ve Perkütan Koroner Revaskülarizasyon girişimlerinde doz uygulama aralıklarıyla ilgili özel öneriler için: bkz. Özel kullanım uyarıları ve önlemleri bölümü. - Medikal hastalarda venöz tromboemboli profil aksisi:Önerilen doz subkütan enjeksiyon yoluyla günde bir kez 40 mg'dır.Enoksaparin sodyum ile tedavi en az 6 gün süreyle uygulanır ve hasta tam hareket kazanana kadar, en fazla 14 gün süreyle devam edilir. -Hemodiyaliz sırasında ekstrakorporeal dolaşımda tromboz oluşumunun engellenmesi:Önerilen doz 1 mg/kg'dır. Yüksek hemoraji riski taşıyan hastalar için, doz ikili vasküler giriş için 0.5 mg/kg'a ve tek vasküler giriş için 0.75 mg/kg'a azaltılmalıdır. Hemodiyaliz sırasında enoksaparin sodyum, diyaliz seansının başında dolaşımın arteriyel koluna uygulanmalıdır. Uygulanan bu dozla 4 saatlik bir seans için genellikle yeterli bir etki sağlanabilmektedir. Fibrin halkalarının gözlendiği durumlarda 0.5 ila 1 mg/kg'lık ek bir doz uygulanabilir.-Pulmoner emboli ile birlikte ya da tek başına derin ven trombozlarının tedavisinde:Enoksaparin sodyum 1.5 mg/kg günde tek enjeksiyon olarak ya da 12 saatte bir 1 mg/kg doz subkütan olarak verilmelidir. Komplike tromboembolik hastalıklarda 1 mg/kg günde 2 kez verilmesi önerilir. Tedavi süresi genelde ortalama 10 gündür. Uygun olduğunda oral antikoagülan tedavisine başlanmalı ve enoksaparin tedavisi terapötik antikoagülan etki sağlanana kadar sürdürülmelidir.-Kararsız angina ve -Q dalgasız miyokard infarktüsünün tedavisi:Önerilen enoksaparin sodyum dozu, oral aspirin (günde bir kez 100 - 325 mg) ile birlikte subkütan enjeksiyon yoluyla 12 saatte bir 1 mg/kg'dır.Bu hastalarda enoksaparin sodyum ile tedavi en az 2 gün süreyle uygulanmalı ve hastanın durumu stabilize olana kadar devam ettirilmelidir. Normal tedavi süresi 2-8 gündür. - Akut ST-segment Yükselmeli Miyokard İnfarktüsünün (STEMİ) Tedavisi:Enoksaparin sodyumun, 30 mg'lık tek bir IV bolus ile birlikte subkütan yolla uygulanan 1 mg/kg'lık dozun ardından subkütan yolla 12 saatte bir 1 mg/kg (yalnızca ilk iki subkütan dozunun her biri için maksimum 100 mg, ardından geriye kalan dozlar için 1 mg/kg'lık doz) dozunda uygulanması önerilmektedir. Yetmiş beş yaşın üzerindeki hastalarda önerilen dozaj için, Yaşlılar bölümüne bakınız.Bir trombolitik (fibrine spesifik ya da fibrine spesifik olmayan) ile birlikte uygulandığında, enoksaparin sodyum, fıbronilitik tedavinin başlangıcının 15 dakika öncesi ila 30 dakika sonrası arasında verilmelidir. STEMI olduğu belirlendiğinde, tüm hastalara hemen asetilsalisilik asit (ASA) verilmeli ve kontrendike olmaması durumunda ASA uygulamasına (günde bir kez 75 ila 325 mg) devam edilmelidir. Enoksaparin sodyum tedavisinin 8 gün boyunca ya da hasta taburcu edilinceye kadar sürdürülmesi hangisinin daha önce gerçekleştiğine bağlı olarak önerilmektedir. Perkütan Koroner Girişim uygulanan hastalar için: subkütan yolla uygulanan son enoksaparin sodyum dozunun balonun şişirilmesinden 8 saatten daha kısa bir süre önce verilmiş olması durumunda herhangi bir ek doz uygulaması gerekli değildir, subkütan yolla uygulanan son enoksaparin sodyum dozunun balonun şişirilmesinden 8 saatten daha uzun bir süre önce verilmiş olması durumunda, IV bolus şeklinde 0.3 mg/kg'lık bir enoksaparin sodyum dozu uygulanmalıdır. Uygulama şekli:Subkütan enjeksiyon:Enoksaparin sodyum, venöz tromboembolik hastalığın önlenmesi, derin ven trombozu tedavisi, kararsız anjina ve Q dalgasız miyokard infarktüsü tedavisi ve akut ST-segment Yükselmeli Miyokard İnfarktüsü tedavisi için yalnızca subkutanöz enjeksiyon yoluyla uygulanır.IV bolus enjeksiyonu:Akut ST-segment Yükselmeli Miyokard İnfarktüsü için, tedaviye tek bir IV bolus enjeksiyonla başlanmalı ve bunun ardından hemen bir subkütan enjeksiyon uygulanmalıdır.Arteryel hat enjeksiyonu:Hemodiyaliz sırasında vücut dışı dolaşımda trombus oluşumunu önlemek amacıyla, bir diyaliz devresinin arteryel hattı yoluyla uygulanır.İntramüsküler yolla uygulanmamalıdır. Tek kullanımlık enjektör hemen kullanıma hazırdır. Subkütan enjeksiyon tekniği:Önceden doldurulmuş tek kullanımlık şırıngalar derhal kullanım için hazırdır.Enjeksiyon tercihen hasta yatar durumdayken yapılmalıdır. Enoksaparin sodyum derin subkütan enjeksiyon yoluyla uygulanır. Önceden doldurulmuş 20 mg ve 40 mg şırıngaları kullanırken ilaç kaybını önlemek için enjeksiyondan önce şırıngadan hava kabarcıklarını dışan atmaya çalışmayınız. Uygulama sol ve sağ anterolateral veya posterolateral abdominal duvar arasında dönüşümlü olarak yapılmalıdır. İğne başparmak ile işaret parmağı arasında bastırmadan tutulan deri kıvrımına dikey olarak sonuna kadar batırılır. Bu deri kıvrımı enjeksiyon tamamlanıncaya kadar bırakılmamalıdır. Jygulamadan sonra enjeksiyon yerini ovuşturmayınız._Basit ve güvenli şekilde enjekte etmek için
Uygulama biçimi ve yolu DERİ ALTINA (hemodiyaliz endikasyonu yoksa). Kas içinden enjekte etmeyiniz. ırınganın güvenlik :apağmı çekip çıkarın. 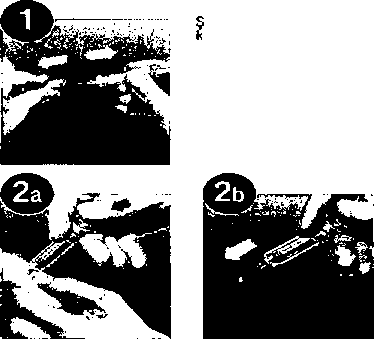 Enjekte edilecek Taşma varsa, enjeksiyon
Enjekte edilecek Taşma varsa, enjeksiyonmiktarı hastanın ağırlığına öncesinde fazlalılığı giderin, göre ayarlayın. Taşma olmadıkça şırıngayı enjeksiyon öncesinde boşaltmayın, enjeksiyon işlemini uygulayın. 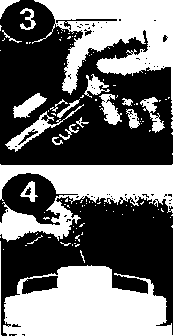 Şırınganın sonuna gelindiğinde, güvenlik sistemi hareketin devamında aktif hale gelir, böylece, hastaya sıkıntı vermeden ıslak iğne tamamen korunur. Uyarı:Güvenlik sistemi ancak şırınga tamamen boşaldığında aktif hale gelir.Enjeksiyon işlemi tek el ile yapılır. Böylece iğnenin kazara batması önlenmiş olur. Enjeksiyon tercihen, uzanmış vaziyetteki bir hastaya, gerek sağdan gerek soldan, anterolateral ve posterolateral karın kaslarının deri altı hücre dokusuna uygulanır İğne, uygulayanın başparmak ile işaret parmağı arasına aldığı deri krvrımına, sıyırır şekilde değil de dikey olarak batırılır. Enjeksiyon boyunca deri kıvrımı başparmak ve işaret parmağı arasında sabit şekilde tutulur.
Clexane Enoksaparinİntravenöz (Bolus) Enjeksiyon Tekniği (yalnızca akut STEMI endikasyonu için):Enoksaparin sodyum bir intravenöz hat yoluyla uygulanmalıdır. Diğer ilaçlarla karıştırılmamalı ya da birlikte uygulanmamalıdır. Enoksaparin sodyumun diğer ilaçlarla olası karışımım önlemek üzere, ilacın giriş yerini temizlemek amacıyla, intravenöz bolus şeklinde enoksaparin sodyum uygulamasından önce ve sonra seçilen intravenöz giriş yeterli miktarda serum fizyolojik ya da dekstroz çözeltisiyle yıkanmalıdır. Enoksaparin sodyum, sudaki %5 dekstroz ya da normal serum fizyolojik çözeltisi (%0.9) ile güvenle uygulanabilir. İlk 30-mg bolusİlk 30 mg bolus için, dereceli bir enoksaparin sodyum kullanıma hazır enjektör kullanarak, enjektörde yalnızca 30 mg (0.3 mİ) kalacak şekilde fazla hacmi dışarıya boşaltınız. Daha sonra bu 30 mg doz intravenöz hat içine doğrudan enjekte edilebilir. Son subkütan uygulama balon şişmeden >8 saat önce verildiğinde,için ek bolusPerkütan Koroner Girişim ile tedavi edilmekte olan hastalar için, eğer son subkütan uygulama balon şişmeden >8 saat önce verilmişse, 3 mg/kg'lik ek bir bolus uygulanmalıdır, (bkz. bölüm 4.2: Akut STEMİ Tedavisi).Enjekte edilecek küçük hacmin doğruluğunu garanti etmek için, ilacın 3 mg/ml'ye seyreltilmesi önerilmektedir. 60 mg enoksaparin sodyum kullanıma hazır enjektör kullanılarak 3 mg/ml'lik bir çözelti elde etmek için, aşağıdaki şekilde 50 ml'lik bir infüzyon torbası kullanılması önerilmektedir (normal serum fizyolojik çözeltisi (%0.9) ya da su içinde %5 dekstroz kullanarak): Bir şırıngayla infüzyon torbasından 30 mİ çekin ve bu sıvıyı atın. 60 mg enoksaparin sodyum kullanıma hazır enjektörün bütün içeriğini torbada kalan 20 ml'nin içine enjekte edin. Torbanın içeriğini nazikçe karıştırın, intravenöz hattın içine uygulamak için gereken seyreltilmiş çözelti hacmini bir şırınga ile çekin. Seyreltme tamamlandıktan sonra, enjekte edilecek miktar aşağıdaki formül kullanılarak [Seyreltilmiş çözeltinin hacmi (mİ) = Hastanın ağırlığı (kg) x 0.1] ya da aşağıdaki tablo kullanılarak hesaplanabilir. Seyreltinin kullanımdan hemen önce hazırlanması önerilmektedir. Seyreltme tamamlandıktan sonra intravenöz hat yoluyla enjekte edilecek hacim
Özel popülasyonlara ilişkin ek bilgiler:Böbrek Yetmezliği:(bkz, bölüm 4.4: Böbrek Yetmezliği).Ağır böbrek Yetmezliği:Ağır böbrek yetmezliği (kreatinin klirensi <30 ml/dakika) olan hastalar için aşağıdaki tablolara göre bir doz ayarlaması gerekir, zira bu hastalarda enoksaparin sodyuma maruz kalma anlamlı ölçüde artmaktadır.Terapötik dozaj sınırları için aşağıdaki dozai ayarlamaları önerilmektedir: |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Standart Doz |
Ağır böbrek fonksiyon bozukluğu |
|
Günde iki kez subkütan yolla 1 mg/kg |
Günde bir kez subkütan yolla 1 mg/kg |
|
Günde bir kez subkütan yolla 1.5 mg/kg |
Günde bir kez subkütan yolla 1 mg/kg |
|
<75 yaşındaki akut STEMI hastalarının tedavisi için | |
|
30 mg'lık tek bir IV bolus ile birlikte subkütan yolla uygulanan 1 mg/kg'lık doz, ardından subkütan yolla günde iki kez 1 mg/kg (ilk iki subkütan dozunun her biri için max 100 mg) |
30 mg'lık tek bir IV bolus ile birlikte subkütan yolla uygulanan 1 mg/kg'lık doz, ardından subkütan yolla günde bir kez 1 mg/kg (yalnızca ilk subkütan dozu için max 100 mg) |
|
>75 yaşındaki akut STEMI hastalarının tedavisi için | |
|
Başlangıçta bolus dozu uygulanmaksızın subkütan yolla günde iki kez 0.75 mg/kg (ilk iki subkütan dozunun her biri için max 75 mg) |
Başlangıçta bolus dozu uygulanmaksızın subkütan yolla günde bir kez 1 mg/kg (yalnızca ilk subkütan dozu için max 100 mg) |
Profilaktik dozaj sınırları için aşağıdaki dozaj ayarlamaları önerilmektedir:
Standart doz uygulaması |
Ağır böbrek yetmezliği |
|
Günde bir kez subkütan yolla 40 mg |
Günde bir kez subkütan yolla 20 mg |
|
Günde bir kez subkütan yolla 20 mg |
Günde bir kez subkütan yolla 20 mg |
Hafif ve Orta Dereceli Böbrek Yetmezliği:
Orta dereceli böbrek yetmezliği (kreatinin klerensi 30-50 ml/dakika) ve hafif böbrek yetmezliği (kreatinin klerensi 50-80 ml/dakika) olan hastalarda herhangi bir doz ayarlaması önerilmemekle birlikte, dikkatli klinik izlemenin yapılması tavsiye edilmektedir.Karaciğer Yetmezliği:
Klinik araştırmalar bulunmadığından, karaciğer yetmezliği olan hastalarda dikkatli olunmalıdır.Pediyatrik popülasy on:
Enoksaparin sodyumun çocuklardaki güvenilirlik ve etkinliği kanıtlanmamıştır.Geriyatrik popülasyon:
Yetmiş beş yaşın üzerindeki yaşlı hastalarda, akut ST-segment Yükselmeli Miyokard Infarktüsü tedavisi için başlangıç IV bolus dozu uygulanmamalıdır. Başlangıç dozu subkütan yolla 12 saatte bir uygulanan 0.75 mg/kg olmalıdır (yalnızca ilk İki subkütan dozunun her biri için maksimum 75 mg, ardından geriye kalan dozlar için 0.75 mg/kg'lık doz).Diğer endikasyonlar için böbrek fonksiyon bozukluğunun olmaması halinde yaşlılarda herhangi bir doz azaltımına gerek yoktur (bkz. bölüm 4.4: Yaşlılarda Hemoraji, bölüm 4.2: Böbrek yetmezliği).
4.3. Kontrendikasyonlar
Enoksaparin sodyum, heparin ya da diğer düşük molekül ağırlıklı heparinler dahil olmak üzere heparin türevlerine karşı aşırı duyarlılık,Aktif majör kanama ve yakın tarihli hemorajik inme dahil olmak üzere yüksek kontrolsüz hemoraji riski taşıyan hastalıklar.
4.4 Özel kullanım uyarıları ve önlemleri
Genel:Düşük molekül ağırlıklı heparinler üretim metodu, molekül ağırlığı, spesifik anti-Xa aktivitesi, ünite ve doz açısından eşdeğer olmadıklarından birbirlerinin yerine kullanılmamalıdır. Farmakokinetik özelikler ve bununla ilişkili biyolojik aktivitelerde (örn. anti-trombin aktivitesi ve trombosit etkileşimleri) farklılıklara yol açar. Her ürünün spesifik kullanım şekline özellikle dikkat edilmesi gerekmektedir.
Spinal/Epidural Anestezi:
Enoksaparin sodyum ve spinal/epidural anestezinin birlikte kullanımı ile uzun süreli ya da kalıcı paraliziye yol açan nöroaksiyel hematom olguları bildirilmiştir. Bu olaylar günde bir kez 40 mg veya daha düşük enoksaparin sodyum dozaj rejimleri ile nadir olarak görülmektedir. Bu risk, daha yüksek enoksaparin sodyum dozaj rejimleri, postoperatif yerleşik kateterlerin kullanımı ya da hemostazı etkileyen NSAİ ilaçlar gibi ilave ilaçların birlikte kullanımıyla daha büyüktür (bkz. bölüm 4.5). Ayrıca travma tik ya da tekrarlanan nöroaksiyel ponksiyonda ya da spinal operasyon veya spinal biçim bozukluğu hikayesi olan hastalarda da bu riskin arttığı düşünülmektedir.
Hekimin epidural/spinal anestezi bağlamında antikoagülan uygulamaya karar vermesi halinde, belde orta hatta ağrı, sensoryel ve motor defisitler (alt ekstremitelerde uyuşukluk veya zayıflık), bağırsak ve/veya mesane disfonksiyonu gibi nörolojik bozukluk belirti ve semptomlarını saptamak üzere olağanüstü dikkat harcanmalı ve sık izleme yapılmalıdır. Hastalara yukarıdaki belirti ve semptomların herhangi birini yaşamaları halinde derhal hekime bildirmeleri talimatı verilmelidir. Spinal hematom belirti veya semptomlanndan kuşkulanılması halinde, ivedilikle tanı konulmalı ve omurilik dekompresyonu dahil olmak üzere tedaviye başlanılmalıdır.
Hekim, tromboprofılaksi için antikoagüle olmuş ya da antikoagüle edilmiş hastalarda nöroaksiyel müdahaleden önce potansiyel yarara karşı riski göz önünde bulundurmalıdır. Enoksaparin sodyum ile epidural ya da spinal anestezinin birlikte kullanımından kaynaklanan potansiyel kanama riskini azaltmak için ilacın farmakokinetik profili dikkate alınmalıdır (bkz. bölüm 5.2). Kateterin yerleştirilmesi ya da çıkarılması için en uygun zaman enoksaparinin antikoagülan etkisinin düşük olduğu zamandır.
Bir kateterin yerleştirilmesi veya çıkarılması enoksaparin sodyumun DVT profılaktik dozlarının uygulanmasından sonra 10-12 saat süreyle geciktirilmelidir. Daha yüksek enoksaparin sodyum dozları (günde iki kez 1 mg/kg ya da günde bir kez 1.5 mg/kg) alan hastalar için bu sürenin daha uzun (24 saat) olması gerekecektir. Bir sonraki enoksaparin sodyum dozu kateter çıkarıldıktan en az 2 saat sonra verilmelidir.
Heparin kaynaklı trombositopeni:
Enoksaparin sodyum trombozun eşlik ettiği ya da etmediği heparin kaynaklı trombositopeni öyküsü bulunan hastalarda çok dikkatli kullanılmalıdır.
Heparin kaynaklı trombositopeni riski birkaç yıl süreyle devam edebilir. Eğer heparin kaynaklı trombositopeni öyküsünden kuşkulanılıyorsa, in vitro trombosit agregasyonu testlerinin sınırlı öngörücü değeri bulunmaktadır. Böyle bir olguda enoksaparin sodyum kullanma kararı ancak bu alanda bir uzman ile konsültasyon yapılarak verilmelidir.
Perkütan koroner revaskülarizasyon girişimleri:
Kararsız anjina, Q dalgasız mıyokard infarktüsü ve akut ST-segment yükselmeli miyokard infarktüsü tedavisi sırasında alet kullanılarak uygulanan vasküler girişimi takiben kanama riskini minimum düzeye indirmek için CLEXANE enjeksiyon dozları arasında bırakılması önerilen zaman aralıklarına kesin olarak uyulmalıdır. Bu, Perkütan Koroner Girişim sonrası ponksiyon bölgesinde hemostaz elde edilmesi açısından önemlidir. Bir kapatma aleti kullanılması durumunda, kılıf hemen çıkarılmalıdır. El ile yapılan bir kompresyon yönteminin kullanılması durumunda, kılıf IV/SC yolla uygulanan son enoksaparin sodyum enjeksiyonundan 6 saat sonra çıkarılmalıdır. Enoksaparin sodyum tedavisinin sürdürülmesi durumunda, planlanan bir sonraki doz kılıfın çıkarılmasının üzerinden 6 ila 8 saat geçmeden verilmemelidir. Girişim bölgesi kanama veya hematom oluşumu belirtileri açısından gözlenmelidir.
Kalp kapak protezi olan gebe kadınlar:
Mekanik kalp kapak protezi olan gebe kadınlarda tromboprofılaksi için CLEXANE enjeksiyonunun kullanımı yeterli olarak çalışılmamıştır. Tromboemboli riskini azaltmak amacıyla mekanik kalp kapak protezleri olan gebe kadınlara enoksaparin (günde iki kez 1 mg/kg) verilen bir klinik araştırmada, 8 kadından 2'sinde kapak blokajı görülmüş ve bu sebeple anne ile bebek kaybedilmiştir. Tromboprofılaksi amacı ile enoksaparin uygulanan mekanik kalp kapak protezli gebe kadınlarda pazarlama sonrası raporlarda izole protez tromboz vakaları bildirilmiştir. Mekanik kalp kapak protezi olan gebe kadınlar tromboembolizm için yüksek risk altında bulunabilirler.
Laboratuvar testleri:
Venöz tromboemboli profılaksisi için kullanılan dozlarda, enoksaparin sodyum kanama süresi ve global kan koagülasyon testlerini anlamlı olarak etkilememektedir ve aynca trombosit agregasyonu ya da fıbrinojenin trombositlere bağlanması üzerinde herhangi bir etkisi bulunmamaktadır. Daha yüksek dozlarda, aPTT'de (aktif parsiyel tromboplastin zamanı) ve ACT'de (aktif pıhtılaşma zamanı) artışlar görülebilir. aPTT ve ACT'deki artışlar ile enoksaparin sodyumun artan antitrombotİk aktivİtesİ arasında doğrusal bir korelasyon yoktur ve dolayısıyla enoksaparin sodyumun aktivitesini izlemek için uygun ve güvenilir değildirler.
İntramüsküler uygulanmamalıdır.
Hemoraji
Tüm diğer antikoagülanlarda olduğu gibi kanama her yerde oluşabilir (Bkz bölüm 4.8). Kanama oluşursa hemorajinin kaynağı araştırılmalı ve uygun tedavi yapılmalıdır.
Tüm diğer antikoagülan tedavilerinde olduğu gibi enoksaparin sodyum da, kanama potansiyelinin arttığı aşağıdaki durumlarda dikkatle kullanılmalıdır:
- bozulmuş hemostaz,
- peptik ülser öyküsü,
- yakın tarihli iskemik inme,
- kontrolsüz ağır arteriyel hipertansiyon,
- diyabetik retinopati,
- yakm tarihli nörolojik ya da oftalmolojik cerrahi,
- Hemostazı etkileyen ilaçların birlikte kullanımı (Bkz. bölüm 4.5).
Mekanik kalp kapak protezleri:
Mekanik kalp kapak protezi olan hastalarda tromboprofılaksi için CLEXANE enjeksiyonunun kullanımı yeterli olarak çalışılmamıştır. Tromboprofılaksi için enoksaparin uygulanan mekanik kalp kapak protezli hastalarda izole kalp kapağı trombozu vakaları bildirilmiştir. Altta yatan hastalıkları ve yetersiz klinik verileri içeren şaşırtıcı faktörler bu vakaların incelenmesini kısıtlamaktadırlar. Bu vakaların bir kısmı trombozun matemal veya fetal ölüme yol açtığı gebe kadınlardır. Mekanik kalp kapak protezi olan gebe kadınlar tromboembolizm için yüksek risk altında bulunabilirler.
Yaşlılarda hemoraji:
Yaşlılarda profılaktik dozaj sınırları ile kanama eğiliminde herhangi bir artış gözlenmemektedİr. Bununla birlikte gecikmiş itrah nedeniyle yaşlı hastalar (özellikle 65 yaş ve üzerindeki hastalar) terapötik dozaj sınırları ile kanama komplikasyonlan açısından artan risk altmda olabilirler. Akut ST-segment Yükselmeli miyokard infarktüsünün (STEMI) tedavisi sırasında 65-75 yaş aralığındaki hastalarda bu hastaların risk altında olduğunu gösteren kanama olaylarında artış görülmüştür. Dikkatli klinik izleme tavsiye edilmektedir (bkz. bölüm 4.2: Yaşlılar).
Böbrek Yetmezliği:
Böbrek yetmezliği olan hastalarda, enoksaparin sodyuma maruz kalmada olan artış ile kanama riski de artar. Ağır böbrek yetmezliği (kreatinin klerensi <30 ml/dakika) olan hastalarda enoksaparin sodyuma maruz kalma anlamlı ölçüde arttığından, terapötik ve profılaktik dozaj sınırları için bir dozaj ayarlanması önerilmektedir. Orta derecede böbrek yetmezliği (kreatinin klerensi 30-50 ml/dakika) ve hafif böbrek yetmezliği (kreatinin klerensi 50-80 ml/dakika) olan hastalarda herhangi bir dozaj ayarlanması önerilmemekle birlikte, dikkatli klinik izleme tavsiye edilmektedir (bkz. bölüm 4.2: Böbrek yetmezliği).
Düşük Kilo:
Düşük kilolu kadınlarda (<45 kg) ve düşük kilolu erkeklerde (<57 kg) profılaktik dozajlarla (kiloya göre ayarlanmamış) gözlemlenen enoksaparin sodyuma maruz kalmadaki artış, daha yüksek kanama riskine yol açabilir. Bu nedenle, bu hastalarda dikkatli klinik izleme tavsiye edilmektedir.
Trombosit sayımının izlenmesi:
Antikor aracılığıyla heparin kaynaklı trombositopeni riski düşük molekül ağırlıklı heparinlerle de söz konusudur. Trombositopeni oluşması halinde bu çoğunlukla enoksaparin sodyum tedavisi başladıktan sonraki 5. ve 21. günler arasında görülmektedir. Bu nedenle, enoksaparin sodyum ile tedaviye başlamadan önce ve daha sonra tedavi süresince düzenli olarak trombosit sayımının yapılması önerilmektedir. Uygulamada, trombosit sayımında anlamlı bir azalma (başlangıç değerinin %30 - 50'si) olduğunun doğrulanması halinde enoksaparin sodyum tedavisi derhal kesilmeli ve başka bir tedavi başlanmalıdır.
4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Eğer kesin olarak endike değilse hemostazı etkileyen ajanların enoksaparin sodyum tedavisinden önce kesilmesi önerilmektedir. Bu ajanlar aşağıdaki ilaçları içermektedir:- Sistemik salisilatlar, asetilsalisilik asit ve ketorolak dahil olmak üzere NSAİ ilaçlar,
- Dekstran 40, tiklopidin ve klopidogrel,
- Sistemik glukokortikoidler,
- Trombolitikler ve antikoagülanlar,
- Glikoprotein Ilb/IIIa antagonistler dahil olmak üzere diğer anti trombosit ajanlar.
- Divalproex, plikamisin, valproik asit, sülfınpirazon.
Varfarin; Beraber kullanım sırasında kanama riski artabilir. Antikoagülasyonu sağlamak ve geçici hiperkoagülabilite ihtimaline karşı korumak üzere varfarin tedavisinin başlangıcında enoksaparin genellikle devam ettirilir.
Eğer kombinasyon endike ise, enoksaparin sodyum dikkatli klinik izleme ve uygun olduğunda laboratuvar izlemesi yapılarak kullanılmalıdır.
4.6 Gebelik ve laktasyon Genel tavsiye
Gebelik kategorisi B'dİr.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Deneysel araştırmalar bir fetotoksisite veya teratojenite bulgusu ortaya koymamıştır.Gebelik dönemi
Gebe kadınlarda gerçekleştirilmiş yeterli ve iyi kontrollü araştırmalar bulunmadığından ve deneysel araştırmalar her zaman insanlardaki yanıtın öngörücüsü olmadığından, bu ilaç ancak hekimin kesin bir gereksinim saptaması halinde gebelik sırasında kullanılmalıdır.İnsanlarda, enoksaparin sodyumun gebeliğin ikinci trimesteri sırasında plasenta bariyerini geçtiğine ilişkin herhangi bir bulgu yoktur. Birinci ve üçüncü trimesterlerle ilgili herhangi bir bilgi bulunmamaktadır.
(Bkz. bölüm 4.4: Kalp kapak protezi olan gebe kadınlar ve mekanik kalp kapak protezleri).
Laktasyon dönemi
Deneysel çalışmalarda, 35S-enoksaparin sodyum ya da işaretli metabolitlerinİn sütteki konsantrasyonunun çok düşük olduğu bildirilmiştir. Değişmemiş enoksaparin sodyumun insan sütünde atılıp atılmadığı bilinmemektedir. Enoksaparin sodyumun oral absorpsiyonu olası değildir. Bununla birlikte, bir önlem olarak, enoksaparin sodyum almakta olan süt veren annelerin emzirmeden kaçınmaları tavsiye edilmelidir.Üreme yeteneği/Fertilite
Üreme yeteneğİ/fertiliteye ait çalışma yapılmamıştır.4.8 Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanımı üzerine bilinen herhangi bir etkisi yoktur.4.8 İstenmeyen etkiler
Enoksaparin, klinik çalışmalarda enoksaparin alan 15.000'den fazla hastada değerlendirilmiştir. Bunlar, tromboembolik komplikasyonlar açısından risk altındaki hastalarda ortopedik veya abdominal cerrahiyi takiben derin ven trombozunun profılaksisi için 1776, hareket yeteneği şiddetli ölçüde kısıtlanmış akut medikal hastalarda derin ven trombozunun profılaksisi için 1169, pulmoner embolizmin eşlik ettiği veya etmediği derin ven trombozunun tedavisi için 559, kararsız angina ve Q-dalgasız miyokard infarktüsünün tedavisi için 1578 ve akut ST-yükselmeli miyokard infarktüsünün tedavisi için 10176 hastayı içermiştir.Bu klinik çalışmalarda uygulanan enoksaparin sodyum rejimi endikasyonlara bağlı olarak farklılık göstermektedir. Enoksaparin sodyum dozu, cerrahiyi takiben veya hareket yeteneği şiddetli ölçüde kısıtlanmış akut medikal hastalarda günde bir kez 40 mg subkütan olmuştur. Pulmoner embolizmin (PE) eşlik ettiği veya etmediği derin ven trombozunun (DVT) tedavisinde, enoksaparin alan hastalar 12 saatte bir 1 mg/kg subkütan dozu ya da günde bir kez 1.5 mg/kg subkütan dozu ile tedavi edilmiştir. Kararsız angina ve Q-dalgasız miyokard infarktüsünün tedavisi için klinik çalışmalarda, dozlar 12 saatte bir 1 mg/kg subkütan olmuş ve akut ST-yükselmeli miyokard infarktüsünün tedavisi için klinik çalışmada enoksaparin sodyum rejimi 30 mg IV bolusu takiben 12 saatte bir 1 mg/kg subkütan olmuştur.
Bu klinik çalışmalarda gözlenen ve pazarlama sonrası deneyimde bildirilen advers etkiler aşağıda ayrıntılı olarak verilmektedir.
Sıklıklar şöyle tanımlanmaktadır; Çok yaygın (> 1/10); yaygın (> 1/100 ila <1/10); yaygın olmayan (> 1/1000 ila <1/100); seyrek (> 1/10,000 ila <1/1,000); çok seyrek (< 1/10,000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Pazarlama sonrası deneyimde bildirilen advers olaylar bilinmiyor sıklık derecesi altında sıralanmaktadır.
Trombositopeni ve trombositoz
|
MedDRA sistem organ sınıfı |
Cerrahi hastalarında profilaksi |
Medikal hastalarda profilaksi |
Beraberinde PE gelişmiş veya gelişmemiş DVT ' olan hastalarda tedavi |
Kararsız angina ve Q-dalgasız Mİ olan hastalarda tedavi |
Akut STEMİ olan hastalarda tedavi |
Kan ve lenf sistemi hastalıklar ı |
Çok yaygın:Trombositoz*Yaygın:Trombositopeni |
Yaygınolmayan:Trombositopeni |
Çok yaygın:Trombositoz *Yaygın:Trombositopeni |
Yaygınolmayan:Trombositopeni |
Yaygın:Trombositoz* Trombositopeni Çok seyrek:İmmuno-alerjik trombositopeni |
Hemoraji:
Klinik çalışmalarda, hemorajiler en sık bildirilen reaksiyon olmuştur. Bunlar, hastaların (cerrahi hastalan1) en fazla %4.2'sinde bildirilen majör hemorajileri içermiştir. Bu olgulardan bazıları ölümle sonuçlanmıştır.
Diğer antikoagülanlarla olduğu gibi, aşağıdaki ilişkili risk faktörlerinin varlığında hemoraji meydana gelebilir: Kanamaya yatkın organik lezyonlar, invazif girişimler veya hemostazı etkileyen ilaçların birlikte kullanılması (bkz. Bölüm 4.4 ve 4.5).
|
MedDRA |
Cerrahi |
Medikal |
Beraberinde PE |
Kararsız angina |
Akut STEMİ |
|
sistem |
hastalarında |
hastalarda |
gelişmiş veya |
ve Q-dalgasız |
olan hastalarda |
|
organ sınıfı |
profilaksi |
profilaksi |
gelişmemiş |
MI olan |
tedavi |
|
|
|
|
DVT olan |
hastalarda tedavi |
|
|
|
|
|
hastalarda tedavi |
|
|
Vısküler |
Çok yaygın: |
Yaygın: |
Çok yaygın: |
Yaygın: |
Yaygın: |
|
|
Hemoraji * |
Hemoraji |
Hemoraji * |
Hemoraji * |
Hemoraji * |
hastalıklar |
|
* |
|
|
|
|
|
Seyrek: |
|
Yaygın |
Seyrek: |
Yaygın |
|
|
Retroperitoneal |
|
olmayan: |
Retroperitoneal |
olmayan: |
|
|
hemoraji |
|
İntrakraniyal |
hemoraji |
İntrakraniyal |
|
|
|
hemoraji, Retroperitoneal hemoraji |
|
hemoraji, Retroperitoneal hemoraji |
1 Cerrahi hastalarında, hemoraji komplikasyonları aşağıdaki durumlarda majör kabul edilmiştir: (1) hemoraji anlamlı bir klinik olaya neden olmuşsa ya da (2) hemorajiye hemoglobinde azalma >2 g/dL veya >2 ünite kan ürünü transfiizyonu eşlik etmişse. Retroperitoneal ve intrakraniyal hemorajiler her zaman majör kabul edilmiştir.
Diğer klinik olarak anlamlı advers reaksiyonlar:
Bu reaksiyonlar, endikasyonlar ne olursa olsun, sistem organ sınıfı, sıklık grubu ve azalan ciddiyet sırasına göre aşağıda sunulmaktadır.
|
MedDRA sistem organ sınıfı |
Tüm endikasyonlar |
|
Bağışıklık sistemi hastalıkları |
Yaygın:Alerjik reaksiyonSeyrek:Anafilaktik / anafilaktoid reaksiyon (bkz. Pazarlama sonrası deneyimi) |
|
Hepato-bilier hastalıklar |
Çok yaygın:Hepatik enzimlerde artış (esas olarak transaminazlar**) |
|
Deri ve deri altı dokusu hastalıkları |
Yaygın:Yaygın olmayan:Büllöz dermatit |
|
Genel bozukluklar ve uygulama yerine ilişkin hastalıldar |
Yaygın:Enjeksiyon yerinde hematom, enjeksiyon yerinde ağrı, diğer enjeksiyon yeri reaksiyonları*Yaygın:Lokal iritasyon; enjeksiyon yerinde deri nekrozu |
|
Araştırmalar 1 |
Seyrek:Hİperkalemi |
* *: transaminaz düzeyleri >3 x normalin üst sının
Pazarlama sonrası deneyim:
CLEXANE'ın ruhsat onayı alındıktan sonraki kullanımında aşağıdaki advers olaylar bildirilmiştir. Advers olaylar spontan bildirimleri temel aldığından, bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) sıklık derecesi altında sıralanmaktadırlar.
Kan ve lenf sistemi hastalıkları:
- Hemorajik anemi
- Trombozla birlikte immuno-alerjik trombositopeni olguları; bunların bazılarında tromboz organ infarktüsü veya ekstremite iskemisiyle komplike olmuştur (bkz. Bölüm 4.4: Trombosit sayımlarının izlenmesi).
- Eozinofıli
Bağışıklık sistemi hastalıktan
- Şok da dahil olmak üzere anafılaktik/anafilaktoid reaksiyon
Sinir sistemi hastalıkları
- Başağnsı
Vasküler hastalıklar
- Enoksaparin sodyum ve spinal/epidural anestezi veya spinal ponksiyonun birlikte kullanımıyla spinal hematom (veya nöraksiyal hematom) olguları bildirilmiştir. Bu reaksiyonlar uzun süreli veya kalıcı paralizi gibi değişen derecelerde nörolojik zedelenmelerle sonuçlanmıştır (bkz. Bölüm 4.4: Spinal/epidural anestezi).
Hepato-bilier hastalıklar
- Hepatoselüler karaciğer haşan
- Kolestatik karaciğer hasarı
Deri ve deri altı dokusu hastalıkları
- Çoğunlukla enjeksiyon yerinde meydana gelen deri nekrozu, kutanöz vaskülit (çoğunlukla bu fenomenlere infiltre olmuş ve ağniı purpura veya eritematöz plaklar öncülük etmiştir). Enoksaparin sodyum ile tedavi kesilmelidir.
- Enjeksiyon yerinde nodüller (kistİk enoksaparin birikimi olmayan enflamatuvar nodüller). Bu nodüller birkaç gün sonra çözülmektedir ve tedavinin kesilmesine neden olmamalıdır.
- Alopesi
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıktan
- Uzun süreli (3 aydan fazla) tedavi sonrasında osteoporoz.
4.9. Doz asımı ve tedavisi:
Intravenöz, ekstrakorporeal veya subkütan enoksaparin sodyumun kazara doz aşımı hemorajik komplikasyonlara yol açabilir. Büyük dozlarda olsa dahi oral uygulamayı takiben enoksaparin sodyumun absorbe olması mümkün değildir.Antidotu ve Tedavisi: '
Antikoagülan etkiler protaminin yavaş İntravenöz enjeksiyonu ile büyük ölçüde nötralize edilebilmektedir. Protamin dozu enjekte edilen enoksaparin sodyum dozuna bağlı olup, enoksaparin sodyum son 8 saat içinde uygulanmış ise 1 mg protamin 1 mg enoksaparin sodyumun antikoagülan etkisini nötralize etmektedir. Enoksaparin sodyum uygulanmasının üstünden 8 saatten daha uzun zaman geçmiş İse veya ikinci bir protamin dozunun gerekli olduğu belirlenmiş ise, 1 mg enoksaparin sodyum başına 0.5 mg protamin infuzyonu uygulanabilir. Enoksaparin sodyum enjeksiyonundan 12 saat sonra, protamin uygulanmasına gerek duyulmayabilir. Bununla birlikte, yüksek protamin dozlarıyla dahi, enoksaparin sodyumun anti-Xa aktivitesİ hiçbir zaman tam olarak nötralize edilmez (maksimum yaklaşık %60). (bkz. protamin tuzlarının reçete bilgileri).5. FARMAKOLOJİK ÖZELLİKLER
5.1 Farmakodinamik özellikler
Farmakoterapötik grup: Heparinler - Düşük molekül ağırlıklı heparinler ATC kodu: B01 AB05 'Enoksaparin sodyum yaklaşık 4500 dalton ortalama molekül ağırlığına sahip Düşük Molekül Ağırlıklı Heparindir. İlaç maddesi sodyum tuzudur. Moleküler ağırlık dağılımı:
<2000 dalton <20%
2000 ilâ 8000 dalton >68%
>8000 dalton <18%
Enoksaparin sodyum, domuz intestinal mukozasından türetilen heparin benzil esterin alkalin depolimerizasyonu ile elde edilmektedir. Yapısı, zincirin indirgenmeyen ucunda bir 2-0-sülfo-4-enepiranosüronik asit ve indirgenen uçta bir 2-N,6-0-disülfo-D-glukozamin ile karakterizedir. Enoksaparin yapısının yaklaşık %20'si (%15 ve %25 aralığında değişmektedir) polisakkarit zincirin indirgenen ucunda bir 1,6 anhidro türevi içermektedir. Yüksek anti-Xa (100 I.U./mg) ve düşük anti-II a veya anti-trombin (28 I.U. /mg) aktivitesi vardır. Bu antikoagülan aktiviteler anti-trombin III (ATIII) aracılığıyla sağlanarak insanlarda anti-trombotik aktivitelerle sonuçlanır. Anti-Xa/IIa aktivitesinin dışında, enoksaparinin gerek sağlıklı bireyler ve hastalarda gerekse klinik dışı modellerde başka anti-trombotik ve antienflamatuvar özellikleri de saptanmıştır.
Bunlar, faktör Vlla gibi diğer koagülasyon faktörlerinin ATIII'e bağımlı inhibisyonunu, endojen Doku Faktör Yolu İnhibitörü (TFPI) saliminin indüksiyonunu ve vasküler endotelyumdan kan dolaşımına von Willebrand faktör (vWF) şahmında azalmayı içermektedir. Bu faktörlerin enoksaparinin genel anti-trombotik etkisine katkıda bulunduğu bilinmektedir.
Klinik etkinlik
Kararsız angina ve non -Q miyokard infarktüsünün tedavisi:
Geniş çaplı çok merkezli bir araştırmada, kararsız angina veya Q dalgasız miyokard İnfarktüsü akut fazında kaydedilen 3.171 hasta, aspirinle (100-325 mg/gün) birlikte subkütan yoldan 12 saatte bir 1 mg/kg enoksaparin sodyum ya da intravenöz yoldan aktive parsiyel tromboplastin zamanına (aPTT) dayanarak ayarlanmış fraksiyone olmayan heparin uygulanmak üzere randomize olarak ayrılmıştır. Hastaların klinik stabilizasyona, revaskülarizasyon girişimlerine ya da taburcu edilinceye değin en az 2 gün süreyle ve en fazla 8 gün süreyle hastanede tedavi edilmeleri zorunlu tutulmuştur. Hastaların 30 güne kadar izlenmesi zorunlu tutulmuştur. Enoksaparin sodyum, 14. günde saptanan ve 30 günlük dönem boyunca devam eden %16.2 gibi bir rölatif risk azalmasıyla tekrarlayan angina, miyokard enfarktüsü ve ölüm insidansım heparine kıyasla anlamlı ölçüde düşürmüştür. Bunun yanı sıra, enoksaparin sodyum grubunda daha az sayıda hastaya perkütan transluminal koroner anjioplasti (PTCA) ya da koroner arter bypass greft (CABG) uygulaması yapılmıştır (30. günde %15.8 rölatif risk azalması).Akut ST-segment Yükselmeli Miyokard İnfarktüsü (STEMI) Tedavisi:
Büyük ölçekli çok merkezli bir araştırmada, fibrinolitik tedavi uygulanması için uygun olduğu belirlenen STEMI geçiren 20479 hasta, intravenöz yolla uygulanan 30 mg'lık tek bir bolus ile birlikte subkütan yolla uygulanan 1 mg/kg dozun ardından subkütan enjeksiyon yoluyla 12 saatte bir 1.0 mg/kg enoksaparin sodyum ya da aktif parsiyel tromboplastin zamanına (aPTT) göre ayarlanan intravenöz fraksiyone olmayan heparin 48 saat uygulanmak üzere randomize olarak gruplara ayrılmıştır. Tüm hastalar aynı zamanda minimum 30 gün süreyle uygulanan aspirin ile tedavi edilmiştir. Enoksaparin doz uygulama stratejisi ağır böbrek fonksiyon bozukluğu olan hastalar ve en az 75 yaş ve üzerindeki yaşlı hastalar için ayarlanmıştır.Subkütan yolla uygulanan enoksaparin enjeksiyonları hasta taburcu oluncaya değin ya da maksimum sekiz gün süreyle (hangisi önce gerçekleşirse) uygulanmıştır.
Körlenmiş bir biçimde uygulanan araştırma ilacı ile birlikte antitrombotik destek tedavisi verilen 4716 hastaya perkütan koroner girişim uygulanmıştır. Bu nedenle, enoksaparin ile tedavi edilmekte olan hastalar için PCI, daha önceki araştırmalarda belirlenmiş olan şemanın kullanıldığı enoksaparin tedavisine devam edilerek (ilaç değişikliği yapılmadan) gerçekleştirilmiştir; bu şema, subkütan yolla uygulanan son enoksaparin sodyum dozunun balonun şişirilmesinden 8 saatten daha kısa bir süre önce verilmiş olması durumunda herhangi bir ek doz uygulanmamasını, subkütan yolla uygulanan son enoksaparin sodyum dozunun balonun şişirilmesinden 8 saatten daha uzun bir süre önce verilmiş olması durumunda, IV bolus şeklinde 0.3 mg/kg'lık bir enoksaparin sodyum dozu uygulamasını içermektedir.
Enoksaparin sodyum, randomizasyondan sonraki ilk 30 günde herhangi bir nedene bağlı olarak meydana gelen ya da miyokard infarktüsünün tekrarlamasından kaynaklanan primer sonlanım noktası, bir bileşik ölüm insidansını fraksiyone olmayan heparine kıyasla anlamlı ölçüde azaltmış [fraksiyone olmayan heparin grubundaki yüzde 12.0 ile karşılaştırıldığında enoksaparin grubunda yüzde 9.9] ve rölatif riskte yüzde 17 oranında azalma sağlamıstır (P <0.001). '
Enoksaparinin bazı etkinlik sonuçlan açısından belirgin olan tedavi yararları 48. saatte saptanmış ve yine 48. saatte fraksiyone olmayan heparin tedavisine kıyasla miyokard infarktüsünün tekrarlamasına İlişkin rölatif riskte yüzde 35 oranında azalma olduğu belirlenmiştir (P <0.001).
Enoksaparinin yaş, cinsiyet, infarktın yeri, diyabet öyküsü, daha önce geçirilmiş miyokard infarktüsü öyküsü, uygulanan fibrinolitik tedavinin türü ve araştırma ilacı tedavisine kadar geçen süreyi içeren önemli alt gruplardaki birincil sonlanım noktasına ilişkin yararlı etkisinin tutarlı olduğu belirlenmiştir.
Enoksaparin, randomizasyondan sonraki 30 gün içinde perkütan koroner girişim uygulanan hastalar (rölatif riskte yüzde 23 azalma) ya da medikal tedavi uygulanmış olan hastalarda (rölatif riskte yüzde 15 azalma, etkileşim için P = 0.27) fraksiyone olmayan heparine kıyasla anlamlı bir tedavi yaran sağlamıştır.
Ölüm, miyokard infarktüsünün tekrarlaması ya da intrakranial kanamayı (net bir klinik yarar ölçütü) kapsayan 30 günlük bileşik sonlanım noktası oranı enoksaparin grubunda (%10.1) heparin grubuna kıyasla (%12.2) anlamlı ölçüde daha düşük olmuştur ve bu da CLEXANE tedavisi lehine %17'lik bir rölatif risk azalmasını te
ms
il etmektedir.İlk 30 gün içinde gözlemlenen primer sonlanım noktasındaki enoksaparinin yararlı etkisi, 12 aylık devam periyodunun üzerinde olmuştur.
5.2. Farmakokinetik Özellikler Genel Özellikler
Enoksaparin sodyumun farmakokinetik parametreleri, önerilen dozaj sınırlannda tek ve tekrarlanan subkütan uygulamadan sonra ve tek intravenöz uygulamadan sonra esas olarak plazma anti-Xa aktivitesinin zaman süreci açısından ve ayrıca anti-IIa aktivitesine göre arastınlmıstır.Anti-Xa ve anti-IIa farmakokinetik aktivitelerin kantitatif tayini, spesifik substratlarla ve DMAH'lar (Düşük Molekül Ağırlıklı Heparinler) için uluslararası standartlara karşı (NIBSC) kalibre edilmiş bir enoksaparin standardı ile validasyonu yapılmış amidolitik yöntemler kullanılarak gerçekleştirilmiştir.
Emilim:
Enoksaparin sodyum subkütan enjeksiyonu takiben hızla ve tam olarak emilir. Emilim doğrudan uygulanan doz ile doğru orantılıdır. Bu durum fraksiyone olmayan heparinin aksine enoksaparin sodyum emiliminin lineer olduğunu ifade etmektedir. Subkütan enjeksiyonun ardından anti Xa aktivitesine dayanarak enoksaparinin biyoyararlanımı % 100'e yakındır. 100-200 mg/ml aralığındaki enjeksiyon hacmi ve doz konsantrasyonu sağlıklı gönüllülerde farmakokinetik parametreleri etkilememektedir.
Ortalama maksimum plazma anti-Xa aktivitesi subkütan enjeksiyondan 3-5 saat sonra gözlenmekte ve 20 mg, 40 mg, 1 mg/kg ve 1.5 mg/kg dozlarının tek subkütan uygulanmasını takiben sırasıyla yaklaşık 0.2, 0.4, 1.0 ve 1.3 anti-Xa IU/mPye ulaşmaktadır.
30 mg dozda IV bolus ve hemen ardından subkütan yolla 12 saatte bir uygulanan 1 mg/kg, 1.16 IU/mL'lik başlangıç pik anti-Faktör Xa düzeyleri (n = 16) ve sabit durum düzeylerinin %88'ine karşılık gelen bir ortalama etkilenim sağlamıştır. Sabit duruma tedavinin ikinci gününde ulaşılmaktadır.
Enoksaparinin farmakokinetiğinin önerilen dozaj sınırlarının üzerinde doğrusal olduğu görülmektedir. Hasta içi ve hastalar arası değişkenlik düşüktür. Sağlıklı gönüllülerde günde bir kez 40 mg ve günde bir kez 1.5 mg/kg rejimlerinin tekrarlanan subkütan uygulanmasını takiben, tek doz sonrasına kıyasla yaklaşık %15 daha yüksek bir ortalama maruz kalma oram ile sabit duruma 2. gün ulaşılmaktadır. Sabit durum enoksaparin aktivitesi düzeyleri tek doz farmakokinetiği ile iyi öngörülmektedir. Günde iki kez 1 mg/kg rejiminin tekrarlanan subkütan uygulanmasını takiben sabit duruma 3. gün ile 4. gün arasında ulaşılmakta olup, tek doz sonrasına kıyasla yaklaşık %65 daha yüksek bir ortalama maruz kalma oranı ve sırasıyla yaklaşık 1.2 ve 0.52 IU/ml'lik ortalama pik ve taban düzeyleri saptanmaktadır. Enoksaparin sodyum farmakokinetiği dikkate alındığında, sabit durumdaki bu farklılık beklenen bir olgudur ve terapötik sınır içindedir.
Subkütan uygulamadan sonra plazma anti-IIa aktivitesi anti-Xa aktivitesine kıyasla yaklaşık 10 kat daha düşüktür. Ortalama maksimum anti-IIa aktivitesi subkütan uygulamadan yaklaşık 3-4 saat sonra gözlenmekte ve günde iki kez 1 mg/kg ve günde bir kez 1.5 mg/kg'm tekrarlanan uygulanmasını takiben sırasıyla 0.13 IU/ml ve 0.19 IU/ml'ye ulaşmaktadır.
Dağılımı:
Enoksaparin sodyum anti-Xa akti vitesin in dağılım hacmi yaklaşık 5 litredir ve kan hacmine bağlıdır.
Bivotransformasvon:
Enoksaparin sodyum esas olarak karaciğerde, depolimerizasyon ve/veya desülfasyon yoluyla son derece azalmış biyolojik potense sahip düşük molekül ağırlıklı türlere metabolize olmaktadır.
Eliminasvon:
İtrahın, tek subkütan dozdan sonra 4 saat ile tekrarlanan doz uygulamasından sonra 7 saat arasında seyreden bir yanlanma ömrü ile monofazik olduğu görülmektedir.
Aktif metabolitlerin renal itrahı uygulanan dozun yaklaşık %10'unu ve aktif ve aktif olmayan metabolitlerin renal atılımı dozun %40'mı temsil etmektedir.
Hastalardaki karakteristik özellikler:
Yaslılar:
Bir popülasyon farmakokinetik analizinin sonuçlarına göre, enoksaparin sodyumun kinetik profili böbrek fonksiyonu normal olduğunda yaşlı bireylerde genç bireylere kıyasla farklılık göstermemektedir. Bununla birlikte, böbrek fonksiyonu yaşla birlikte düştüğünden, yaşlı hastalarda enoksaparin sodyum eliminasyonu azalma gösterebilir (bkz. bölüm 4.4: Yaşlılarda Hemoraj; bölüm
4.2:
Yaşlılar; bölüm 5.2: Böbrek yetmezliği).Böbrek Yetmezliği:
Sabit durumda anti-Xa plazma klirensi ile kreatinin klirensi arasında doğrusal bir ilişki gözlenmiştir ve bu, böbrek fonksiyonu bozulmuş hastalarda enoksaparin sodyum klirensinin azaldığını göstermektedir. Sabit durumda eğri altında kalan alan (EAA) ile ifade edilen anti-Xa maruz kalma, tekrarlanan günde bir kez subkütan 40 mg dozlarından sonra hafif böbrek yetmezliği (kreatinin klirensi 50-80 ml/dakika) ve orta derecede böbrek yetmezliği (kreatinin klirensi 30-50 ml/dakika) olan hastalarda küçük bir artış göstermektedir. Ağır böbrek yetmezliği (kreatinin klirensi <30 ml/dakika) olan hastalarda ise, sabit durumda EAA, tekrarlanan günde bir kez subkütan 40 mg dozlarından sonra ortalama %65 oranında anlamlı bir artış göstermektedir (bkz. bölüm 4.4: Böbrek yetmezliği; bölüm 4.2: Böbrek yetmezliği).
Kilo:
Tekrarlanan günde bir kez subkütan 1.5 mg/kg doz uygulamasından sonra, anti-Xa aktivitesi İçin ortalama EAA sabit durumda obez sağlıklı gönüllülerde (BMI 30-48 kg/m2) obez olmayan kontrollere kıyasla biraz daha yüksek olup, Amax (maksimum anti-Xa aktivitesi) artmamaktadır. Obez bireylerde subkütan doz uygulamasıyla daha düşük bir kiloya göre ayarlanmış klirens söz konusudur.
Kiloya göre ayarlanmamış doz uygulandığında, tek bir subkütan 40 mg dozu takiben anti-Xa maruz kalma düzeyinin, normal kilolu kontrollerle karşılaştırıldığında düşük kilolu kadınlarda (< 45 kg) %52 ve düşük kilolu erkeklerde (< 57 kg) %27 daha yüksek olduğu saptanmıştır (bkz. bölüm 4.4: Düşük Kilo).
Hemodiyaliz:
Bir araştırmada, tek bir 0.25 veya 0.50 mg/kg intravenöz dozunu takiben eliminasyon oranının kontrol popülasyonuna kıyasla benzer ancakEAA'nın iki kat daha yüksek olduğu saptanmıştır.
Farmakokinetik etkileşimler:
Eşzamanlı olarak birlikte uygulandığında, enoksaparin ile trombolitikler arasında herhangi bir farmakokinetik etkileşim gözlenmemiştir.
5.3 Klinik öncesi güvenlilik verileri
Enoksaparinin kanserojen potansiyelini değerlendirmeye yönelik olarak hayvanlar üzerinde uzun dönemli bir araştırma yapılmamıştır.Enoksaparinin, Ames testi, fare lenfoma hücresi ileriye dönük mutasyon testi ve insan lenfosit kromozomal düzensizlik testi dâhil olmak üzere in vitro testlerde ve in vivo sıçan kemik iliği kromozomal düzensizlik testinde mutajenik olmadığı gözlemlenmiştir.
Enoksaparinin, erkek ve dişi sıçanlarda 20 mg/kg/gün subkütan doz düzeylerine kadar fertilite ve reprodüktif performans üzerinde hiçbir etkisinin olmadığı gözlemlenmiştir. Gebe sıçan ve tavşanlarda, 30 mg/kg/gün enoksaparin subkütandoz düzeylerine kadar teratoloji araştırmaları yapılmıştır. Enoksaparin kaynaklı hiçbir teratojenik etki veya fetotoksİsıte bulgusuna rastlanmamıştır.
Enoksaparinin antikogülan etkilerinin yanı sıra, 15 mg/kg/gün doz uygulaması ile hem sıçan ve köpekler üzerinde yapılan 13 haftalık subkutan toksisite araştırmalarında hem de 10 mg/kg/gün doz uygulaması ile sıçan ve maymunlar üzerinde yapılan 26 haftalık subkutan ve intravenöz toksisite araştırmalarında hiçbir yan etki bulgusuna rastlanmamıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1 Yardımcı maddelerin listesi
Enjeksiyonluk su6.2 Geçimsizlikler Subkütan Enjeksiyon:
Diğer ürünler ile karıştırılmamalıdır.İntravenöz (Bolus) Enjeksiyon (yalnızca akut STEMİ endikasyonu için):
Enoksaparin sodyum, sudaki %5 dekstroz ya da normal serum fizyolojik çözeltisi (%0.9) ile güvenle uygulanabilir.6.3 Raf ömrü
36 ay6.4 Saklamaya yönelik özel tedbirler
25°C1nin altındaki oda sıcaklığında ve ambalajında saklayınız. Dondurmayınız.6.5 Ambalajın niteliği ve içeriği Sabit iğneli cam:
Tip I cam hazneRef: BD Hypak® şırıngalar ya da BG şırıngalar ya da MG şırıngalar Tedarikçi: BD ya da BG ya da MG Paslanmaz Çelik Z6CN18/10
İğne koruması (sert plastik kapaklı):
Sentetik poliizopren kauçuk ref. W7025/65, gri, West şirketi (latekssiz), Tedarikçi: BD ya daStiren butadiyen kauçuk, ref. FM27/0, gri, Helvoet (latekssiz), Tedarikçi: BD
ya da
Sentetik poliizopren kauçuk, ref. 4800 GS, gri, Stelmi (latekssiz), Tedarikçi: BD ya da Stelmi
Tıpa:
Klorobutil kauçuk - ref. PH701/50/C, siyah, West şirketi (latekssiz), Tedarikçi: BD ya daBromobutil kauçuk - ref. FM257/7, siyah, Helvoet (latekssiz), Tedarikçi: BD ya da
Klorobutil kauçuk- ref. 6422NR, siyah, Stelmi (latekssiz), Tedarikçi: Stelmi
6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler Subkutan enjeksiyon:
Enoksaparin sodyum, venöz tromboembolik hastalığın önlenmesi, derin ven trombozu tedavisi, kararsız anjina ve Q dalgasız miyokard infarktüsü tedavisi ve akut ST-segment Yükselmeli Miyokard İnfarktüsü tedavisi için yalnızca subkütan enjeksiyon yoluyla uygulanır.IV bolus enjeksiyonu:
Akut ST-segment Yükselmeli Miyokard İnfarktüsü için, tedaviye tek bir IV bolus enjeksiyonla başlanmalı ve bunun ardından hemen bir subkütan enjeksiyon uygulanmalıdır.Arterye] hat enjeksiyonu:
Hemodiyaliz sırasında vücut dışı dolaşımda trombus oluşumunu önlemek amacıyla, bir diyaliz devresinin arteryel hattı yoluyla uygulanır.İntramüsküler yolla uygulanmamalıdır.
Tek kullanımlık enjektör hemen kullanıma hazırdır.
Subkutan enjeksiyon tekniği:
Önceden doldurulmuş tek kullanımlık şırıngalar derhal kullanım için hazırdır.Enjeksiyon tercihen hasta yatar durumdayken yapılmalıdır. Enoksaparin sodyum derin subkütan enjeksiyon yoluyla uygulanır. Önceden doldurulmuş 20 mg ve 40 mg şırıngaları kullanırken ilaç kaybım önlemek için enjeksiyondan önce şırıngadan hava kabarcıklarını dışarı atmaya çalışmayınız. Uygulama sol ve sağ anterolateral veya posterolateral abdominal duvar arasında dönüşümlü olarak yapılmalıdır.
İğne başparmak ile işaret parmağı arasında bastırmadan tutulan deri kıvrımına dikey olarak sonuna kadar batınlır. Bu deri kıvrımı enjeksiyon tamamlanıncaya değin bırakılmamalıdır. Uygulamadan sonra enjeksiyon yerini ovuşturmayınız.
İntravenöz (Bolus) Enjeksiyon Tekniği (yalnızca akut STEMI endikasyonu için):
Enoksaparin sodyum bir intravenöz hat yoluyla uygulanmalıdır. Diğer ilaçlarla karıştırılmamalı ya da birlikte uygulanmamalıdır. Enoksaparin sodyumun diğer ilaçlarla olası karışımını önlemek üzere, ilacın giriş yerini temizlemek amacıyla, intravenöz bolus şeklinde enoksaparin sodyum uygulamasından önce ve sonra seçilen intravenöz giriş yeterli miktarda serum fizyolojik ya da dekstroz çözeltisiyle yıkanmalıdır. Enoksaparin sodyum, sudaki %5 dekstroz ya da normal serum fizyolojik çözeltisi (%0.9) ile güvenle uygulanabilir.7. RUHSAT SAHİBİ
Sanofı aventis İlaçlan Ltd. Şti.Büyükdere Cad. No:l 93,
Levent - İstanbul
8. RUHSAT NUMARASI:
109/929. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ:
İlk ruhsat tarihi:27.04.2001 Ruhsat yenileme tarihi: 27.04.201110. KÜB'ÜN YENİLENME TARİHİ:
18İlaç Bilgileri
Clexane 8000 Anti-xa/0.8 Ml Kullanıma Hazie Enjek...
Etken Maddesi: Enoksaparin Sodyum
Atc Kodu: B01AB05
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.