Risperdal Consta 25 mg uzun salınımlı IM enjeksiyonluk flakon Kısa Ürün BilgisiSinir Sistemi » Psikoleptikler (Psikolojik İlaçlar) » Antipsikotikler » Diğer İlaçlar » Risperidon KISA ÜRÜN BILGISI1. BEŞERI TIBBI ÜRÜNÜN ADIRISPERDAL CONSTA 25 mg uzun salınımlı IM enjeksiyonluk flakon2. KALITATIF VE KANTİTATIF BILEŞIMIEtkin madde:Risperidon 25 mg Yardımcı maddeler: Her 1 ml çözeltide: Sodyum klorür 6 mg Sodyum hidroksit 0,54 mg Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTIK FORMEnjeksiyon için uzatılmış salımlı süspansiyonBeyaz-beyazımsı serbest akıcı toz içeren flakon ve berrak, renksiz, seyreltici içeren kullanıma hazır dolu enjektör 4. KLİNIK ÖZELLIKLER4.1. Terapötik endikasyonlarRISPERDAL CONSTA şizofreni ve şizoafektif bozukluk tedavisinde endikedir. RISPERDAL CONSTA, pozitif (halüsinasyon, delüzyon, düşünce bozuklukları, saldırganlık, şüphecilik) ve/veya negatif (künt afekt, emosyonel ve sosyal çekingenlik ve konuşma yetersizliği) semptomların belirgin olduğu, erken dönem psikozlar, akut şizofrenik alevlenmeler, kronik şizofreni ve diğer psikotik durumlar dahil şizofreni hastalarının tedavisinde endikedir. RISPERDAL CONSTA şizofreni ile ilgili afektif semptomları (depresyon, suçluluk duygusu, endişe) da azaltır. RISPERDAL CONSTA (risperidon), duygu durum epizotlarının oluşmasını geciktirmek amacıyla bipolar I bozukluğun tedavisinde monoterapi veya lityum ve valproat tedavisine ek olarak kullanılabilir. (bkz; bölüm 5.1 Farmakodinamik özellikler).RISPERDAL CONSTA, bipolar I bozukluğu olan hastalarda, duygu durum epizotlarının oluşmasını geciktirmek amacıyla destekleyici idame tedavisi olarak endikedir ( bkz; bölüm 5.1 Farmakodinamik özellikler).4.2. Pozoloji ve uygulama şekli Pozoloji: RISPERDAL CONSTA iki haftada bir uygulanmalıdır. YetişkinlerÖnerilen doz iki haftada bir intramüsküler 25 mg'dır. Bazı hastalarda 37,5 mg ya da 50 mg gibi daha yüksek dozlarla yarar sağlanabilir. Klinik çalışmalarda, şizofreni hastalarında 75 mg ile ek fayda gözlenmemiştir. Bipolar bozukluğu olan hastalarda 50 mg'ın üzerindeki dozlar çalışılmamıştır. İki haftada bir 50 mg'dan daha yüksek dozlar önerilmemektedir. İlk RISPERDAL CONSTA enjeksiyonundan sonraki üç haftalık gecikme döneminde yeterli düzeyde antipsikotik ilaç desteği verilmelidir (bkz; bölüm 5.2 Farmakokinetik özellikler).Uygulama sıklığı ve süresi: Artırma yönündeki doz ayarlamaları 4 haftadan sık aralıklarla yapılmamalıdır. Bu doz ayarlamasının etkisinin, ilk yüksek doz uygulamasından sonraki 3 haftadan önce etkili olması beklenmemelidir. Uygulama şekli: Daha önce risperidon kullanmamış hastalarda, RISPERDAL CONSTA tedavisine başlanmadan önce oral risperidonun tolere edilebilirliğinin tayin edilmesi önerilir. RISPERDAL CONSTA uygun emniyetli iğne kullanılarak, kalçadan veya omuzdan derin intramüsküler enjeksiyon yolu ile uygulanmalıdır. Omuzdan enjeksiyon için 1-inch'lik iğne kullanılmalıdır ve enjeksiyon omuzlar arasında dönüşümlü olarak yapılmalıdır. Kalçadan enjeksiyon için 2-inch'lik iğne kullanılmalıdır ve enjeksiyon kalçalar arasında dönüşümlü olarak yapılmalıdır. İntravenöz yolla uygulanmamalıdır (bkz; 4.4 Özel Kullanım Uyarıları ve Önlemleri).Özel popülasyonlara ilişkin ek bilgiler Böbrek/Karaciğer yetmezliği: Karaciğer veya böbrek yetmezliği bulunan hastalarda RISPERDAL CONSTA kullanımına ilişkin bir çalışma yapılmamıştır. Karaciğer veya böbrek yetmezliği bulunan hastaların RISPERDAL CONSTA ile tedavi edilmeleri gerekirse ilk hafta boyunca günde iki defa 0,5 mg oral risperidon başlangıç dozu önerilir. Tedavinin ikinci haftasında günde iki defa 1 mg ya da günde bir defa 2 mg verilebilir. En az 2 mg düzeyindeki toplam günlük oral doz iyi tolere edilebiliyorsa iki haftada bir 25 mg RISPERDAL CONSTA enjeksiyonu uygulanabilir. Pediyatrik popülasyon: RISPERDAL CONSTA 18 yaşın altındaki çocuklarda çalışılmamıştır. Geriyatrik popülasyon: Önerilen doz iki haftada bir intramüsküler 25 mg'dır. İlk RISPERDAL CONSTA enjeksiyonundan sonraki üç haftalık gecikme döneminde yeterli düzeyde antipsikotik ilaç desteği verilmelidir (hkz; bölüm 5.2 Farmakokinetik özellikler).4.3. Kontrendikasyonlar RISPERDAL CONSTA etkin madde veya ilacın içerdiği yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen hastalarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleri Daha önce risperidon kullanmamış hastalarda, RISPERDAL CONSTA tedavisine başlanmadan önce oral risperidonun tolere edilebilirliğinin tayin edilmesi önerilir. Demanslı yaşlı hastalarKonvansiyonel ve atipik antipisikotik ilaçlar demansa bağlı psikozu olan yaşlı hastaların tedavisinde kullanıldığında ölüm riskinde artışa neden olmaktadır. Furosemidle Birlikte KullanımDemansı olan yaşlı hastalarda oral RISPERDAL ile plasebo kontrollü çalışmalarda, tek başına risperidon (%3.1; ortalama yaş 84 (yaş aralığı 70-96)) veya tek başına furosemid alanlara (%4.1; ortalama yaş 80 (yaş aralığı 67-90)) göre, furosemid+risperidon ile tedavi edilen hastalarda (%7.3; ortalama yaş 89 (yaş aralığı 75-97)) daha yüksek mortalite oranları gözlenmiştir. Furosemid+risperidon tedavisi ile hastalarda artan mortalite 4 klinik çalışmanın 2'sinde gözlenmiştir. Bu bulguyu açıklayacak bir patofizyolojik mekanizma tanımlanamamış ve ölüm nedeni belli bir neden üzerine yoğunlaşmamıştır. Ancak kullanım kararından önce dikkat edilmeli ve bu kombinasyonun risk ve yararları değerlendirilmelidir. Risperidon ile birlikte diğer diüretiklerin kullanımında hastalarda artan mortalite insidansına rastlanmamıştır. Tedaviden bağımsız olarak dehidratasyon mortalite için genel bir risk faktörüdür ve demansı olan yaşlı hastalarda dikkatle kaçınılmalıdır. Serebrovasküler Advers OlaylarDemanslı yaşlı hastalarda yapılan plasebo kontrollü çalışmalarda, oral RISPERDAL ile tedavi edilen hastalarda (ortalama yaş 85 yaş aralığı; 73-97), plasebo kullanan hastalara oranla ölüm de dahil serebrovasküler advers olayların (serebrovasküler kazalar, geçici iskemik ataklar) insidansının daha yüksek olduğu tespit edilmiştir. RISPERDAL CONSTA inme için risk faktörü taşıyan hastalarda dikkatli kullanılmalıdır. Alfa-bloke edici aktiviteRisperidonun alfa-adrenerjik reseptörleri bloke etmesine bağlı olarak özellikle tedavinin başlangıç döneminde (ortostatik) hipotansiyon görülebilir. Pazarlama sonrasında risperidon ve antihipertansif tedavinin eşzamanlı kullanılması ile klinik olarak belirgin hipotansiyon gözlenmiştir. Risperidon kardiyovasküler hastalığı (örneğin kalp yetmezliği, miyokard enfarktüsü, ileti anomalileri, dehidratasyon, hipovolemi veya serebrovasküler hastalık) olduğu bilinen hastalarda dikkatle kullanılmalıdır. Klinik açıdan belirgin ortostatik hipotansiyon devamlı olarak görülürse RISPERDAL CONSTA tedavisinin devamının yarar/risk değerlendirmesi yapılmalıdır. Tardif Diskinezi/Ekstrapiramidal Semptomlar (TD/EPS)Dopamin reseptör antagonisti olan ilaçlar, özellikle dil ve/veya yüzde istemsiz ritmik hareketler ile karakterize tardif diskinezi gelişimi ile ilgili bulunmuştur. Ekstrapiramidal semptomların görülmesinin tardif diskinezi gelişiminde bir risk faktörü olduğu bildirilmiştir. Risperidonun klasik nöroleptiklere oranla ekstrapiramidal semptomları indükleme potansiyeli daha az olduğundan, klasik nöroleptiklerle karşılaştırıldığında tardif diskinezi indükleme riski daha az olmalıdır. Tardif diskinezi belirtileri görüldüğünde tüm nöroleptiklerin kesilmesi düşünülmelidir. Nöroleptik Malign Sendrom (NMS)Hipertermi, kas rijiditesi, otonom instabilite, bilinç bulanıklığı ve serum kreatinin fosfokinaz düzeyinin yükselmesi ile karakterize olan Nöroleptik Malign Sendromunun, antipsikotiklerin kullanımına bağlı olarak oluştuğu bildirilmiştir. İlave belirtiler, myoglobinüri (rabdomiyoliz) ve akut böbrek yetmezliği olabilir. Bu durumda, risperidon dahil olmak üzere tüm antipsikotikler kesilmelidir. Son RISPERDAL CONSTA uygulamasından sonra, risperidonun plazma seviyeleri en az 6 hafta süresince mevcut kalır. Parkinson Hastalığı veya Lewy Cisimcikli Demansı (LCD) olan hastalarda, antipsikotik ilaçlara duyarlılık artabileceği gibi Nöroleptik Malign Sendrom riski de artabileceğinden, her iki gruba RISPERDAL CONSTA'nın da dahil olduğu antipsikotikler reçete edilirken hekimler tarafından risk ve yarar değerlendirilmelidir. Bu artan duyarlılığın belirtileri arasında, ekstrapiramidal semptomlara ek olarak, konfüzyon, küntleşme, sık düşmelerin olduğu postural dengesizlik bulunabilir. Hiperglisemi ve Diabetes MellitusRISPERDAL tedavisi sırasında hiperglisemi, diabetes mellitus ve önceden var olan diyabetin alevlenmesi bildirilmiştir. Atipik antipsikotik kullanımı ile glukoz anormallikleri arasındaki ilişkinin değerlendirilmesi, şizofreni hastalarında artan diabetes mellitus arka planı riski olasılığı ve genel popülasyonda artan diabetes mellitus insidansı nedeniyle zorlaşmaktadır. Karışıklığa neden olan bu hususlar göz önünde bulundurulduğunda, antipsikotik kullanımı ve hiperglisemi ilişkili advers olaylar arasındaki ilişki tamamen anlaşılmamıştır. RISPERDAL de dahil atipik antipsikotiklerle tedavi edilen tüm hastalar hiperglisemi ve diabetes mellitus semptomları açısından izlenmelidir (bkz; bölüm 4.8 İstenmeyen etkiler).HiperprolaktinemiDoku kültürü çalışmaları meme tümörlerinde hücre büyümesinin prolaktin tarafından stimule edilebileceğini belirtmektedir. Klinik ve epidemiyolojik çalışmalarda antipsikotik kullanımı ile ilişkisi açık bir şekilde gösterilememiş olsa da, ilgili tıbbi öyküsü olan hastalarda dikkatli olunması önerilmektedir. RISPERDAL CONSTA daha önceden hiperprolaktinemisi ve olası prolaktine bağlı tümörü olan hastalarda dikkatli kullanılmalıdır. QT AralığıDiğer antipsikotikler ile olduğu gibi, RISPERDAL CONSTA, aritmojenik etkiyi arttırabileceğinden kardiyak aritmi hikayesi olan hastalarda, konjenital uzun QT sendromu olan hastalarda, bradikardi veya elektrolit düzensizliği olan hastalarda (hipokalemi, hipomagnezinemi) ve QT aralığını uzattığı bilinen ilaçlar ile birlikte kullanılırken dikkatli olunmalıdır. PriapizmAlfa-adrenerjik blokör özelliğinden dolayı RISPERDAL CONSTA ile tedavi sırasında priapizm görülebilir. Vücut Sıcaklığının RegülasyonuVücudun vücut sıcaklığını ayarlama yeteneğinin bozulması antipsikotik ilaçlarla ilişkilendirilmişir. RİSPERDAL CONSTA ile tedavi gören hastalarda; şiddetli egzersiz, aşırı sıcağa maruz kalma, eş zamanlı antikolinerjik tedavi görme veya dehidratasyona uğrama gibi vücut sıcaklığını artıran durumlar söz konusu olduğunda hastalar uygun olarak izlenmelidir. Kilo AlımıAnlamlı kilo alımı bildirilmiştir. RISPERDAL kullanıldığında kilo alımının izlenmesi önerilir. Böbrek veya karaciğer yetmezliğiOral risperidon çalışılmış olsa da, RISPERDAL CONSTA böbrek veya karaciğer yetmezliği olan hastalarda çalışılmamıştır. Bu hastalarda RISPERDAL CONSTA kullanırken dikkatli olunmalıdır. (bkz; bölüm 4.2 Pozoloji ve Uygulama Şekli)DiğerKlasik nöroleptikler, kriz eşiğini düşürdüğünden epilepsi hastalarında dikkatle kullanılmalıdır. Antipsikotik ilaçlarla venöz tromboembolik olaylar (VTE) bildirilmiştir. Antipsikotik ilaç tedavisi gören hastalarda çoğunlukla kazanılmış VTE risk faktörleri bulunduğu için, VTE için tüm olası risk faktörleri, RISPERDAL CONSTA ile tedaviden önce ve sonra tanımlanmalı ve koruyucu önlemler alınmalıdır. UygulamaRISPERDAL CONSTA'nın kaza ile kan damarları içine uygulanmasından kaçınılmasına dikkat edilmelidir (bkz; bölüm 4.8 İstenmeyen etkiler [retinal arter oklüzyonu]).4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri Risperidonun santral sinir sistemi üzerine olan etkisi nedeniyle, diğer santral etkili ilaçlarla kullanılırken dikkatli olunmalıdır. Risperidon, levodopa ve diğer dopamin agonistlerinin etkilerini antagonize edebilir. Pazarlama sonrasında risperidon ve antihipertansif tedavinin eşzamanlı kullanılması ile klinik olarak belirgin hipotansiyon gözlenmiştir. RISPERDAL CONSTA QT aralığını uzattığı bilinen ilaçlar ile birlikte kullanılırken dikkatli olunmalıdır. Karbamazepinin, risperidonun plazmadaki aktif antipsikotik fraksiyonunu azalttığı gösterilmiştir. CYP3A4 karaciğer enzim indükleyicileri ile benzer etkiler görülebilir. Karbamazepin ya da diğer CYP3A4 karaciğer enzim indükleyicileri başlandığında veya kesildiğinde RISPERDAL CONSTA dozu hekim tarafından tekrar değerlendirilmelidir. CYP2D6 inhibitörleri olan fluoksetin ve paroksetin, aktif antipsikotik fraksiyonun daha az olmak üzere risperidonun plazma konsantrasyonlarını artırır. Eşzamanlı olarak fluoksetin veya paroksetin başlandığında ya da kesildiğinde RISPERDAL CONSTA dozu tekrar değerlendirilmelidir. Topiramat risperidonun biyoyararlanımını hafifçe düşürmüştür ancak aktif antipsikotik fraksiyonun biyoyararlanımını etkilememiştir. Bu nedenle bu etkileşimin klinik bir anlamının olması beklenmemektedir. Fenotiyazinler, trisiklik antidepresanlar ve bazı beta blokerler risperidonun plazma düzeyini artırabilir, ancak aktif antipsikotik fraksiyonu etkilemez. Amitriptilin, risperidonun veya aktif antipsikotik fraksiyonunun farmakokinetiğini etkilemez. Simetidin ve ranitidin sadece aktif antipsikotik fraksiyonu ile sınırlı olmak üzere risperidonun biyoyararlanımını artırır. Bir CYP3A4 inhibitörü olan eritromisin, risperidon ve aktif antipsikotik fraksiyonunun farmakokinetiğini değiştirmez. Kolinesteraz inhibitörleri galantamin ve donepezil, risperidon ve aktif antipsikotik fraksiyonların farmakokinetiğini klinik olarak belirgin biçimde etkilemez. Risperidon, plazma proteinlerine büyük oranda bağlanan ilaçlarla birlikte alındığında, ilaçlardan herhangi birinde klinik açıdan anlamlı bir plazma proteinlerden ayrılma durumu görülmez. Risperidon lityum, valproat, digoksin ve topiramatın farmakokinetiğini klinik olarak belirgin biçimde etkilemez. Oral RISPERDAL ile birlikte furosemid kullanan demanslı yaşlı hastalarda artan mortalite ile ilgili olarak 4.4 Özel kullanım uyarıları ve önlemleri"bölümüne bakınız.4.6. Gebelik ve laktasyon Genel tavsiye Gebelik kategorisi C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) RISPERDAL CONSTA'nın gebelik esnasında güvenle kullanımına dair yeterli veri yoktur. Gebelik dönemi Gebeliğin üçüncü trimesterinde antipsikotik ilaçlara (RISPERDAL CONSTA da dahil) maruz kalan yeni doğanlar, doğumu takiben şiddeti değişebilen, anormal kas hareketleri (ekstrapiramidal işaretler/ekstrapiramidal semptomlar) ve/veya ilaç kesilme semptomları açısından risk altındadırlar. Bu semptomlar, ajitasyon, hipertoni, hipotoni, tremor, somnolans, respiratuar distres veya beslenme bozukluklarını içermektedir. RISPERDAL CONSTA gebelerde sadece muhtemel yarar, risklerden fazla olduğunda kullanılmalıdır. Laktasyon dönemi Risperidon ve 9-hidroksi-risperidon anne sütü ile atılmaktadır (süte geçmektedir). RISPERDAL CONSTA emzirme döneminde kullanılmamalıdır. Üreme yeteneği/Fertilite Hayvan deneylerinde, risperidonun doğrudan fertilite toksik etkileri görülmemişse de, prolaktin ve santral sinir sistemine bağlı bazı indirekt etkileri görülmüştür. Hiçbir çalışmada risperidonun teratojenik etkisine rastlanmamıştır. 4.7. Araç ve makine kullanımı üzerindeki etkiler RISPERDAL CONSTA zihinsel uyanıklık gerektiren fonksiyonları etkileyebilir. Bu yüzden hastaların, bireysel duyarlılıkları anlaşılıncaya kadar, araç ve makine kullanmaları önerilmez. 4.8. İstenmeyen etkiler Klinik Çalışma VerileriŞizofreni tedavisi için RISPERDAL CONSTA'nın tek veya çoklu dozlarına maruz kalan 2392 hastanın dahil olduğu klinik bir çalışmada RISPERDAL CONSTA'nın güvenliliği değerlendirilmiştir. 2392 hastadan 332'si, 12 haftalık çift-kör, plasebo-kontrollü çalışmada RISPERDAL CONSTA almışlardır. 332 hastanın toplam 202'si, 25 mg veya 50 mg RISPERDAL CONSTA alan şizofreni hastalarıdır. RISPERDAL CONSTA ile tedavinin koşulları ve süresi diğer klinik çalışmalarda büyük farklılık göstermektedir. Bu çalışmalar çift-kör, sabit- ve değişken-doz, plasebo- veya aktif-kontrollü çalışmalar ve çalışmaların açık-etiket fazları, yatan ve ayaktan tedavi gören hastalar ve kısa dönemli (12 haftaya kadar) ve uzun dönemli (4 yıla kadar) maruziyet çalışmalarını içerir. Şizofreni hastaları ile yapılan çalışmalara ek olarak, RISPERDAL CONSTA'nın bipolar I bozukluğu olan hastalarda destekleyici idame tedavisi olarak ve bipolar I bozukluk idame tedavisinde monoterapi olarak uygulandığındaki etkinlik ve güvenliliğinin incelendiği bir çalışmadan elde edilen güvenlilik verileri de sunulmuştur. Bipolar I bozukluk idame tedavisi için monoterapi çalışmasındaki, çok-merkezli, çift-kör, plasebo-kontrollü çalışmadaki denekler; Bipolar Bozukluk Tip I için DSM-IV kriterlerini karşılayan ve risperidon (oral veya uzun-etkili enjeksiyon) ile stabilize edilmiş, diğer antipsikotikler veya duygu-durum düzenleyiciler ile stabilize edilmiş ya da akut epizot geçiren yetişkin hastalardır. Açık-etiketli oral risperidon (n=440) tedavisinin 3 haftalık periyodunun ardından, bu periyotta oral risperidona başlangıç yanıtı gösteren hastalar ve çalışmanın başlangıcında risperidon (oral veya uzun-etkili enjeksiyon) ile stabilize edilmiş hastalar, açık-etiketli RISPERDAL CONSTA (n=501) 26 haftalık stabilizasyon periyoduna dahil olmuşlardır. Bu periyot süresince yanıtı sürdüren hastalar, monoterapi olarak RISPERDAL CONSTA (n=154) veya plasebo (n=149) aldıkları, 24 aylık, çift-kör, plasebo-kontrollü periyoda randomize edilmişlerdir. Nüks olan veya çift-kör periyodu tamamlayan hastalar 8-haftalık, açık-etiketli RISPERDAL CONSTA uzatma periyoduna dahil olmayı seçebilmişlerdir (n=160). Bipolar I bozukluğu olan hastaların dahil olduğu destekleyici idame tedavisi çalışmasındaki çok-merkezli, çift-kör, plasebo kontrollü çalışmadaki denekler ise; Bipolar Bozukluk Tip I veya Tip II için DSM-IV kriterlerini karşılayan yetişkin hastalardır. Bu hastalar son 12 ay içerisinde, en az 2'si çalışmanın başlangıcından 6 ay önceki dönem içerisinde olmak üzere, psikiyatrik/klinik müdahale gerektiren en az 4 duygu durum bozukluğu epizodu geçirmiştir. Bu çalışmanın başlangıcında tüm hastalar (n=275), çeşitli duygu durum düzenleyiciler, antidepresanlar ve/veya anksiyolitiklerden oluşan normal tedavilerini sürdürürken ayrıca RISPERDAL CONSTA tedavisi aldıkları, 16 haftalık açık-etiketli tedavi fazına dahil olmuşlardır. 16 haftalık açık-etiketli tedavi fazının sonunda remisyona ulaşan hastalar (n=139), normal tedavilerini sürdürürken ayrıca RISPERDAL CONSTA (n=72) veya plasebo (n=67) aldıkları 52 haftalık, çift-kör, plasebo-kontrollü faza randomize edilmişlerdir. 16 haftalık açık-etiketli tedavi fazının sonunda remisyona ulaşmayan hastalar, normal tedavilerini sürdürürken ayrıca açık-etiketli şekilde destekleyici tedavi olarak RISPERDAL CONSTA almaya devam etmeyi (ek 36 haftaya kadar - klinik açıdan endike olan toplam 52 haftalık tedavi periyodunu geçmeyecek şekilde) tercih edebilirler. Bu hastalar (n=70) da ayrıca güvenlilik değerlendirmesine dahil edilmişlerdir. Advers ilaç reaksiyonların çoğu hafif veya orta derecelidir. Çift-Kör, Plasebo-Kontrollü Veriler - ŞizofreniRISPERDAL CONSTA ile tedavi gören şizofreni hastalarında, 12 haftalık çift-kör, plasebo kontrollü bir çalışmada >%2 sıklıkla görülen advers ilaç reaksiyonları Tablo 1'de gösterilmiştir.
*Parkinsonizm, ekstrapiramidal bozukluk, iskelet-kas katılığı, kas sertliği ve bradikineziyi içerir. Akatizi, akatizi ve huzursuzluğu içerir.Çift-Kör, Plasebo-Kontrollü Veriler - Bipolar BozuklukRISPERDAL CONSTA'nın bipolar I bozukluğu olan hastaların idame tedavisinde monoterapi olarak uygulandığındaki etkinlik ve güvenliliğinin incelendiği bir çalışmanın 24 aylık çift-kör, plasebo kontrollü tedavi fazındaki hastalarda >% 2 sıklıkla bildirilen tedavi-gerektiren advers ilaç reaksiyonları aşağıda sıralanmıştır. Şu terimler ve sıklık dereceleri kullanılmıştır: Çok yaygın (> 1/10); yaygın (> 1/100 ila <1/10); yaygın olmayan (> 1/1000 ila <1/100); seyrek(> 1/10.000 ila <1/1000); çok seyrek (< 1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Sinir sistemi hastalıkları Yaygın: Sersemlik Vasküler hastalıklar Yaygın: Hipertansiyon Araştırmalar Yaygın: Kiloda artış RISPERDAL CONSTA'nın bipolar I bozukluğu olan hastalarda, destekleyici idame tedavisi olarak uygulandığındaki etkinlik ve güvenliliğinin incelendiği bir çalışmanın 52 haftalık çift-kör, plasebo kontrollü tedavi fazındaki hastalarda >% 4'ü sıklıkla bildirilen tedavi-gerektiren advers ilaç reaksiyonları aşağıda sıralanmıştır. Enfeksiyonlar ve enfestasyonlar Yaygın: Üst solunum yolu enfeksiyonu Metabolizma ve beslenme hastalıkları Yaygın: İştahta azalma, iştahta artış Sinir sistemi hastalıkları Çok yaygın: Tremor, parkinsonizm (kaslarda sertlik, hipokinezi, eklem bölgelerinde sertleşme, bradikinezi) Yaygın: Diskinezi (kaslarda seğirme, diskinezi), sedasyon, dikkat dağınıklığı Solunum, göğüs bozuklukları ve mediastinal hastalıklar Yaygın: Öksürük Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları Yaygın: Artralji Üreme sistemi ve meme hastalıkları Yaygın: Amenore Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar Yaygın: Yürüyüşte anormallik Araştırmalar Yaygın: Kiloda artış Diğer Klinik Çalışma VerileriRISPERDAL CONSTA ile tedavi gören şizofreni hastalarında, 12 haftalık çift-kör, plasebo kontrollü bir çalışmada hastaların <%2'sinde veya bipolar I bozukluğu olan hastalarda monoterapi tedavisini değerlendiren, 24-aylık, çift-kör, plasebo kontrollü bir çalışmada RISPERDAL CONSTA ile tedavi edilen hastaların <%2'sinde veya 52 haftalık çift-kör, plasebo kontrollü, bipolar I bozukluğu destekleyici idame tedavisi çalışmasında RISPERDAL CONSTA ile tedavi edilen hastaların <%4'ünde bildirilen ilave advers ilaç reaksiyonları aşağıda verilmiştir. Aşağıda ayrıca RISPERDAL CONSTA ile tedavi edilen, açık etiketli yukarıdaki bipolar bozukluk çalışmaları ile çift kör, aktif kontrollü ve açık etiketli şizofreni ve bipolar I çalışmalarına katılan hastalarda herhangi bir sıklıkta gözlenen advers ilaç reaksiyonları da sıralanmıştır. Enfeksiyonlar ve enfestasyonlar Nazofarenjit, influenza, bronşit, üriner sistem enfeksiyonu, rinit, solunum yolu enfeksiyonu, kulak enfeksiyonu, pnömoni, alt solunum yolu enfeksiyonu, farenjit, sinüzit, viral enfeksiyon, enfeksiyon, lokalize enfeksiyon, sistik, gastroenterit, subkutan apse Kan ve lenf sistemi hastalıkları Anemi, nötropeni Bağışıklık sistemi hastalıkları Aşırı duyarlılık Endokrin hastalıkları Hiperprolaktinemi Metabolizma ve beslenme hastalıkları Anoreksi, hiperglisemi Psikiyatrik hastalıklar Uykusuzluk, anksiyete, ajitasyon, uyku bozukluğu, depresyon, başlangıç uykusuzluğu, libidoda azalma, sinirlilik Sinir sistemi hastalıkları Koordinasyon bozukluğu, distoni, tardif diskinezi, letarji, ağız sulanması, parestezi, postural baş dönmesi, aşırı uyuma, konvülziyon, akinezi, hipokinezi, dizartri Göz hastalıkları Konjunktivit, görme duyarlılığında azalma Kulak ve iç kulak hastalıkları Kulak ağrısı, vertigo Kardiyovasküler hastalıklar Taşikardi, birinci dereceden atriyoventriküler blok, palpitasyonlar, sinüs bradikardi, sol dal bloğu, bradikardi, sinüs taşikardi, sağ dal bloğu, atriyal fibrilasyon Vasküler hastalıklar Hipotansiyon, ortostatik hipotansiyon Solunum, göğüs bozuklukları ve mediastinal hastalıklar Nazal konjesyon, paringolaringeal ağrı, dispne, rinore Gastrointestinal hastalıklar Diyare, kusma, üst karın bölgesinde ağrı, karın ağrısı, mide rahatsızlığı, gastrit Deri ve deri altı doku hastalıkları Döküntü, egzema, yaygın kaşıntı, kaşıntı Duruş bozukluğu, sırt ağrısı, miyalji, kas-iskelet sistemine ait göğüs ağrısı, kalça ağrısı, kaslarda güçsüzlük, boyun ağrısı Böbrek ve idrar hastalıkları Üriner inkontinans Üreme sistemi ve meme hastalıkları Galaktore, oligomenore, erektil disfonksiyon, seksüel disfonksiyon, ejakülasyon bozukluğu, jinekomasti, göğüs rahatsızlığı, menstruasyon bozukluğu, menstruasyonda gecikme, düzensiz menstruasyon, ejakülasyonda gecikme Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar Enjeksiyon bölgesinde ağrı, göğüs sıkıntısı, göğüs ağrısı, influenza benzeri hastalık, tembellik, bitkinlik, duygusuzlaşma, enjeksiyon bölgesinde duyarsızlaşma, şişme veya enfeksiyon reaksiyonu, yüzde ödem Araştırmalar Kan prolaktininde yükselme, alanin aminotransferazda yükselme, anormal elektrokardiyogram, gamma-glutamil transferazda yükselme, kan glukozunda yükselme, hepatik enzimlerde yükselme, aspartat aminotransferazda yükselme, uzamış elektrokardiyogram QT, idrarda glukoz varlığı Yaralanma ve zehirlenme Düşme, prosedürle ilgili ağrı Aşağıdakiler oral risperidon (RİSPERDAL) ile bildirilen ilave advers ilaç reaksiyonlarının bir listesidir. Enfeksiyonlar ve enfestasyonlar Tonsilit, göz enfeksiyonu, selülit, orta kulak iltihabı, onikomikoz, akarodermatit, bronkopnömoni, trakeobronşit, kronik orta kulak iltihabı Kan ve lenf sistemi hastalıkları Granulositopeni İlaç aşırı duyarlılık Metabolizma ve beslenme hastalıkları Polidipsi Psikiyatrik hastalıklar Duyarsızlaşma etkisi, konfüzyonel durum, gece uykudan uyanma, halsizlik, anorgazmi Sinir sistemi hastalıkları Hipertoni, denge bozukluğu, uyaranlara yanıt vermeme, bilinç seviyesinde düşüş, hareketlerde bozukluk, Parkinson benzeri dinlenme tremoru, geçici iskemik atak, serebrovasküler kaza, maske yüz, konuşma bozukluğu, bilinç kaybı, istemsiz kas kasılmaları, serebral iskemi, serebrovasküler bozukluk, nöroleptik malign sendrom, diyabetik koma Göz hastalıkları Oküler hiperemi, göz akıntısı, göz yuvarlanması, gözkapağında ödem, gözde şişme, gözkapağı kenarında kabuklanma, göz kuruluğu, lakrimasyonda artış, fotofobi, glokom Kulak ve iç kulak hastalıkları Kulak çınlaması Kardiyovasküler hastalıklar Atriyoventriküler blok Vasküler hastalıklar Kızarma Solunum, göğüs bozuklukları ve mediastinal hastalıklar Epistaksis, hırıltılı nefes, aspirasyon pnömonisi, disfoni, prodüktif öksürük, pulmoner konjesyon, solunum sistemi konjesyonu, hırıltı, solunum bozukluğu, hiperventilasyon, burun ödemi Gastrointestinal hastalıklar Disfaji, fekaloma, karın bölgesinde rahatsızlık, fekal inkontinans, dudaklarda şişme, dudak iltihabı, tükürük salgısının olmaması Deri ve deri altı doku hastalıkları Eritem, deride renk bozukluğu, deride lezyonlar, deri rahatsızlığı, döküntülü eritematozus, papüler döküntü, hiperkeratoz, kepeklenme, seboroik dermatit, genel döküntü, maculo-papüler döküntü Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları Eklemlerde şişme, eklemlerde sertlik, rabdomyoliz, tortikolis Böbrek ve idrar hastalıkları İdrarını tutamama, ağrılı idrar yapma, sık idrara çıkma Üreme sistemi ve meme hastalıkları Vajinal akıntı, geriye ejakulasyon, ejakulasyon güçlüğü, göğüslerde büyüme Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar Susama, anormal hissetme, yürüyüş bozukluğu, çukur ödem, ödem, titreme, rahatsızlık, genel ödem, ilaç kesilme sendromları, periferal üşüme Araştırmalar Vücut ısısında artış, kalp atış hızında artış, eozinofil sayısında artış, beyaz kan hücre sayısında azalma, hemoglobinde azalma, kan kreatin fosfokinazında artış, hematokritte azalma, vücut ısısında azalma, kan basıncında azalma, transaminazlarda artış Pazarlama Sonrası VerilerRisperidon ile ilk olarak pazarlama sonrası deneyimde spontan bildirimlere dayanan bir sıklık kategorisi ile verilen advers ilaç reaksiyonları Tablo 2'de yer almaktadır. Aşağıdaki terimler ve sıklık dereceleri kullanılmıştır: Çok yaygın (> 1/10); yaygın (> 1/100 ila <1/10); yaygın olmayan (> 1/1000 ila <1/100); seyrek(> 1/10.000 ila <1/1000); çok seyrek (< 1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Tablo 2. Spontan bildirimlere dayanan bir sıklık kategorisi ile risperidonun pazarlama sonrası deneyiminde tanımlanmış olan advers olaylar Kan ve lenf sistemi hastalıkları Çok seyrek: Agranulositoz, trombositopenia Bağışıklık sistemi hastalıkları Çok seyrek: Anafilaktik reaksiyon Endokrin hastalıkları Çok seyrek: Düzensiz antidiüretik hormon salgılanması Metabolizma ve beslenme hastalıkları Çok seyrek: Diyabetik ketoasidoz, Diabetes mellitus, hipoglisemi, su intoksikasyonu Psikiyatrik hastalıklar Çok seyrek: Mani Göz hastalıkları Çok seyrek: Retinal arter oklüzyonub Kardiyak hastalıklar Çok seyrek: Atriyal fibrilasyon Solunum, göğüs bozuklukları ve mediastinal hastalıklar Çok seyrek: Uykuda apne sandromu Gastrointestinal hastalıklar Çok seyrek: Barsak tıkanması, pankreatit Hepato-bilier hastalıklar Çok seyrek: Sarılık Deri ve deri altı doku hastalıkları Çok seyrek: Anjiyoödemc, alopesi Böbrek ve Boşaltım Sistemi hastalıkları Çok seyrek: İdrar retansiyonu Çok seyrek: Priapizm Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar Çok seyrek: Hipotermi, enjeksiyon bölgesinde abse, selülit, kist, hematom, nekroz, nodül veya ülserd dahil enjeksiyon bölgesi reaksiyonları a Araştırılan terimler; trombositopeni, platelet sayısında azalma, platelekritte azalma, platelet üretiminde azalmab Sadece RİSPERDAL CONSTA formülasyonunda, sağ-sol şanta eğilimi olan intrakardiyak bir bozukluk varlığında bildirilmiştir (örneğin fetüste atriyumlar arası belirgin delik).c Araştırılan terimler; anjiyonörotik ödem, kazanılmış C1 esteraz eksikliği, ağız çevresinde ödem, göz kapağında ödem, yüzde ödem, kalıtsal anjiyoödem, laringeal ödem, laringotrakeal ödem, okulo-respiratuar sendrom, ağızda ödem, periorbital ödem, küçük ilik anjiyoödemi, dilde ödemd Bu olaylar ciddi olarak rapor edilmiştir. İzole vakalarda cerrahi müdahale gerekli olmuştur.Pulmoner embolizm ve derin ven trombozu vakaları da dahil olmak üzere, antipsikotik ilaçlarla venöz tromboembolik olay bildirilmiştir-Sıklık bilinmemektedir.4.9. Doz aşımı ve tedavisi Parenteral uygulama ile doz aşımı görülme olasılığı oral uygulamaya göre daha düşük olduğundan, oral uygulamaya ilişkin bilgiler sunulmuştur. BelirtilerGenellikle, bildirilen belirtiler ilacın bilinen farmakolojik etkilerinin artması şeklindedir. Bunlar, sersemlik ile sedasyon, taşikardi ile hipotansiyon ve ekstrapiramidal semptomlardır. Doz aşımında QT-uzaması ve konvülsiyonları bildirilmiştir. Oral RISPERDAL ve paroksetinin birlikte kullanımındaki doz aşımı ile ilişkili olarak torsades de pointes bildirilmiştir. Akut doz aşımı durumlarında birden fazla ilaç ihtimali düşünülmelidir. TedaviSolunum yolu açılmalı ve açık tutulmalı, yeterli oksijenasyon ve ventilasyon sağlanmalıdır. Hasta yakından izlenmeli, hemen kardiyovasküler izlemeye alınmalı ve sürekli elektrokardiyografi ile muhtemel aritmiler takip edilmelidir. RISPERDAL'e özgü bir antidot yoktur. Bu yüzden uygun destekleyici tedavi sağlanmalıdır. Hipotansiyon ve dolaşım kolapsı intravenöz sıvı ve/veya sempatomimetiklerle gerektiği gibi tedavi edilmelidir. Şiddetli ekstrapiramidal belirtilerde antikolinerjik tedavi uygulanmalıdır. Hasta durumu düzelinceye kadar yakın tıbbi gözlem altında tutulmalı ve izlenmelidir. 5. FARMAKOLOJİK ÖZELLİKLER 5.1. Farmakodinamik özellikler Farmakoterapötik Grup: Diğer antipsikotikler ATC Kodu: N05A X08 Risperidon benzersiz özellikleri olan seçici bir monoaminerjik antagonisttir. Serotonin 5-HT2 ve dopamin D2 reseptörlerine yüksek oranda bağlanır. Alfa1-adrenerjik reseptörlere, daha az oranda H1-histamin reseptörlerine ve alfa2-adrenerjik reseptörlere de bağlanır. Risperidon kolinerjik reseptörlere bağlanmaz. Risperidon, güçlü bir dopamin D2 reseptörü antagonisti olarak, şizofrenideki pozitif semptomları düzeltir. Motor aktivitede depresyona ve katalepsi oluşumuna klasik nöroleptiklerden daha az neden olur. Dengeli bir santral serotonin ve dopamin reseptörleri antagonizması, ekstrapiramidal yan etkileri azaltabilir ve tedavinin etkililiğini şizofreninin negatif ve afektif semptomlarına yayabilir. Klinik çalışmalar:ŞizofreniRISPERDAL CONSTA'nın (25 mg ve 50 mg), psikotik bozukluk (şizofreni/şizoafektif bozukluk) belirtilerinin kontrol altına alınmasındaki etkililiği, şizofreni için DSM-IV kriterlerine uyan yetişkin psikotik hastalarda (yatan ve ayakta tedavi gören), 12 haftalık, plasebo kontrollü bir çalışma ile ispatlanmıştır. Stabil şizofreni hastaları üzerinde yapılan 12 haftalık karşılaştırmalı bir çalışmada, RISPERDAL CONSTA®'nın oral tablet formülasyonu kadar etkili olduğu gösterilmiştir. Ayrıca açık etiketli bir çalışmada, RISPERDAL CONSTA®'nın uzun-dönem (50 hafta) güvenlilik ve etkililiği, şizofreni veya şizoafektif bozukluk için DSM-IV kriterlerine uyan stabil psikotik hastalar (yatan ve ayakta tedavi gören) üzerinde değerlendirilmiştir. RISPERDAL CONSTA® ile daha fazla etkililik sağlanmıştır. Şekil 1. Şizofreni hastalarında zamana karşı toplam PANSS skoru ortalaması (LOCF). 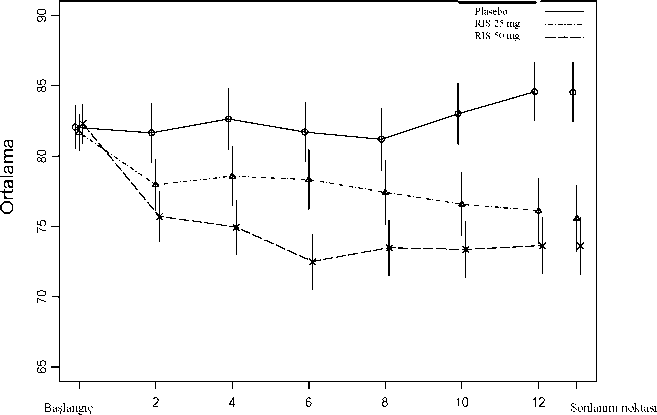
HiiftaŞekil 2. Başlangıçtan itibaren 50 hafta içinde test edilen tüm dozlar için toplam PANSS skorundaki ortalama değişiklik, açık etiketli çalışma.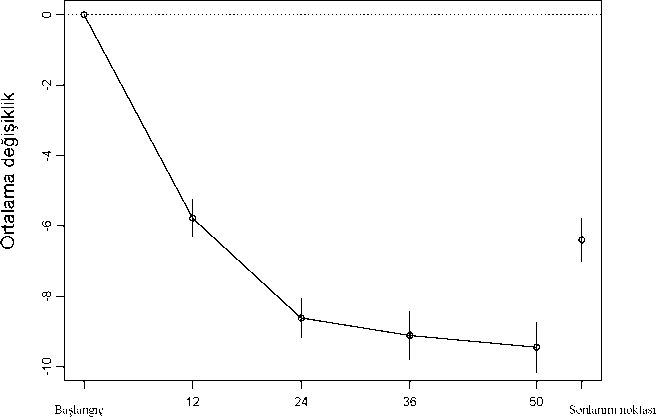
H^ftaNfgatifi^ffiCişImlfşr g(Eiilşsmfyigöstermektedir.Bipolar I Bozukluk İdame Tedavisi - MonoterapiRISPERDAL CONSTA'nın bipolar I bozukluğun idame tedavisinde monoterapi olarak uygulandığındaki etkinliği, Bipolar Bozukluk Tip I için DSM-IV kriterlerini sağlayan ve ilaçlı tedavi ile stabil olan veya akut manik veya karışık epizotlar yaşayan yetişkin hastalarda, çok merkezli, çift-kör, plasebo-kontrollü iki çalışmada saptanmıştır. İlk çalışmada toplam 585 hasta 12 haftalık açık etiketli bir dönem boyunca RISPERDAL® CONSTA® ile tedavi edilmiştir (başlangıç dozu 25 mg olup klinik olarak makul görülürse 37,5 mg veya 50 mg'ye titre edilmiştir). Açık etiketli fazda 410 (%70) hasta stabil remisyona ulaşmış ve aynı dozda RISPERDAL® CONSTA®, plasebo veya olanzapin 10 mg ile çift kör tedaviye randomize edilmiş ve 18 aylık dönem boyunca relaps açısından izlenmiştir. Birincil son nokta, herhangi bir duygudurum epizoduna (depresyon, mani, hipomani veya karma epizod) relaps zamanıdır. Relaps zamanı, RISPERDAL® CONSTA® monoterapisi alan hastalarda plaseboya kıyasla geciktirilmiştir (p = 0,032; log rank testi). 18 aylık çift kör relaps önleme fazı süreci boyunca RISPERDAL® CONSTA® grubundaki hastaların %38,5'inde ve plasebo grubundaki hastaların %55,8'inde relaps görülmüştür. Plasebo grubundaki hastaların relaps yaşama olasılığı, RISPERDAL® CONSTA® grubundaki hastalara göre 1,5 kat fazladır. Relapsların büyük çoğunluğu depresif semptomlardan çok manik semptomlardan kaynaklanmıştır. RISPERDAL® CONSTA®'nın bu çalışmadaki bipolar I bozukluğu olan hastalarda depresyon zamanını geciktirme konusundaki etkililiğini belirlemek için yeterli kanıt yoktur. Bipolar I bozukluk öykülerine dayanarak bu çalışmaya alınan katılımcılar ortalama olarak depresif epizoddan daha fazla manik epizod yaşamıştır. İkinci çalışmada ise; 26 haftalık, açık-etiketli periyot süresince RISPERDAL CONSTA ile (25 mg başlangıç dozu, klinik açıdan gerekli görülürse 37,5 veya 50 mg'a titre edilmiştir; 25 mg'ı tolere edemeyen hastalarda, doz 12,5 mg'a düşürülebilir) toplam 501 hasta tedavi edilmiştir. Açık-etiketli fazda, 303 hastada (%60) stabil remisyon sağlanmıştır ve bu hastalar aynı RISPERDAL CONSTA dozu veya plasebo ile çift-kör tedaviye randomize edilmişlerdir ve 24 aylık periyot süresince nüks için takip edilmişlerdir. Primer sonlanım noktası herhangi bir duygu durum epizodunun (depresyon, mani, hipomani veya karışık) nüks ettiği zamandır. RISPERDAL CONSTA monoterapisi alan hastalarda nüks için geçen zaman plasebo ile karşılaştırıldığında geciktirilmiştir (p <0,001; log rank testi). Deneklerin %25'inin nüks yaşadığı süre plasebo grubunda 82 gün iken RISPERDAL CONSTA grubunda 173 gün olmuştur. 24-aylık, çift-kör nüks önlenmesi fazı süresince RISPERDAL CONSTA grubundaki hastaların %30'unda ve plasebo grubundaki hastaların %56'sında nüks gözlenmiştir. RISPERDAL CONSTA grubu ile karşılaştırıldığında, plasebo grubundaki hastalar nüks geçirmeye 2,5 kat daha yatkın görünmektedirler. Nükslerin çoğunluğu depresif semptomlardan çok maniye bağlıdır. Bu çalışmada, RISPERDAL CONSTA'nın bipolar I bozukluğu olan hastalarda depresyon oluşumunu geciktirmede etkili olup olmadığına dair veriler yetersizdi. Bipolar bozukluk hikayesine bağlı olarak, bu çalışmaya dahil olan hastalar, ortalamada, depresif epizotlardan çok manik epizotlar geçirmişlerdir. Bipolar I Bozukluk - Destekleyici TedaviRISPERDAL CONSTA'nın bipolar bozukluğun destekleyici tedavisindeki etkinliği, Bipolar Bozukluk Tip I için DSM-IV kriterlerini karşılayan ve son 12 ay içerisinde, en az 2'si çalışmanın başlangıcından 6 ay önceki dönem içerisinde olmak üzere, psikiyatrik/klinik müdahale gerektiren en az 4 duygu durum bozukluğu epizodu geçirmiş yetişkin hastalarda yapılan çok-merkezli, çift-kör, plasebo-kontrollü bir çalışmada değerlendirilmiştir. Hastalar, 52 haftalık, çift-kör, plasebo-kontrollü destekleyici tedavi çalışma periyoduna katılmadan önce, bipolar bozukluk tedavisi için aldıkları duygu durum düzenleyiciler, antidepresanlar ve/veya anksiyolitiklerden oluşan tedaviye ilaveten destekleyici tedavi olarak aldıkları RISPERDAL CONSTA'nın 16 haftalık açık etiketli çalışma periyodunun en az son 4 haftasında stabil remisyona ulaşmış olmalıdırlar. RISPERDAL CONSTA'nın başlangıç enjeksiyonunun ilk 3 haftasından sonra tüm oral antipsikotikler kesilmiştir. RISPERDAL CONSTA ile destekleyici tedavi alan hastalarda, yeni bir duygu durum epizodunun nüksetmesine kadar geçen süre, yani primer sonlanım noktası, plaseboya kıyasla gecikmiştir (p=0,001; log rank testi). 52 haftalık, çift-kör, nüksün önlenmesi fazında, RISPERDAL CONSTA grubundaki hastaların %23'ünde, plasebo grubundaki hastaların ise % 46'sında nüks gözlenmiştir. RISPERDAL CONSTA destekleyici tedavi olarak hem manik hem de depresif duygudurum epizodlarının önlenmesinde etkili olmuştur. 5.2. Farmakokinetik özellikler Emilim :RISPERDAL CONSTA'dan risperidonun emilimi tamdır. Dağılım :Risperidon hızla dağılır. Dağılım hacmi 1-2 L/kg'dır. Risperidon plazmada albumin ve alfa1-asit glikoproteinine bağlanır. Plazma proteinlerine bağlanma oranları risperidon için %90, aktif metaboliti 9-hidroksi-risperidon için %77'dir. Biyotransformasyon :Risperidon, CYP2D6 aracılığı ile farmakolojik aktivitesi risperidona benzeyen 9-hidroksi-risperidona metabolize olur. Risperidon ve 9-hidroksi-risperidon birlikte aktif antipsikotik fraksiyonu oluşturur. Risperidon N-dealkilasyon reaksiyonları ile de metabolize edilir. Eliminasyon :Aktif antipsikotik fraksiyon ve risperidon klerensi, CYP2D6 metabolizması hızlı olan bireylerde sırasıyla 5.0 ve 13.7 L/saat, yavaş olanlarda ise 3.2 ve 3.3 L/saat'tir. RISPERDAL CONSTA ile tek intramüsküler (i.m.)(4.2 Pozoloji ve Uygulama Şekli bölümüne bakınız).Salıverilme profili ve doz rejiminin kombinasyonu (iki haftada bir intramüsküler enjeksiyon) uzun süreli terapötik plazma konsantrasyonları sağlar. Terapötik plazma konsantrasyonları son RISPERDAL CONSTA dozunun ardından 4-6 hafta arasında devam eder. Son enjeksiyonu takip eden 7-8. haftalarda eliminasyon fazı tamamlanır. Doğrusallık /Doğrusal Olmayan Durum :Her iki haftada bir tekrarlayan 25 ya da 50 mg RISPERDAL CONSTA intramüsküler enjeksiyonlarından sonra aktif antipsikotik fraksiyonun ortalama vadi ve doruk konsantrasyonları sırasıyla 9,9-19,2 ng/ml ve 17,9-45,5 ng/ml arasında değişir. İki haftada bir enjekte edilen 25-50 mg doz aralığındaki risperidonun farmakokinetiği doğrusaldır. İki haftada bir 25-50 mg enjekte edilen hastalarda, uzun dönemli (12 ay) kullanımda risperidon birikimi gözlenmemiştir. Yukarıdaki çalışmalar kalçaya intramusküler enjeksiyon ile yürütülmüş çalışmalardır. Aynı dozlarda yapılan omuz ve kalça intramusküler enjeksiyonları biyoeşdeğerdir ve dolayısıyla birbirleri ile değiştirilebilir. Oral risperidon ile yapılan bir tek-doz çalışmasında aktif plazma konsantrasyonlarında artış ve aktif antipsikotik fraksiyonun klerensinde yaşlılarda %30, böbrek yetmezliği olan hastalarda ise %60 azalma gözlenmiştir. Karaciğer yetmezliği olan hastalarda risperidonun plazma konsantrasyonları normaldir ancak plazmadaki ortalama serbest risperidon fraksiyonu yaklaşık %35 artmıştır. Etkinlik ve güvenliliğin değerlendirildiği Faz-III çalışmalarının hiç birinde değerlendirme vizitleri arasında aktif antipsikotik fraksiyonun plazma konsantrasyonları ile total PANNS (Pozitif ve Negatif Sendrom Ölçeği) ve total ESRS (Ekstrapiramidal Semptom Derecelendirme Ölçeği) puanlarındaki değişiklikler arasında herhangi bir ilişki gözlenmemiştir. 5.3. Klinik öncesi güvenlilik verileri Sıçan ve köpeklerde risperidon ile yapılan (sub)kronik toksisite çalışmalarına benzer şekilde, RISPERDAL CONSTA ile tedavinin (12 aya dek intramüsküler enjeksiyon) majör etkileri, risperidonun farmakodinamik aktivitesiyle ilişkili olarak prolaktin-aracılı meme bezi stimülasyonu, erkek ve dişi genital yollarında değişiklikler ve santral sinir sistemi (SSS) etkileridir. Genç sıçanlarla yapılan oral toksisite çalışmasında, artan yavru mortalitesi ve fiziksel gelişimde gecikme gözlenmiştir. Oral risperidon tedavisi gören genç köpeklerle yapılan 40 haftalık çalışmada cinsel olgunlaşma gecikmiştir. Uzun kemik gelişimi, adolesanlarda maksimum insan oral dozuna benzer bir dozda etkilenmemiştir (6 mg/gün); adolesanlardaki etkiler maksimum insan oral dozunun 4 katı (AUC temelinde) veya 7 katı (mg/m2 temelinde) dozlarda gözlenmiştir. Erkek ve dişi sıçanlara 12 ve 24 ay boyunca 40 mg/kg/2 hafta dozlarında yapılan RISPERDAL CONSTA uygulaması osteodistrofiye neden olmuştur. Osteodistrofi için sıçanlarda etkili olan doz, mg/m2 bazında incelendiğinde, önerilen maksimum insan dozunun 8 katı olmuştur ve önerilen maksimum dozda insanlarda beklenen maksimum maruziyetin iki katı bir plazma maruziyeti ile ilişkilidir. 12 ay boyunca 20 mg/kg/2 hafta dozda RISPERDAL CONSTA tedavisi alan köpeklerde osteodistrofi gözlenmemiştir. Bu doz, insanlarda önerilen maksimum dozun 14 katı plazma maruziyeti sağlamaktadır. Mutajenik potansiyele ilişkin hiç bir bulgu yoktur. Güçlü bir dopamin D2-antagonistinden bekleneceği gibi, Wistar (Hannover) sıçanları üzerinde (5 ve 40mg/kg/2 hafta dozlar ile) yürütülen bir intramüsküler karsinojenite çalışmasında 40mg/kg dozda endokrin pankreas, hipofiz bezi, adrenal medulla tümörleri insidansında prolaktin-aracılı artış gözlenirken, 5 ve 40mg/kg dozlarda ise meme bezi tümörleri gelişmiştir. Adrenal medulla tümörlerinin insidansını artırdığı varsayılan hiperkalsemi ise, her iki doz grubunda da gözlenmiştir. Hiperkal seminin insanlarda feokromasitomaya yol açtığına dair bulgu yoktur. Erkek sıçanlarda, 40 mg/kg/2 hafta dozlarda renal tubüler adenomalar ortaya çıkmıştır. Düşük doz grubunda, NaCl %0.9 grubunda ya da mikroküre taşıyıcılı kontrol grubunda renal tümör gözlenmemiştir. RISPERDAL CONSTA ile tedavi edilen erkek Wistar (Hannover) sıçanlarındaki renal tümörlerin mekanizması bilinmemektedir. Oral risperidon ile yapılan karsinojenite çalışmalarında, Wistar (Wiga) sıçanlarda ya da Swiss farelerde tedavi ile ilişkili renal tümör insidansında artış ortaya çıkmamıştır. Tümör organ profilleri arasındaki farklılığı ortaya koymak için yapılan çalışmalar, karsinojenite çalışmasında kullanılan Wistar (Hannover) türünün, oral karsinojenite çalışmalarında kullanılan Wistar (Wiga) türüne göre, spontan yaşa bağlı non-neoplastik renal değişiklikler, serum prolaktin artışları ve risperidona bağımlı renal değişiklikler açısından büyük ölçüde farklılık gösterdiğini ortaya koymuştur. Kronik olarak RISPERDAL CONSTA tedavisi alan köpeklerde böbrek ile ilgili değişiklikler olduğuna dair veri yoktur. Osteodistrofinin, prolaktin ile ilişkili tümörlerin ve sıçan türlerine spesifik renal tümörlerin insandaki risk açısından önemi bilinmemektedir. Yüksek doz RISPERDAL CONSTA uygulamalarından sonra köpekler ve sıçanlarda enjeksiyon bölgesinde lokal irritasyon gözlenmiştir. Sıçanlarda yapılan 24 ay süreli IM karsinojenite çalışmasında, taşıyıcı veya aktif ilaç grubunda enjeksiyon bölgesi tümörlerinde artış gözlenmemiştir. 6. FARMASÖTİK ÖZELLİKLER 6.1 Yardımcı maddelerin listesi RISPERDAL CONSTA® uzatılmış salımlı mikrokürelerSeyrelticiPolisorbat 20Karmeloz sodyum 40mPa.s Disodyum hidrojen fosfat dihidrat Susuz sitrik asit Sodyum klorür Sodyum hidroksit Enjeksiyonluk su 6.2. Geçimsizlikler: RISPERDAL CONSTA uygulama için verilen seyreltici dışında herhangi bir ilaç veya sıvı ile karıştırılmamalı veya seyreltilmemelidir. 6.3. Raf ömrü: 36 ay Seyreltildikten sonra: Kullanım sırasındaki fiziksel ve kimyasal stabilitesinin 25°C'de 24 saat olduğu kanıtlanmıştır. Mikrobiyolojik açıdan bakıldığında ürün hemen kullanılmalıdır. Hemen kullanılmadığı takdirde, kullanım sırasındaki saklama süresi ve koşulları, kullanıcının sorumluluğundadır ve normal şartlarda çözündürme, kontrollü ve valide edilmiş aseptik koşullarda gerçekleştirilmediği sürece seyreltildikten sonra 25°C'de 6 saatten fazla saklanmamalıdır. 6.4. Saklamaya yönelik özel uyarılar 2-8°C arası sıcaklıklarda (buzdolabında) saklayınız. Işıktan koruyunuz. 25°C üzerindeki sıcaklıklara maruz bırakmayınız. Eğer buzdolabında saklanamıyorsa, RISPERDAL CONSTA uygulamadan önce en fazla 7 gün süresince 25°C altındaki oda sıcaklıklarında saklanmalıdır. Buzdolabında saklanmayan ürünü 25°C üzerindeki sıcaklıklara maruz bırakmayınız. 6.5. Ambalajın niteliği ve içeriği İğnesiz Flakon Kullanım Aparatı RISPERDAL CONSTA uzatılmış salımlı mikroküreler içeren bir flakon RISPERDAL CONSTA için seyreltici içeren kullanıma hazır dolu enjektör Seyreltme için bir Alaris SmartSite® İğnesiz Flakon Kullanım Aparatı İntramusküler enjeksiyon için iki Needle-Pro® iğnesi (omuza uygulama için iğne koruyucu aparatı ile birlikte 21G 1-inch UTW emniyetli iğne ve kalçaya uygulama için iğne koruyucu aparatı ile birlikte 20G 2-inch TW emniyetli iğne) 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler İğnesiz Flakon Kullanım Aparatı için TalimatlarRISPERDAL CONSTA uzatılmış salımlı mikroküreler içeren flakon sadece doz ambalajında yer alan enjektördeki seyrelticiyle sulandırılarak hazırlanmalı ve sadece doz ambalaj ındaki gluteal (2 inchlik iğne) veya deltoid (1 inchlik iğne) uygulama için verilmiş olan uygun iğne ile uygulanmalıdır. Doz ambalajındaki bileşenlerden hiçbirinin yerine başka bir bileşen kullanmayın. Hedeflenen risperidon dozunun alındığından emin olmak için, flakonun içeriğinin tamamı uygulanmalıdır. İçeriğin kısmen uygulanması, hedeflenen dozda risperidon alınmamasına yol açabilir.  IinBuzdolabından çıkarttığınız RISPERDAL CONSTA'yı seyreltmeden önce oda ısısına gelmesi için bir süre bekleyiniz.Doz ambalajının içeriği: RISPERDAL CONSTA uzatılmış salımlı mikroküreler içeren bir flakon RISPERDAL CONSTA için seyreltici içeren kullanıma hazır dolu enjektör Seyreltme için bir Alaris SmartSite® İğnesiz Flakon Kullanım Aparatı İntramusküler enjeksiyon için iki Needle-Pro® iğnesi (omuza uygulama için iğne koruyucu aparatı ile birlikte 21G 1-inch UTW emniyetli iğne ve kalçaya uygulama için iğne koruyucu aparatı ile birlikte 20G 2-inch TW emniyetli iğne) 1. Flakonun üzerindeki renkli plastik kapağı çıkarınız.
Uygulama aparatının sivri ucuna hiç bir zaman dokunmayınız. 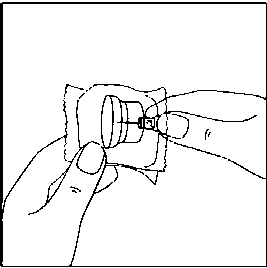 3. Flakonu sert bir yüzeye koyunuz. Flakon kullanım aparatının ince ucunu, flakonun lastik tıpasının ortasına doğru, aparat flakonun tepesine güvenli bir şekilde oturana kadar, düz olarak aşağıya doğru itme hareketiyle bastırınız.
3. Flakonu sert bir yüzeye koyunuz. Flakon kullanım aparatının ince ucunu, flakonun lastik tıpasının ortasına doğru, aparat flakonun tepesine güvenli bir şekilde oturana kadar, düz olarak aşağıya doğru itme hareketiyle bastırınız.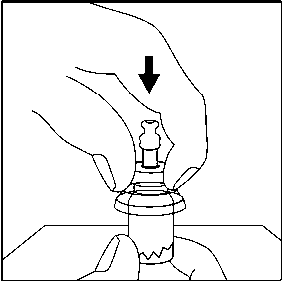 4. Enjektörü flakon kullanım aparatına bağlanmadan hemen önce, flakon kullanım aparatının enjektör birleşme noktasını (mavi daire) tercih edilen antiseptik ile siliniz.
4. Enjektörü flakon kullanım aparatına bağlanmadan hemen önce, flakon kullanım aparatının enjektör birleşme noktasını (mavi daire) tercih edilen antiseptik ile siliniz.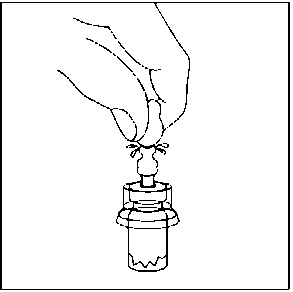 5. Kullanıma hazır enjektörün beyaz ucu iki parçadan oluşur: Beyaz halka ve düz beyaz başlık. Enjektörü açmak için, beyaz halkadan tutun ve düz beyaz başlığı çekin (BEYAZ BAŞLIĞI ÇEVİRMEYİN) Beyaz başlığı, içindeki kauçuk ucuyla kapağıyla birlikte çıkarın.
5. Kullanıma hazır enjektörün beyaz ucu iki parçadan oluşur: Beyaz halka ve düz beyaz başlık. Enjektörü açmak için, beyaz halkadan tutun ve düz beyaz başlığı çekin (BEYAZ BAŞLIĞI ÇEVİRMEYİN) Beyaz başlığı, içindeki kauçuk ucuyla kapağıyla birlikte çıkarın.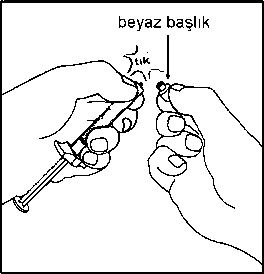 Birleştirme adımlarında, enjektörü sadece ucundaki beyaz halkadan tutun. Birleştirme sırasında bileşenleri aşırı sıkmamaya dikkat edin. Bağlantıları fazla sıkmak, enjektör parçalarının enjektör gövdesinden ayrılmasına yol açabilir.
Birleştirme adımlarında, enjektörü sadece ucundaki beyaz halkadan tutun. Birleştirme sırasında bileşenleri aşırı sıkmamaya dikkat edin. Bağlantıları fazla sıkmak, enjektör parçalarının enjektör gövdesinden ayrılmasına yol açabilir.6. Enjektörün beyaz halkasını tutarken, enjektör ucunu flakon erişim cihazının mavi halkası sokup bastırın ve enjektörün flakon erişim cihazıyla bağlantısının sağlam olması için erişim saat yönünde çevirin (fazla çevirmekten kaçının). Bağlantı sırasında flakon erişim cihazının dönmesini önlemek için kenarından tutun. Enjektör ve flakon kullanım aparatını aynı hizada tutunuz.
7. Seyreltici içeren, enjektörün tüm içeriğini flakona enjekte edin. 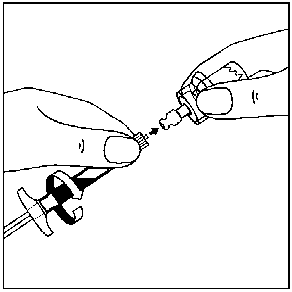 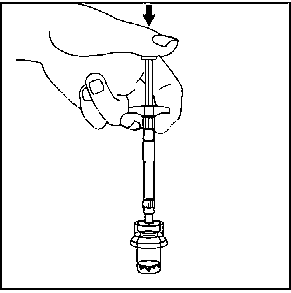 Homojen bir süspansiyon elde etmek için, pistonu başparmağınızla kavrayıp aşağı yönde tutarak flakonu minimum 10 saniye süreyle iyice çalkalayın.
Homojen bir süspansiyon elde etmek için, pistonu başparmağınızla kavrayıp aşağı yönde tutarak flakonu minimum 10 saniye süreyle iyice çalkalayın.Süspansiyon uygun şekilde karıştırıldığında homojen, koyu ve sütlü renkte görünür. Mikroküreler sıvı içinde görünür olabilir, ancak kuru mikroküre kalmamış olmalıdır. 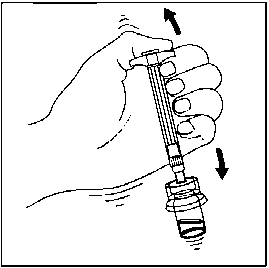
9. SÜSPANSİYON ÇÖKEBİLECEĞİNDEN, SEYRELTTİĞİNİZ FLAKONU DAHA SONRA KULLANMAK ÜZERE SAKLAMAYINIZ.10. Flakonu tamamen ters çeviriniz ve süspansiyonun tamamını flakondan enjektöre çekiniz.Flakon üzerindeki ayrılabilir etiketi koparın ve enjektörü tanımlamak için etiketi enjektöre yapıştırın. 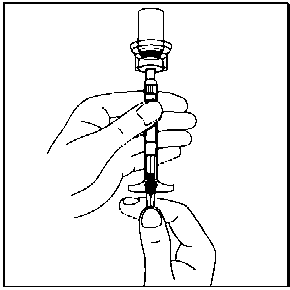 11. Enjektörün beyaz halkasını tutarken, enjektörü flakon erişim cihazından çevirerek çıkarın. Flakonu ve flakon erişim cihazını uygun şekilde atın.
11. Enjektörün beyaz halkasını tutarken, enjektörü flakon erişim cihazından çevirerek çıkarın. Flakonu ve flakon erişim cihazını uygun şekilde atın.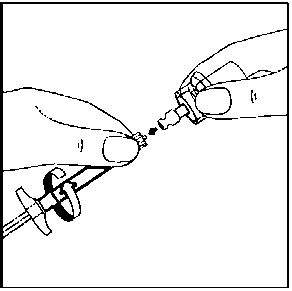 12. İğne ambalaj ını açınız ve uygun iğneyi seçiniz. İğnenin birleşme yerine DOKUNMAYINIZ, iğnenin yalnızca şeffaf kılıfını tutunuz.
12. İğne ambalaj ını açınız ve uygun iğneyi seçiniz. İğnenin birleşme yerine DOKUNMAYINIZ, iğnenin yalnızca şeffaf kılıfını tutunuz.Kalçaya enjeksiyon için 20G TW 2-inch iğneyi (sarı renkli uzun iğne) seçiniz. Omuza enjeksiyon için 21G UTW 1-inch iğneyi (yeşil renkli kısa iğne) seçiniz. 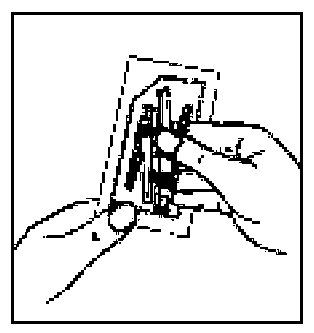 13. Enjektörün beyaz halkasını tutarken, turuncu Needle-Pro® güvenlik aparatının Luer bağlantısını basit bir saat yönünde dönme hareketiyle enjektöre takın.
13. Enjektörün beyaz halkasını tutarken, turuncu Needle-Pro® güvenlik aparatının Luer bağlantısını basit bir saat yönünde dönme hareketiyle enjektöre takın.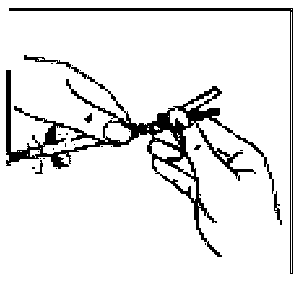 14. Enjektörün beyaz halkasını tutmaya sürdürerek, şeffaf iğne kılıfını kavrayın ve iğneyi saat yönünde çevirirken iterek turuncu renkli Needle-Pro® güvenlik aparatına sıkıca oturtun.
14. Enjektörün beyaz halkasını tutmaya sürdürerek, şeffaf iğne kılıfını kavrayın ve iğneyi saat yönünde çevirirken iterek turuncu renkli Needle-Pro® güvenlik aparatına sıkıca oturtun.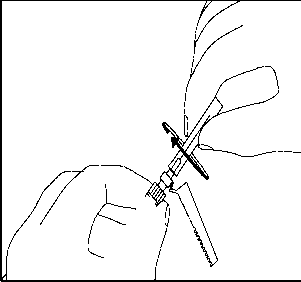 15. ÜRÜN SULANDIRILARAK HAZIRLANDIKTAN SONRA ZAMAN İÇİNDE ÇÖKELME OLACAĞI İÇİN, RISPERDAL® CONSTA® UYGULAMADAN ÖNCE TEKRAR SÜSPANSE EDİLMESİ GEREKLİDİR. HIZLA ÇALKALAYARAK ENJEKTÖRDEKİ MİKROKÜRELERİ TEKRAR SÜSPANSİYON HALİNE GETİRİN.
15. ÜRÜN SULANDIRILARAK HAZIRLANDIKTAN SONRA ZAMAN İÇİNDE ÇÖKELME OLACAĞI İÇİN, RISPERDAL® CONSTA® UYGULAMADAN ÖNCE TEKRAR SÜSPANSE EDİLMESİ GEREKLİDİR. HIZLA ÇALKALAYARAK ENJEKTÖRDEKİ MİKROKÜRELERİ TEKRAR SÜSPANSİYON HALİNE GETİRİN.16. Enjektörün beyaz halkasını tutarak, şeffaf kılıfı iğnenin tam aksi yönde çekin. Luer bağlantılarının gevşememesi için kılıfı ÇEVİRMEYİN. 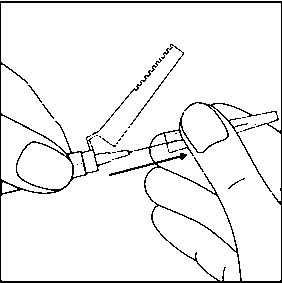 17. Olası hava kabarcıklarının yukarı çıkması için enjektöre hafifçe vurun.
17. Olası hava kabarcıklarının yukarı çıkması için enjektöre hafifçe vurun.Enjektördeki havayı çıkarmak için, iğneyi dik konumda tutarak piston çubuğuna bastırın. Enjektörün tüm içeriğini, hastanın seçilen gluteal veya deltoid kasına intramüsküler olarak enjekte edin. Gluteal enjeksiyon, gluteal alanın üst-dış çeyreğine uygulanmalıdır. İNTRAVENÖZ ENJEKSİYON YOLU İLE UYGULAMAYINIZ. 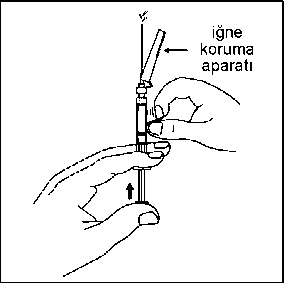 Needle-Pro® güvenlik aparatını iğne üzerine serbest elinizle bastırmayın.
Needle-Pro® güvenlik aparatını iğne üzerine serbest elinizle bastırmayın.Needle-Pro® güvenlik aparatını devreden çıkarmayın. İğne eğilmiş veya zarar görmüşse, iğneyi düzeltmeye ya da Needle-Pro® güvenlik aparatını takmaya çalışmayın. İğnenin Needle-Pro® güvenlik aparatından dışarı çıkmasına yol açmamak için, Needle-Pro® güvenlik aparatını yanlış kullanmaktan kaçının. 18. Enjeksiyon tamamlandıktan sonra, tek el tekniğini kullanarak iğneyi turuncu renkli Needle-Pro® güvenlik aparatının içine bastırın. Tek el tekniğini kullanarak turuncu renkli Needle-Pro® güvenlik aparatını masanın üstüne veya başka bir sert zemine YAVAŞÇA bastırın. TURUNCU RENKLİ NEEDLE-PRO® GÜVENLİK CİHAZINA BASILDIĞINDA, İĞNE TURUNCU RENKLİ NEEDLE-PRO® GÜVENLİK CİHAZININ İÇİNE GİRECEKTİR. İğneyi atmadan önce, turuncu Needle-Pro® güvenlik aparatının içine tam olarak girmiş olduğunu görsel olarak kontrol edip doğrulayın. İğneyi uygun şekilde atın. Verilen diğer iğneyi (kullanılmayan) da doz ambalajının içine koyarak atın. 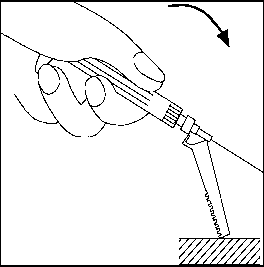 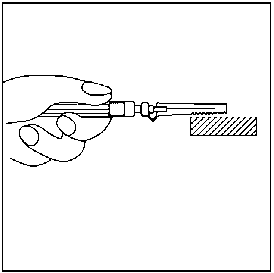 7. RUHSAT SAHİBİ
7. RUHSAT SAHİBİJohnson and Johnson Sıhhi Malzeme San. ve Tic. Ltd. Şti., Kavacık Mahallesi Ertürk Sokak Keçeli Plaza No:13 Kavacık, Beykoz-İstanbul Tel: 0 216 538 20 00 Faks: 0 216 538 23 69 8. RUHSAT NUMARASI 15.01.2004-115/43 9. ILK RUHSAT TARIHI/RUHSAT YENILEME TARIHIİlk ruhsatlandırma tarihi:Son yenileme tarihi:10. KÜB'ÜN YENILENME TARIHI31 Mayıs 2011 |
İlaç BilgileriRisperdal Consta 25 mg uzun salınımlı IM enjeksiyonluk flakonEtken Maddesi: Risperidon Atc Kodu: N05AX08 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.