Gilenya 0.5 mg kapsül Kısa Ürün BilgisiKISA URUN BILGISI1. BEŞERI TIBBI URUNUN ADIGILENYA 0.5 mg kapsül2. KALITATIF VE KANTIFATIF BILEŞIMEtkin madde:Fingolimod hidroklorür 0.56 mg (0.5 mg fingolimoda eşdeğer)Yardımcı maddeler:Yardımcı maddeler için 6.1'e bakınız.3. FARMASÖTIK FORMKapsülBeyaz opak gövde parlak sarı opak başlıklı, başlığı üzerinde siyah mürekkeple radyal FTY 0.5 mg yazısı basılı ve gövde üzerinde sarı mürekkeple iki radyal bant baskısı bulunan kapsül. 4. KLINIK ÖZELLIKLER4.1. T erapötik endikasyonlarGILENYA, çok aktif durumlarda RR tipindeki erişkin MS hastalarının tedavisinde şu durumlarda:1) Tedavi almamış / yeni tanılı hastalarda 1 yılda 2 veya daha fazla, 2 yılda 3 veya daha fazla ciddi atak ve beyin MR'ında 1 veya daha fazla Gadolinyum tutan lezyon veya bir önceki MR'a kıyasla (tercihen 3 ay) T2 lezyonlarında anlamlı artış görülmesi durumunda, 2) Yeterli süre ve yeterli dozda uygulanan bir beta interferon veya glatiramer asetat tedavisine yanıt vermeyen ve yüksek hastalık aktivitesine sahip olan hastalar - Yeterli süre; en azından bir yıllık tedavi - Yanıt vermeyen hastalar; bir yıllık tedavi ile ataklarında değişiklik olmayan, ataklarında artış gözlenen, daha ciddi atakları olan veya önceki tedaviler ile son yıl içinde en az bir atak geçirmiş ve kraniyal MR'ında bir veya birden fazla kontrast tutan lezyon veya birbirini takip eden MR'larda T2 lezyonlarının arttığı durumlardaki hastalarda endikedir. 3) Parenteral ilaç kullanımı veya kullanılan maddeye karşı oluşan yan etkileri nedeniyle ilk basamak tedavilerini tolere edemeyen, uzun yıllar boyunca enjeksiyon tedavisi nedeniyle vücutta enjeksiyona uygun yer kalmayan RR tipte erişkin MS hastalarının tedavisinde endikedir. 4.2. Pozoloji ve uygulama şekliTedavi, MS konusunda uzman bir doktor gözetiminde başlatılmalı ve devam ettirilmelidir.PozolojiGILENYA'nın önerilen dozu aç veya tok karnına günde bir kez oral olarak alınabilen bir adet 0.5 mg kapsüldür. Bir doz atlanırsa, tedavi bir sonraki dozla planlandığı şekilde devam ettirilmelidir.Yüksek derece atriyo-ventriküler blokları veya hasta sinüs sendromu olan hastalar GILENYA'nın iyi tolere edildiğini doğrulamak üzere tedavi başlangıcını takiben 6 saat boyunca gözlenmelidir. Benzer öneriler düşük istirahat kalp atışı olan hastalar ve beta blokerler kullanan hastalar için de geçerlidir (Bkz. Bölüm 4.4 Özel kullanım uyarıları ve önlemleri, bradiaritmi alt bölümü). Hastalar nötropeni gibi ilgili tedavi ilişkili anomali belirtileri söz konusu olmadığı sürece beta interferon veya glatiramer asetattan GILENYA tedavisine geçebilir geçirilebilir. Uygulama sıklığı ve süresi:Önerilen doz aç veya tok karnına günde bir kez oral olarak alınabilen bir adet 0.5 mg kapsüldür.Uygulama şekli:Ağızdan kullanım içindir.Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:GILENYA dozuna ilişkin herhangi bir ayarlama gerekli değildir (Bkz. Bölüm 5.2 Farmakokinetik özellikler).Karaciğer yetmezliği:Hafif veya orta şiddette karaciğer yetmezliği olan hastalarda GILENYA'ya ilişkin herhangi bir doz ayarlaması gerekli değildir. GILENYA şiddetli karaciğer yetmezliği (Child-Pugh sınıf C) olan hastalarda kullanılmamalıdır (Bkz. Bölüm 4.3. Kontrendikasyonlar ve Bölüm 5.2 Farmakokinetik özellikler).Pediatrik popülasyonGILENYA pediatrik hastalarda kullanım için endike değildir (Bkz. Bölüm 5.2 Farmakokinetik özellikler).Geriatrik popülasyonGILENYA 65 yaş ve üzerindeki hastalarda dikkatle kullanılmalıdır (Bkz. Bölüm 5.2 Farmakokinetik özellikler).IrkEtnik orijine göre GILENYA dozu ayarlaması gerekli değildir (Bkz. Bölüm 5.2 Farmakokinetik özellikler).CinsiyetCinsiyete göre GILENYA dozu ayarlaması gerekli değildir (Bkz. Bölüm 5.2 Farmakokinetik özellikler).4.3. Kontrendikasyonlar Bağışıklık yetmezlik sendromu İmmün sistemi baskılanmış hastalar da dahil olmak üzere fırsatçı enfeksiyonlar açısından artmış risk taşıyan hastalar (halihazırda immünosupresif tedavi görmekte olan veya önceki tedaviden dolayı immün sistemi baskılanmış hastalar dahil). Şiddetli aktif enfeksiyonlar, aktif kronik enfeksiyonlar (hepatit, tüberküloz). Kutanöz bazal hücreli karsinomu olan hastalar haricinde bilinen aktif maligniteler. Şiddetli karaciğer bozukluğu (Child-Pugh sınıf C). Etkin maddeye veya ürünün içeriğinde yer alan yardımcı maddelerden herhangi birine (Bkz. Bölüm 6.1 Yardımcı maddelerin listesi) karşı aşırı duyarlılıkta kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriEnfeksiyonlar:GILENYA'nın temel bir farmakodinamik etkisi periferik lenfosit sayısında doza bağımlı olarak başlangıç değerlerinin % 20-30 oranında azalmasıdır. Bu durum lenfositlerin geri dönüşümlü olarak lenfoid dokularda alıkonulmasından kaynaklanmaktadır (Bkz. Bölüm 5.1 Farmakodinamik özellikleri). GILENYA ile tedavinin başlatılmasından önce, güncel bir tam kan sayımı (TKS) ( son 6 ay içinde yapılmış) mevcut olmalıdır., Ayrıca tedavi sırasında periyodik olarak ve enfeksiyon belirtilerinin görülmesi durumunda da TKS değerlendirmelerinin yapılması önerilmektedir. Mutlak lenfosit sayımı <0.2x109/l değerinde doğrulanırsa, iyileşme görülene kadar tedavi kesilmelidir, çünkü klinik çalışmalarda mutlak lenfosit sayımı <0.2x109/l olan hastalarda fingolimod tedavisi kesilmiştir. Ciddi aktif enfeksiyonu olan hastalarda bu sorun çözülmeden GILENYA tedavisine başlangıç ertelenmelidir. GILENYA tedavisi başlatılmadan önce, suçiçeği geçirmemiş veya varisella zoster virüsüne (VZV) karşı aşılanmamış hastalar VZV antikorları açısından test edilmelidir. GILENYA ile tedavi başlatılmadan önce antikor açısından negatif hastalara VZV aşısı yapılmalı ve ardından GILENYA ile tedavinin başlatılması aşının tam etki göstermesini sağlamak için 1 ay ertelenmelidir. GILENYA'nın immün sistem etkileri (Bkz. Bölüm 5.1 Farmakodinamik özellikleri) enfeksiyon riskini artırabilir (Bkz. Bölüm 4.8 İstenmeyen etkiler). Bu nedenle tedavi sırasında enfeksiyon semptomları olan hastalarda etkili tanısal ve terapötik stratejiler uygulanmalıdır. Tedavinin bırakılmasını takiben fingolimodun eliminasyonu iki aya kadar sürebilir ve bu nedenle enfeksiyon açısından takip bu periyotta da devam etmelidir. Hastalara fingolimodu bıraktıktan sonra 2 aya kadar enfeksiyon semptomlarını bildirmeleri söylenmelidir. İlave immün sistem etkilerine ilişkin risk nedeniyle anti-neoplastik, immünosupresif veya immün düzenleyici tedaviler ile eşzamanlı uygulamada dikkat gösterilmelidir (Bkz. Bölüm 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri). GILENYA kullanan hastalara enfeksiyon belirtilerini doktorlarına bildirmeleri talimatı verilmelidir. Hastada ciddi bir enfeksiyon gelişirse GILENYA tedavisinin durdurulması düşünülmeli ve tedaviye tekrar başlamadan önce fayda-risk profili dikkate alınmalıdır. Aşılama: Aşılama GILENYA ile tedavi sırasında ve sonrasında iki aya kadar daha az etkili olabilir (Bkz. Bölüm 4.4 Özel kullanım uyarıları ve önlemleri; Tedavisinin durdurulması). Canlı attenüe aşıların kullanımından kaçınılmalıdır. Maküler ödem: GILENYA 0.5 mg ile tedavi edilen hastaların % 0.4'ünde özellikle tedavinin ilk 3-4 ayında görme kusuru ile birlikte olan veya olmayan maküler ödem geliştiği bildirilmiştir (Bkz. Bölüm 4.8 İstenmeyen etkiler). Bu nedenle tedavi başlatıldıktan sonraki 3-4. ayda oftalmolojik bir değerlendirme önerilmektedir. Hastalar GILENYA ile tedavi sırasında herhangi bir zamanda görme bozukluğu bildirirse, makülayı da içeren fundus değerlendirmesi yapılmalıdır. Üveit öyküsü olan hastalar ve diabetes mellituslu hastalar maküler ödem açısından artmış risk taşımaktadır (Bkz. Bölüm 4.8 İstenmeyen etkiler). GILENYA eşlik eden diabetes mellitusu olan multipl skleroz hastalarında araştırılmamıştır. Diabetes mellituslu veya üveit öyküsü olan hastaların GILENYA tedavisine başlamadan önce oftalmolojik bir değerlendirmeden geçmeleri ve GILENYA tedavisi sırasında takip değerlendirmeleri yaptırmaları önerilmektedir. Maküler ödemi olan hastalarda GILENYA tedavisine devam edilmesi araştırılmamıştır. Eğer hastada maküler ödem gelişirse GILENYA tedavisine devam edilmemesi önerilir. GILENYA tedavisinin bırakılıp bırakılmamasına ilişkin bir karar, bireysel olarak hastaya potansiyel faydaları ve riskleri dikkate alınarak verilmelidir. Bradiaritmi: GILENYA tedavisine başlandığında kalp hızında geçici bir azalma görülür. İlk dozdan sonra kalp hızı azalması bir saat içinde başlar ve yaklaşık 4-5. saatte maksimuma ulaşır. İkinci doz bir miktar daha fazla azalma ile sonuçlanabilir. Kalp hızı devam eden doz uygulaması ile kronik tedavinin bir ayı içinde başlangıca döner (Bkz. Bölüm 5.1 Farmakodinamik özellikleri). GILENYA 0.5 mg kullanan hastalarda kalp hızındaki azalma dakikada yaklaşık 8 atış civarındadır. Dakikada 40 atışın altındaki kalp hızları çok nadir gözlenmiştir (Bkz. Bölüm 4.8 İstenmeyen etkiler). Bradikardi yaşayan hastalar genellikle geçici ve asemptomatik olmakla birlikte bazı hastalar tedavinin ilk 24 saati içinde düzelen baş dönmesi, yorgunluk, çarpıntıyı da içeren hafif ila orta şiddette semptomlar yaşamıştır. GILENYA ile tedavide, genellikle birinci derece atriyo-ventriküler bloklar olmak üzere (elektrokardiyogramda uzamış PR aralığı) atriyo-ventriküler ileti gecikmeleri tedavi ile ile ilişkilendirilmiştir. GILENYA 0.5 mg kullanan hastaların % 0.5'inden azında ikinci derece atriyo-ventriküler bloklar, genellikle Mobitz tip I (Wenkebach) gözlenmiştir. İleti anomalileri tipik olarak geçici, asemptomatik olup, genellikle tedavi gerektirmemiş ve tedavinin ilk 24 saati içinde düzelmiştir (Bkz. Bölüm 4.8 İstenmeyen etkiler). GILENYA oturur durumdaki kalp atım hızı dakikada 55 atımdan düşük olan hastalarda, beta blokerlerle eşzamanlı tedavi gören hastalarda veya geçmişinde senkop geçiren hastalarda araştırılmamıştır. Kalp hızı üzerinde olası ilave etkileri nedeniyle düşük istirahat kalp hızına sahip hastalarda ve beta blokerlerle eşzamanlı tedavi gören hastalarda tedavi başlatılırken dikkati olunmalıdır (Bkz. Bölüm 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri). Bu hastalarda GILENYA tedavisi başlatıldığında, hastaların GILENYA'nın iyi tolere edilebildiğini doğrulamak üzere 6 saatlik bir periyot boyunca gözlenmeleri önerilmektedir. Doz sonrası bradiaritmi ilişkili semptomların meydana gelmesi durumunda uygun kontrol gerektiği şekilde başlatılmalı ve hasta semptomlar düzelene kadar gözlenmelidir. GILENYA Sınıf Ia (örn., kinidin, prokainamid) veya Sınıf III anti-aritmik ilaçlarla (örn., amiodaron, sotalol) tedavi gerektiren aritmileri olan hastalarda araştırılmamıştır. Sınıf Ia ve Sınıf III anti-aritmik ilaçlar bradikardisi olan hastalarda Torsades de Pointes vakaları ile ilişkilendirilmiştir. GILENYA tedavisinin başlatılması kalp hızının azalmasına neden olduğu için, GILENYA bu ilaçlarla eşzamanlı olarak uygulanmamalıdır. GILENYA ayrıca yüksek dereceli atriyo-ventriküler blokları, hasta sinüs sendromu, iskemik kardiyak hastalığı, konjestif kalp yetmezliği veya ciddi kardiyovasküler hastalığı olan hastalarda da araştırılmamıştır. Bu tarz hastalarda GILENYA kullanımında genel fayda-risk değerlendirmesi temel alınmalı ve ciddi ritm bozuklukları potansiyeli nedeniyle tedavinin başlatılması sırasında dikkatli gözlemlerin yapılması gerekmektedir. Bu hastaların tedavisine başlamadan önce bir kardiyoloji uzmanından tavsiye alınması önerilmektedir. Beta blokerler veya kalp hızını yavaşlatabilecek diğer maddeleri (örn., verapamil, digoksin, antikolinesteratik ajanlar veya pilokarpin) kullanan hastalarda tedavi başlangıcında kalp hızı üzerindeki ilave etkilerden dolayı dikkat gösterilmelidir (Bkz. Bölüm 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri). GILENYA tedavisi 2 haftadan uzun süreli bırakılırsa, GILENYA'nın tekrar kullanılmaya başlanması ile kalp hızı ve atriyo-ventriküler ileti üzerindeki etkiler tekrar edebilir ve ilk doz uygulamasındaki aynı önlemler geçerlidir. QT aralığı: Kararlı durumda, fingolimodun kronotropik etkisi halen mevcutken 1.25 veya 2.5 mg'lık çalışma dozlarına ilişkin kapsamlı bir QT aralığı çalışmasında, fingolimod tedavisi QTcI uzaması ile sonuçlanmış olup, % 90 GA'nın üst sınırı <13.0 ms'dir. Fingolimod ve QTcI uzamasına ilişkin doz veya maruziyet-yanıt ilişkisi söz konusu değildir. Fingolimod tedavisi ile ilişkili olarak, mutlak veya başlangıca göre değişen QTcI aykırı değerlerinin insidansında artışa ilişkin tutarlı bir sinyal mevcut değildir. Bu bulgunun klinikle ilişkisi bilinmemektedir. Multipl skleroz çalışmalarında, klinik olarak anlam taşıyan QTc aralığı uzaması gözlenmemiş olmakla birlikte klinik çalışmalara QT uzaması açısından risk taşıyan hastalar dahil edilmemiştir. QTc aralığını uzatabilecek ilaçlardan veya hipokalemi, konjenital QT uzaması, konjestif kalp hastalığı, sınıf Ia (örn., kinidin, disopiramid) veya sınıf III (örn., amiodaron, sotalol) antiaritmik ilaçların eşzamanlı olarak uygulanması gibi ilgili risk faktörlerini taşıyan hastalarda kullanımdan kaçınılmalıdır. Gebelik: GILENYA tedavisinin başlatılmasından önce çocuk doğurma potansiyeli olan kadınlara fetüse gelebilecek potansiyel riskler ve GILENYA ile tedavi sırasında etkili doğum kontrol yöntemi ihtiyacına ilişkin danışmanlık sağlanmalıdır. Tedavinin bırakılması durumunda bileşiğin vücuttan elimine edilmesi yaklaşık 2 ay alacağından fetüse risk potansiyeli devam edebilir ve bu periyotta doğum kontrolü kullanılmalıdır Karaciğer fonksiyonu: Klinik çalışmalar sırasında, plasebo alan hastaların % 2'sinde, fingolimod 0.5 mg ile tedavi edilen hastaların % 8'inde karaciğer transaminazlarında normal üst sınırın (NÜS) 3 katı veya daha fazla artış meydana geldiği saptanmıştır. Fingolimod kullanan hastaların % 2'si ve plasebo kullanan hastaların % 1'inde NÜS'ün 5 katı artış meydana geldiği gözlenmiştir. Klinik çalışmalarda, artış NÜS'ün 5 katını geçtiğinde fingolimod tedavisi bırakılmıştır. Bazı hastalarda tekrar maruziyet durumunda karaciğer transaminazlarında artışlar nüksetmiş olup, bu durum fingolimodla ilişkiyi desteklemektedir. Artışların çoğu 3-4 ay içinde meydana gelmiştir. Serum transaminaz düzeyleri fingolimod bırakıldıktan sonra yaklaşık 2 ay içinde normale dönmüştür. GILENYA daha önceden şiddetli hepatik hasarı olan (Child-Pugh sınıf C) hastalarda araştırılmamış olup, bu hastalarda kullanılmamalıdır (Bkz. Bölüm 4.3 Kontrendikasyonlar). Fingolimodun immünosupresif özelliklerinden dolayı, aktif viral hepatiti olan hastalarda tedavinin başlatılması iyileşme görülene kadar ertelenmelidir. GILENYA tedavisi başlatılmadan önce güncel (son 6 ay içinde yapılmış) transaminaz ve bilirubin düzeyleri mevcut olmalıdır. Herhangi bir klinik semptom yoksa, karaciğer transaminazları tedavinin 1, 3, ve 6. ayında ve sonrasında periyodik olarak takip edilmelidir. Karaciğer transaminazları NÜS'ün 5 katından fazla artarsa, serum bilirubin ve alkalen fosfataz (ALP) ölçümü dahil daha sık takip gerçekleştirilmelidir. Karaciğer transaminazlarının NÜS'ün 5 katının üzerinde olduğu tekrar tekrar doğrulanırsa, GILENYA ile tedavi bırakılmalı ve sadece karaciğer transaminaz değerleri normale döndüğünde tekrar başlatılmalıdır. Açıklanamayan bulantı, kusma, karın ağrısı, yorgunluk, anoreksi veya sarılık ve/veya koyu renk idrar gibi hepatik fonksiyon bozukluğunu düşündüren semptomlar gelişen hastalarda karaciğer enzimleri kontrol edilmeli ve önemli düzeyde bir karaciğer hasarının doğrulanması durumunda GILENYA bırakılmalıdır (örneğin NÜS'ün 5 katından fazla karaciğer transaminaz düzeyleri ve/veya serum bilirubin artışları). Tedavinin tekrar başlatılması karaciğer hasarına ilişkin başka bir nedenin belirlenip belirlenmemesine ve karaciğer fonksiyon bozukluğu nüksü açısından risklere karşı tedaviyi tekrar başlatmanın hastaya sunacağı faydalara bağlı olacaktır. Daha önce karaciğer hastalığı olan hastaların GILENYA kullanırken karaciğer fonksiyon testlerinde artış gelişmesi açısından artmış bir risk taşıdığını gösteren herhangi bir veri mevcut olmasa da, GILENYA önemli karaciğer hastalığı öyküsü olan hastalarda kullanılırken dikkat gösterilmelidir. Serolojik testle etkileşim: Fingolimod sekonder lenfoid organlarda kan lenfosit sayısını azalttığından, periferik kan lenfosit sayımları GILENYA ile tedavi edilen bir hastanın lenfosit durumunu değerlendirmek üzere kullanılamaz. Dolaşımdaki mononükleer hücrelerle ilgili laboratuvar testleri için, dolaşımdaki lenfositlerin sayısındaki azalmadan dolayı daha yüksek miktarda kan gerekir. Kan basıncı etkileri: İlaçla kontrol edilemeyen hipertansiyonu olan hastalar pazarlama öncesi klinik çalışmalarda hariç tutulmuş olup, kontrol edilemeyen hipertansiyonu olan hastaların GILENYA ile tedavi edilmesi durumunda özel dikkat önerilmektedir. MS klinik çalışmalarında, fingolimod 0.5 mg ile tedavi edilen hastalar sistolik basınçta yaklaşık 2 mmHg ve diyastolik basınçta yaklaşık 1 mmHg'lik bir artış yaşamış olup, bunlar ilk kez tedavi başlatıldıktan yaklaşık 2 ay sonra tespit edilmiş ve tedavi süresince kalıcı olmuştur. İki yıllık plasebo kontrollü çalışmada, hipertansiyon fingolimod 0.5 mg kullanan hastaların % 6.1'inde, plasebo kullanan hastaların ise % 3.8'inde advers olay olarak bildirilmiştir. Bu nedenle kan basıncı GILENYA ile tedavi sırasında düzenli olarak takip edilmelidir. Respiratuvar etkiler: GILENYA tedavisi ile, karbonmonoksit için difüzyon kapasitesi (DLCO) ve zorlu ekspiratuvar hacim (FEV1) değerlerinde 1. Ayda başlayan ve sonrasında stabil olan minör, doza bağımlı azalmalar görülmüştür. GILENYA şiddetli respiratuvar hastalığı, pulmoner fibrozisi ve kronik obstrüktif akciğer hastalığı olan hastalarda dikkatle kullanılmalıdır (Bkz. Bölüm 4.8 İstenmeyen etkiler). İmmünosupresanlarla önceki tedavi: Hastalar interferon veya glatiramer asetattan GILENYA kullanımına geçtiğinde, bu tip tedavilere ilişkin immün etkilerin (örn, sitopeni) ortadan kalkması için beklenecek bir arınma dönemi gerekli değildir. Natalizumabın uzun yarılanma ömrü nedeniyle, GILENYA tedavisinin hemen başlatılması durumunda, natalizumabın bırakılmasını takiben 2-3 aya kadar eşzamanlı maruziyet ve böylece eşzamanlı immün etkiler meydana gelebilir. Bu nedenle hastalar natalizumabdan GILENYA kullanımına geçtiğinde dikkat gösterilmelidir. Diğer immünosupresif ilaçlardan geçiş yapıldığında, GILENYA tedavisi başlatılırken ilave immün baskılayıcı etkilerden kaçınmak üzere bu maddelerin etki süresi ve etki mekanizması dikkate alınmalıdır. Tedavinin durdurulması: GILENYA ile tedaviyi durdurmaya yönelik bir karar alındığında, yarılanma ömrüne dayanarak fingolimodun dolaşımdan temizlenmesi için 6 haftalık tedavisiz bir aralık gereklidir (Bkz. Bölüm 5.2 Farmakokinetik özellikler). Lenfosit sayısı tipik olarak tedavinin durdurulmasının 1-2 ayı içinde normal aralığına dönmektedir (Bkz. Bölüm 5.1 Farmakodinamik özellikleri). Bu süre içersinde diğer tedavilere başlanması fingolimoda eşzamanlı bir maruziyetle sonuçlanacaktır. GILENYA'nın bırakılmasından sonra immünosupresanların kullanımı immün sistem üzerinde ilave bir etkiye yol açabilir, bu nedenle de dikkat gösterilmelidir. Özel popülasyonlara ilişkin ek bilgiler:Diyabetik hastalarGILENYA diabetes mellituslu hastalarda artmış maküler ödem riski potansiyeli nedeniyle dikkatle kullanılmalıdır (Bkz. Bölüm 4.4 Özel kullanım uyarları ve önlemleri, Bölüm 4.8 İstenmeyen etkiler)4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriAnti-neoplastik, immünosupresif veya immün düzenleyici tedaviler:Anti-neoplastik, immünosupresif veya immün düzenleyici tedaviler ilave immün sistem etkileri riski nedeniyle eşzamanlı olarak uygulanmamalıdır (Bkz. Bölüm 4.3 Kontrendikasyonlar ve Bölüm 4.4 Özel kullanım uyarları ve önlemleri). Hastalar natalizumab veya mitoksantron gibi immün etkileri olan uzun etkili tedavilerden geçirilirken dikkatli olunmalıdır (Bkz. Bölüm 4.4 Özel kullanım uyarları ve önlemleri). Multipl skleroz klinik çalışmalarında atakların kısa bir kortikosteroid kürü ile eşzamanlı tedavisi artmış bir enfeksiyon riski ile ilişkilendirilmemiştir. Aşı: GILENYA ile tedavi sırasında ve sonrasında iki aya kadar aşılama daha az etkili olabilir. Canlı attenüe aşıların kullanılması enfeksiyon riski taşıyabileceğinden, bu durumdan kaçınılmalıdır. Bradikardiyi indükleyen maddeler: Fingolimod atenolol ve diltiazem ile kombinasyon halinde araştırılmıştır. Fingolimod atenolol ile kullanıldığında, diltiazem ile görülmeyen ancak fingolimodun başlanmasına bağlı olarak kalp hızında % 15'lik ilave bir azalma meydana gelmektedir. Beta blokerleri veya sınıf Ia ve III antiaritmikler, verapamil veya diltiazem gibi kalsiyum kanalı blokerleri, digoksin, antikolinesteratik ajanlar veya pilokarpin gibi kalp hızını azaltabilecek diğer maddeleri kullanan hastalarda tedavinin başlangıcında, kalp hızı üzerinde ilave etkilerden dolayı dikkat gösterilmelidir (Bkz. Bölüm 4.4 Özel kullanım uyarları ve önlemleri). Halihazırda kalp hızını azaltan bir madde kullanan hastalarda fingolimod tedavisinin başlatılmasına ilişkin potansiyel riskler ve faydalar dikkate alınmalıdır. Farmakokinetik etkileşimler: Fingolimod başlıca insan CYP4F2 aracılığıyla metabolize edilirken, ayrıca CYP2D6*1, 2E1, 3A4 ve 4F12'ye ilişkin anlamlı katkılar da gözlenmiştir. Çoklu CYP izoenzimlerinin fingolimod oksidasyonuna dahil olması fingolimod metabolizmasının tekli spesifik bir CYP inhibitörünün varlığında önemli bir inhibisyona uğratılmayacağını düşündürmektedir. Fingolimod ve fingolimod-fosfatın eşzamanlı ilaçların metabolizmasını inhibe etme potansiyeli: Bir araya toplanmış insan karaciğer mikrozomları ve spesifik metabolik prob substratlarında yapılan in vitroçalışmalar fingolimod ve fingolimod-fosfatın CYP450 enzimlerinin etkinliğini (CYP1A2, CYP2A6, CYP2B6, CYP2C8/9, CYP2C19, CYP2D6, CYP2E1, CYP3A4/5 veya CYP4A9/11) inhibe etme kapasitesinin çok az olduğunu veya böyle bir kapasiteye sahip olmadığını göstermiştir. Bu nedenle fingolimod ve fingolimod-fosfatın başlıca majör sitokrom P450 izoenzimleri ile temizlenen ilaçların temizlenmesini azaltması olası değildir.Fingolimod ve fingolimod-fosfatın kendi ve/veya diğer eşzamanlı ilaçların metabolizmasını indükleme potansiyeli: Fingolimod birincil insan hepatositlerinde insan CYP3A4, CYP1A2, CYP4F2 ve ABCB1 (P-gp) mRNA ve CYP3A, CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19 ve CYP4F2 etkinliğini indükleme potansiyeli açısından incelenmiştir. Fingolimod taşıyıcı kontrolü açısından mRNA veya farklı CYP450 enzimlerini veya ABCBl'i indüklememiş olup, bu nedenle fingolimod ile test edilen CYP450 enzimlerinin veya ABCBl'nin (P-gp) klinik olarak indüksiyonu terapötik konsantrasyonlarda beklenmemektedir. Diğer maddelerin fingolimod üzerindeki farmakokinetik etkileri: Günde iki kez kararlı durumdaki 200 mg ketokonazol ve fingolimod 5 mg tekli dozunun eşzamanlı uygulanması fingolimod ve fingolimod-fosfatın EAA'sinde orta dereceli bir artışa yol açmış (1.7 kat artış) olup, bu durum CYP3A ve CYP4 potent inhibitörlerinin fingolimod farmakokinetiği üzerinde zayıf bir etkisi olduğunu göstermektedir. CYP3A4'ü inhibe edebilecek maddelerle dikkat gösterilmelidir (proteaz inhibitörleri, azol antifungaller, klaritromisin veya telitromisin gibi makrolidler). Fingolimodun diğer maddeler üzerindeki farmakokinetik etkileri: Fingolimodun başlıca CYP450 enzimleri veya ana taşıyıcı proteinlerin substraları ile temizlenen maddelerle etkileşime girmesi olası değildir. Fingolimodun oral doğum kontrol hapları (etinilöstradiol ve levonorgestrel) ile eşzamanlı olarak uygulanması oral doğum kontrolü maruziyetinde herhangi bir değişiklik ortaya koymamıştır. Diğer progestajenleri içeren oral doğum kontrol hapları ile etkileşim çalışması yapılmamıştır, Ancak fingolimodun maruziyetleri üzerinde bir etkiye sahip olması beklenmemektedir. Güçlü CYP450 indükleyicilerinin eşzamanlı olarak uygulanmasının fingolimod ve fingolimod P'ye maruziyeti azaltıp azaltmadığı bilinmemektedir. Taşıyıcılar: Fingolimodun yanı sıra fingolimod-fosfatın OATP1B1, OATP1B3 veya NTCP ile taşınan eşzamanlı ilaçlar ve/veya biyolojiklerin alımını inhibe etmesi beklenmemektedir. Benzer şekilde terapötik dozlarda, meme kanseri direnç proteini (MXR), safra tuzu eksport pompası (BSEP), çoklu ilaç direnci ilişkili protein 2 (MRP2) ve MDR1 aracılı taşınma ile taşınan eşzamanlı ilaçların ve/veya biyolojiklerin dışarı akışını inhibe etmesi beklenmemektedir. Siklosporin: Tek doz fingolimodun farmakokinetiği kararlı durumdaki siklosporin ile eşzamanlı uygulama sırasında değişmemiş ve yine siklosporinin kararlı durum farmakokinetiği tek doz veya çoklu doz (28 gün) fingolimod uygulaması ile değişmemiştir. Bu veriler fingolimodun başlıca CYP3A4 ile temizlenen ilaçların temizlenmesini azaltmasının muhtemel olmadığını ve PgP, MRSP2 ve OATP-C taşıyıcıların potent inhibisyonunun fingolimod dispozisyonunu etkilemediğini göstermiştir. İzoproterenol, atropin, atenolol ve diltiazem: Tek doz fingolimod ve fingolimod-fosfat dozu maruziyeti izoproterenol veya atropinin eşzamanlı uygulanması ile değişmemiştir. Benzer şekilde fingolimod ve fingolimod-fosfatın tek doz farmakokinetiği, hem atenolol hem de diltiazemin farmakokinetiği son iki ilacın fingolimod ile eşzamanlı uygulanması sırasında değişmemiştir. Potansiyel ilaç-ilaç etkileşimlerinin popülasyon farmakokinetiği analizi: Multipl skleroz hastalarında yürütülen bir popülasyon farmakokinetiği değerlendirmesi fluoksetin ve paroksetinin (güçlü CYP2D6 inhibitörleri) ve karbamazepinin (potent enzim indükleyicisi) fingolimod veya fingolimod-fosfat konsantrasyonları üzerinde anlamlı bir etkisi olduğuna ilişkin bir kanıt sağlamamıştır. Ayrıca şu yaygın olarak reçete edilen maddelerin fingolimod veya fingolimod-fosfat konsantrasyonları üzerinde klinik olarak ilgili herhangi bir etkisi (<% 20) saptanmamıştır: baklofen, gabapentin, oksibutinin, amantadin, modafinil, amitriptilin, pregabalin, kortikosteroidler ve oral doğum kontrol hapları. Laboratuar testleri: Fingolimod ikincil lenfoid organlarda tekrar dağılım aracılığıyla kan lenfosit sayımını azalttığından, GILENYA ile tedavi edilen bir hastanın lenfosit alt küme durumunu değerlendirmek için periferik kan lenfosit sayımları kullanılamaz. Dolaşımda mononükleer hücrelerin değerlendirmesini gerektiren laboratuar testleri dolaşımdaki lenfositlerin sayısındaki azalma nedeniyle daha büyük kan hacimleri gerektirmektedir. 4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Hayvanlar üzerinde yapılan çalışmalar, gebelik / ve-veya / embriyonal/fetal gelisim / ve-veya / doğum / ve doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. Bölüm 5.3).Gerekli olmadıkça gebelik döneminde kullanılmamalıdır. GILENYA tedavisinin başlatılmasından önce çocuk doğurma potansiyeli olan kadınlara fetüse gelebilecek potansiyel riskler ve GILENYA ile tedavi sırasında etkili doğum kontrol yöntemi ihtiyacına ilişkin danışmanlık sağlanmalıdır. Tedavinin bırakılması durumunda bileşiğin vücuttan elimine edilmesi yaklaşık 2 ay alacağından fetüse risk potansiyeli devam edebilir ve bu periyotta doğum kontrolü kullanılmalıdır (Bkz. Bölüm 4.4 Özel kullanım uyarları ve önlemleri). Gebelik dönemiFingolimod hidroklorür'ün gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir. (Bkz. Bölüm 5.3 Klinik öncesi güvenlilik verileri). İnsanlara yönelik risk bilinmemektedir.Gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Çocuk doğurma potansiyeli olan kadınlarda tedaviye başlanmadan önce gebelik testi sonuçlarının negatif olduğu kontrol edilmelidir. Tedavi esnasında hasta hamile kalmamalı ve aktif korunma yöntemleri önerilmelidir. GILENYA kullanımı esnasında hamile kalınırsa, GILENYA tedavisinin kesilmesi önerilir. Gebe olan veya gebe olabilecek kadınlarda GILENYA kullanımı sadece potansiyel faydaların fetüse potansiyel riskleri haklı çıkardığı durumlarda düşünülebilir (Bkz. Bölüm 4.6 Gebelik ve laktasyon; Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)). Hayvan çalışmaları fetal kayıp ve organ kusurları, dikkate değer şekilde persistan trunkus arteriosus ve ventriküler septal kusur dahil olmak üzere üreme toksisitesini göstermiştir (Bkz. Bölüm 5.3 Klinik öncesi güvenlilik verileri). Ayrıca fingolimoddan etkilenen reseptörün (sfingozin-1-fosfat reseptörü) embriyogenez sırasında vasküler oluşuma dahil olduğu bilinmektedir. Şu anda insanlarda kardiyovasküler malformasyonların bulunup, bulunamayacağı bilinmemektedir. Gebe kadınlarda fingolimod kullanımıyla ilgili veriler çok kısıtlıdır. Klinik çalışmalarda gebelik tanısı zamanında fingolimoda maruz kalan hastalarda 20 gebe rapor edilmekle birlikte, GILENYA'nın gebelikteki güvenliliği ile ilgili sonuçlar çıkarmak için veriler oldukça kısıtlıdır. Hamile kadınlarda fingolimod kullanımı ile ilgili çok kısıtlı veri bulunmaktadır. Doğum sancısı ve doğum: Fingolimodun doğum sancısı ve doğum üzerindeki etkileri ile ilgili herhangi bir veri yoktur. Laktasyon dönemiFingolimod hidroklorür GILENYA'nın terapötik dozları emziren kadınlara uygulandığı takdirde memedeki çocuk üzerinde etkiye neden olabilecek düzeyde anne sütünde geçmektedir. Fingolimodun, tedavi edilmekte olan laktasyon dönemindeki hayvanların sütlerine, maternal plazmada bulunandan 2-3 kat daha yüksek konsantrasyonlarda geçtiği saptanmıştır (Bkz. Bölüm 5.3 Klinik öncesi güvenlilik verileri). Emzirilen bebeklerde fingolimoddan kaynaklanan ciddi advers ilaç reaksiyonlara ilişkin potansiyel nedeniyle, GILENYA kullanan kadınlar emzirmemelidir.Üreme yeteneği / FertiliteKlinik öncesi çalışmalardan elde edilen veriler fingolimodun azalmış fertiliteye ilişkin artmış bir risk ile ilişkili olmayacağını düşündürmektedir.Mevcut veriler GILENYA'nın erkek aracılı fetal toksisiteye ilişkin bir artışa sebep olabileceğini düşündürmemektedir. 4.7. Araç ve makine kullanımı üzerindeki etkilerGILENYA'nın araç ve makine kullanımı üzerine bilinen etkisi yoktur.Ancak GILENYA ile tedavi başlatıldığında bazen baş dönmesi veya sersemlik görülebilir. GILENYA tedavisi başlatıldığında, hastaların 6 saatlik bir süre boyunca gözlenmeleri önerilmektedir (Bkz. Bölüm 4.4 Özel kullanım uyarları ve önlemleri - Bradiaritmi). 4.8. İstenmeyen etkilerGILENYA kullanan (0.5 veya 1.25 mg doz) toplamda 1703 hasta tekrarlayan-düzelen tip (relapsing-remitting) multipl sklerozu olan hastalarla yapılan iki Faz III çalışmadaki güvenlilik popülasyonunu oluşturmuştur (Bkz. Bölüm 5.1 Farmakodinamik özellikleri). Çalışma No 1 (FREEDOMS) fingolimod ile tedavi edilen 854 multipl sklerozlu hastada (plasebo: 418) yapılan 2 yıllık plasebo kontrollü klinik çalışma olarak tasarlanmıştır. Bu çalışmada önerilen terapötik doz 0.5 mg için en ciddi advers olaylar (ADR'ler) tedavinin başlatılması ile enfeksiyonlar, maküler ödem ve geçici atriyo-ventriküler bloklar olmuştur. 0.5 mg dozda en sık görülen ADR'ler (insidans >% 10) baş ağrısı, grip, diyare, sırt ağrısı, karaciğer enzimi artışları ve öksürük olmuştur. GILENYA 0.5 mg için tedaviye ara verilmesine yol açan % 1'den yüksek bir insidansta en sık rapor edilen advers olay serum transaminaz artışı olmuştur. (% 3.8).Çalışma No 2'deki (TRANSFORMS) (fingolimod ile tedavi olan multipl sklerozlu 849 hastada karşılaştırma ajanı olarak interferon beta-1a kullanan 1 yıllık kontrollü bir çalışma) ADR'ler çalışma süresindeki farklılıklar dikkate alınarak genellikle Çalışma 1 ' e benzer olmuştur. ADR'ler MedDRA sistem organ sınıfına göre listelidir. Sıklıklar şu şekilde tanımlanmıştır: Çok yaygın (>1/10); yaygın (>1/100 ila 1/10); yaygın olmayan (>1/1,000 ila <1/100); seyrek (> 1/10,000 ila <1/1,000); çok seyrek (< 1/10,000); bilinmeyen (eldeki veriler ile bilinemeyen). Her bir sıklık gruplandırması içinde advers olaylar azalan ciddiyetlerine göre derecelendirilir. Enfeksiyonlar ve enfestasyonlarÇok yaygın: Influenza virüsü enfeksiyonlarıYaygın: Bronşit, sinüzit, gastroenterit, Herpes viral enfeksiyonlar*, Tinea enfeksiyonları Yaygın olmayan: Pnömoni* Kan ve lenf sistemi bozukluklarıPsikiyatrik bozukluklarYaygın: DepresyonYaygın olmayan: Depresyonda olma hali Sinir sistemi bozukluklarıÇok yaygın: Baş ağrısıYaygın: Baş dönmesi, parestezi, migren Göz bozukluklarıYaygın: Göz ağrısı, bulanık görüşYaygın olmayan: Maküler ödem** Kardiyak bozukluklarVasküler bozukluklarYaygın: HipertansiyonSolunum sistemi bozukluklarıÇok yaygın: Öksürük Yaygın: DispneGastrointestinal bozukluklarÇok yaygın: DiyareDeri ve deri altı doku bozukluklarıYaygın: Egzama, saç dökülmesi, kaşıntıKas-iskelet, bağ doku ve kemik bozukluklarıÇok yaygın: Sırt ağrısıGenel ve uygulama bölgesine ilişkin bozukluklarYaygın: Asteni AraştırmalarÇok yaygın: Alanin transaminaz (ALT) artışı Yaygın: Gama-glutamil transferaz (GGT) artışı, hepatik enzim artışı, vücut ağırlığında azalma, kan trigliseritleri artışı, karaciğer fonksiyonu testi anomalisi Yaygın olmayan: Nötrofil sayısında azalma * GILENYA ile olası ilişki ** Çalışma 1'de (Study D2301 (FREEDOMS)) 0.5 mg'da bildirilmemiş; ancak diğer çalışmalarda bu dozda vakalar bildirilmiştir. Sıklık kategorisi Çalışma 2'de (Study D2302 (TRANSFORMS) 0.5 mg'daki insidansı temel almaktadır. Enfeksiyonlar: Multipl skleroz klinik çalışmalarında 0.5 mg dozdaki genel enfeksiyon (% 72) ve ciddi enfeksiyon oranı (% 2) plaseboya benzer bulunmuştur. Ancak alt solunum yolu enfeksiyonları, bronşit ve pnömoni GILENYA ile tedavi edilen hastalarda daha yaygın bulunmuştur. 1.25 mg dozda ölümcül olan iki ciddi yaygın herpes enfeksiyonu meydana gelmiştir; asiklovir tedavisinin başlatılması bir hafta geciken bir hastada bir herpes ensefalit vakası ve multipl skleroz atağı için eşzamanlı yüksek dozda steroid tedavi gören daha önce varisella geçirmemiş bir hastada primer yaygın varisella zoster vakası. Maküler Ödem: Klinik çalışmalarda maküler ödem 0.5 mg'lık önerilen GILENYA dozu ile tedavi edilen hastaların % 0.4'ünde ve 1.25 mg'lık daha yüksek dozla tedavi edilen hastaların % 1.1'inde meydana gelmiştir. Multipl skleroz klinik çalışmalarında vakaların çoğunluğu tedavinin ilk 3-4 ayı içinde meydana gelmiştir. Bazı hastalarda bulanık görme veya azalmış görme keskinliği gelişmiş olmakla birlikte diğerleri asemptomatik olup, bu hastalara rutin oftalmolojik muayenede tanı konmuştur. Maküler ödem genellikle ilacın bırakılmasından sonra spontan olarak iyileşmiş veya düzelmiştir. Tekrar uygulamadan sonraki nüks riski değerlendirilmemiştir. Maküler ödem insidansı üveit öyküsü olan multipl sklerozlu hastalarda artmıştır (üveit öyküsü yokluğunda yaklaşık % 0.6'ya karşı üveit öyküsü varlığında % 17). GILENYA diabetes mellituslu multipl skleroz hastalarında araştırılmamıştır. Diabetes mellituslu hastaların dahil edildiği böbrek nakli klinik çalışmalarında GILENYA 2.5 mg ve 5 mg ile tedavi maküler ödem insidansında 2 katlık bir artışla sonuçlanmıştır. Bu nedenle diabetes mellituslu multipl skleroz hastalarının maküler ödem için daha yüksek bir risk taşıması beklenmektedir (Bkz. Bölüm 4.4 Özel kullanım uyarları ve önlemleri). Bradiaritmi: GILENYA tedavisinin başlatılması kalp hızında geçici bir azalma ile sonuçlanmakta olup, ayrıca atriyo-ventriküler ileti gecikmeleri ile de ilişkili olabilir (Bkz. Bölüm 4.4 Özel kullanım uyarları ve önlemleri). Multipl skleroz klinik çalışmalarında ilk dozdan sonra kalp hızındaki ortalama maksimum azalma, GILENYA 0.5 mg için ortalama kalp hızında dakikada 8 atışlık azalmalarla doz ertesi 4-5. saatte görülmüştür. GILENYA 0.5 mg kullanan hastalarda dakikada 40 atış altındaki kalp hızları nadiren gözlenmiştir. Kalp hızı kronik doz uygulamasının 1 ayı içinde başlangıca dönmüştür. Bradikardi genellikle asemptomatiktir ancak bazı hastalar baş dönmesi, yorgunluk ve/veya çarpıntıyı içeren, tedavi başlatıldıktan sonraki ilk 24 saat içinde düzelen hafif ila orta şiddette semptomlar yaşamıştır. Multipl skleroz klinik programında ilacın başlanmasını takiben GILENYA 0.5 mg kullanan hastaların % 4.7'sinde, intramüsküler interferon beta-1a kullanan hastaların % 2.8'inde ve plasebo kullanan hastaların % 1.5'inde birinci derece atriyo-ventriküler blok (elektrokardiyogramda uzamış PR aralığı) tespit edilmiştir. GILENYA 0.5 mg kullanan hastaların % 0.5'inden azında ikinci derece atriyo-ventriküler blok tespit edilmiştir. İleti anomalileri tipik olarak geçici, asemptomatik olup, tedavinin 24 saati içinde düzelmiştir. Çoğu hastada tıbbi girişim gerekmemişse de, 0.5 mg doz kullanan bir hasta asemptomatik ikinci derece atriyo-ventriküler blok için izoprenalin kullanmıştır. 1.25 mg'lık ilk GILENYA dozu uygulandıktan üç saat sonra üçüncü derece atriyo-ventriküler bloka ilişkin geçici bir vaka meydana gelmiş olup, 30 saniye sürmüştür. Hasta kendiliğinden düzelmiştir. Kan basıncı: Multipl skleroz klinik çalışmalarında GILENYA 0.5 mg tedavinin başlatılmasından yaklaşık 2 ay sonra sistolik basınçta yaklaşık 2 mmHg ve diyastolik basınçta yaklaşık 1 mmHg'lik ortalama artışla ilişkili bulunmuştur. Bu artış devam eden tedavi ile kalıcı olmuştur. GILENYA 0.5 mg kullanan hastaların % 6.1'inde ve plasebo kullanan hastaların % 3.8'inde hipertansiyon rapor edilmiştir. Karaciğer transaminazları: Multipl skleroz klinik çalışmalarında GILENYA 0.5 mg ile tedavi edilen hastaların % 8 ve % 2'si serum hepatik transaminaz düzeylerinde sırasıyla >3x ULN ve >5x ULN'lik asemptomatik artışlar yaşamıştır. Bazı hastalarda tekrar maruziyet durumunda karaciğer transaminazlarında artışlar nüksetmiş olup, bu durum fingolimodla ilişkiyi desteklemektedir. Artışların çoğunluğu 3-4 ay içinde meydana gelmiştir. Serum transaminaz düzeyleri GILENYA'nın bırakılmasından sonra yaklaşık 2 ay içinde normale dönmüştür. >5x ULN'lik karaciğer transaminaz artışları yaşayan ve GILENYA tedavisine devam eden az sayıda hastada (GILENYA 1.25 mg'da 10 hasta; GILENYA 0.5 mg'da 2 hasta) artışlar yaklaşık 5 ay içinde normale dönmüştür. Sinir sistemi bozuklukları: Daha yüksek dozlarda (1.25 veya 5.0 mg) fingolimod ile tedavi edilen hastalarda meydana gelen sinir sistemini içeren nadir olaylar iskemik ve hemorajik inmeler ve posterior geri dönüşümlü ensefalopati sendromunu içerir. Akut yaygın ensefalomiyelit (ADEM) benzeri olaylar gibi nörolojik atipik bozukluklar bildirilmiştir. Vasküler olaylar: Yüksek dozlarda (1.25 veya 5.0 mg) GILENYA ile tedavi edilen hastalarda nadir vasküler olay vakaları iskemik ve hemorajik inme, periferik arteryel oklusiv hastalık ve posterior reversibl ensefalopati sendromunu içermektedir. Respiratuvar sistem: GILENYA tedavisi ile, karbonmonoksit için difüzyon kapasitesi (DLCO) ve zorlu ekspiratuar hacim (FEV1) değerlerinde 1. Ayda başlayan ve sonrasında stabil olan minör doza bağımlı azalmalar görülmüştür. 24. Ayda, öngörülen FEV1 yüzdesinde başlangıç değerlerine göre meydana gelen azalma fingolimod için % 3.1 ve plasebo için % 2.0 olup, bu farklılık tedavi bırakıldıktan sonra düzelmiştir. 24. Ayda DLCO azalmaları fingolimod 0.5 mg için % 3.8 ve plasebo için % 2.7'dir. Lenfomalar: Multipl sklerozda klinik çalışma programı sırasında önerilen doz 0.5 mg'da veya üzerinde fingolimoda maruz kalan 4,000 hastalık bir popülasyonda (yaklaşık 10,000 hasta yıl) ölümcül Epstein-Barr virüs (EBV) pozitif B-hücreli lenfoma dahil olmak üzere üç lenfoma vakası bildirilmiştir. 10,000 hasta yılında 3'lük bu insidans (% 95 GA: 0.6-8.8/10,000 hasta yıl) genel popülasyondaki 10,000 hasta yılında 1.9'luk bir arka plan insidansıyla benzerdir. 4.9. Doz aşımı ve tedavisiHiçbir doz aşımı vakası rapor edilmemiştir. Ancak tekli dozlar sağlıklı gönüllülerde önerilen dozun (0.5 mg) 80 katına kadar tolere edilebilmiştir. 6 gönüllüden 5'i 40 mg'da küçük hava yolu reaktivitesi ile klinik olarak tutarlı hafif göğüs darlığı veya rahatsızlığı bildirmiştir.Fingolimod bradikardiyi indükleyip, atriyoventriküler iletimi yavaşlatabilir. Fingolimodun vücuttan anlamlı ölçüde uzaklaştırılması için diyaliz veya plazma değişimi yöntemleri etkili değildir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Selektif immunosupresanlar ATC kodu: L04AA27 Etki mekanizması:Fingolimod bir sfingozin-1-fosfat reseptör düzenleyicisidir. Fingolimod sfingozin kinazla aktif metaboliti fingolimod-fosfata metabolize edilir. Fingolimod-fosfat düşük nanomolar konsantrasyonlarda lenfositlerde yerleşik sfingozin-1-fosfat (S1P) reseptörleri 1, 3 ve 4'e bağlanır ve merkezi sinir sistemindeki nöral hücrelerde yerleşik S1P reseptörleri 1, 3 ve 5'e bağlanmak üzere kolaylıkla kan beyin bariyerini geçer. Lenfositlerdeki S1PR'nin fonksiyonel bir antagonisti olarak iş görmesiyle fingolimod-fosfat lenfositlerin lenf nodlarından çıkış kapasitesini engelleyip, lenfositlerin sayısının azalmasından ziyade tekrar dağılımına neden olur. Bu tekrar dağılım sinir enflamasyonu ve sinir dokusu hasarı ile ilişkili olan patolojik lenfosit hücrelerinin merkezi sinir sistemine infiltrasyonunu azaltır. Hayvan çalışmaları ve in vitrodeneyler fingolimodun multipl skleroz üzerinde ayrıca nöral hücrelerdeki S1P reseptörleri ile etkileşim aracılığıyla da faydalı etkiler sergileyebildiğini göstermektedir.Farmakodinamik Özellikler: İmmün sistem: Kandaki immün hücre sayısı üzerindeki etkiler: İlk 0.5 mg'lık fingolimod dozu uygulamasından sonra 4-6 saat içinde lenfosit sayımı başlangıcın yaklaşık % 75'ine kadar azalır. Devam eden günlük doz uygulaması ile lenfosit sayımı iki haftalık bir periyotta düşmeye devam edip, yaklaşık 500 hücre/^L'lik en düşük lenfosit sayımına veya başlangıcın yaklaşık % 30'una ulaşır. Hastaların yüzde on sekizi en az bir durumda 200 hücre/^L altındaki en düşük değere ulaşmıştır. kronik günlük doz uygulaması ile düşük lenfosit sayısı korunmaktadır. T ve B lenfositlerinin çoğunluğu lenfoid organlardan düzenli olarak geçmekte olup, bunlar fingolimoddan etkilenen başlıca hücrelerdir. T lenfositlerinin yaklaşık % 15-20'si periferik immün sistem hakkında bilgi veren önemli hücreler olan bir efektör hafıza fenotipine sahiptir. Bu lenfosit alt kümesi tipik olarak lenfoid organlara geçmediğinden fingolimoddan etkilenmez. Periferik lenfosit sayısı artışları fingolimod tedavisinin durdurulduğu günler içinde belirgin olup, tipik olarak normal sayısına bir ila iki ay içinde ulaşılır. Kronik fingolimod doz uygulaması nötrofil sayısında başlangıcın yaklaşık % 80'ine kadar hafif bir azalmaya yol açar. Monositler fingolimoddan etkilenmez. Kalp hızı ve ritmi: Fingolimod tedavinin başlangıcında kalp hızında ve atriyo-ventriküler iletide geçici bir azalmaya neden olur (Bkz. Bölüm 4.8 İstenmeyen etkiler). Maksimum kalp hızı azalması ilk günde elde edilen negatif kronotropik etkinin % 70'i ile doz ertesi ilk 4-5 saat içinde görülür. Kalp hızı kronik tedavinin bir ayı içinde ilerleyici bir şekilde başlangıç düzeylerine döner. Kalp hızına ilişkin diürnal varyasyon ve egzersize yanıt dahil olmak üzere kalbin otonom yanıtları fingolimod tedavisinden etkilenmez. Fingolimod tedavisinin başlatılması ile atriyal erken kasılmalarda bir artış görülmekle birlikte atriyal fibrilasyon/çarpıntı veya ventriküler aritmi veya ektopi oranında bir artış görülmez. Fingolimod tedavisi kardiyak çıkışta bir azalma ile ilişkili değildir. Kalp hızında fingolimod tarafından indüklenen bir azalma atropin, izoprenalin veya salmeterol ile geri döndürülebilir. QT aralığını uzatma potansiyeli: Kararlı durumda 1.25 veya 2.5 mg fingolimod dozlarına ilişkin kapsamlı bir QT aralığı çalışmasında, fingolimoda ilişkin negatif bir kronotropik etki halen mevcutken, fingolimod tedavisi <13.0 ms % 90 GA üst sınırına sahip bir QTcI uzaması ile sonuçlanmıştır. Fingolimod ve QTcI uzamasına ilişkin doz maruziyeti-yanıt ilişkisi söz konusu değildir. Fingolimod tedavisi ile ilişkili, QTcI'ya ilişkin mutlak veya başlangıçtan itibaren olan ve insidans artışı olarak belirtilebilecek bir değişiklik görülmemiştir. Multipl skleroz çalışmalarında klinik olarak QT aralığına ilişkin bir uzama görülmemiştir. GILENYA'nın etkililiği tekrarlayan-düzelen tip multipl sklerozlu hastalarda GILENYA 0.5 mg ve 1.25 mg'ın günde bir kez uygulanan dozlarını değerlendirilen iki çalışmada gösterilmiştir. Her iki çalışmada da randomizasyondan önceki 2 yılda en az 2 klinik atak veya randomizasyondan önceki 1 yılda en az 1 klinik atak geçirmiş ve 0 ila 5.5 arasında bir Genişletilmiş Özürlülük Durumu Skalası (EDSS) değerine sahip hastaları dahil etmiştir. Çalışma No 1 (FREEDOMS) en azından önceki 3 ayda herhangi bir interferon-beta veya glatiramer asetat kullanmamış ve en azından önceki 6 ayda herhangi bir doz natalizumab kullanmamış tekrarlayan-düzelen tip multipl sklerozlu hastalarda 2 yıllık, randomize, çift kör, plasebo kontrollü bir Faz III çalışma olarak tasarlanmıştır. Nörolojik değerlendirmeler Taramada, her 3 ayda bir ve atak şüphesinde yapılmıştır. MRG değerlendirmeleri Taramada, 6. ayda, 12. ayda ve 24. ayda yürütülmüştür. Birincil sonlanım noktası yıllık atak oranı olarak belirlenmiştir. Ortalama yaş 37, ortalama hastalık süresi 6.7 ve başlangıçtaki ortalama EDSS skoru 1.0 olarak belirlenmiştir. Hastalar 24 ay boyunca GILENYA 0.5 mg (n=425) veya GILENYA 1.25 mg (n=429) veya plasebo kullanımına randomize edilmiştir. Çalışma ilacını kullanmadaki ortalama süre 0.5 mg'da 717 gün, 125 mg'da 715 gün ve plaseboda 718.5 gün olarak belirlenmiştir. Yıllık atak oranı GILENYA ile tedavi edilen hastalarda plasebo kullananlardan anlamlı olarak daha düşük bulunmuştur. Kilit ikincil sonlanım noktası; başlangıçtan itibaren EDSS'de en az 1 puanlık bir artış meydana gelen(başlangıç EDSS'si 5.5 olanlar için 0.5 puan) ve 3 ay boyunca kalıcı olan 3 aylık doğrulanmış dizabilite progresyonuna kadar geçen süre olarak belirlenmiştir. 3 aylık doğrulanmış dizabilite progresyonunun başlamasına kadar geçen süre plaseboya kıyasla GILENYA tedavisi ile anlamlı olarak gecikmiştir. Hiçbir sonlanım noktasında 0.5 mg ve 1.25 mg arasında anlamlı farklılıklar bulunmamıştır. Bu çalışmanın bulguları Tablo 2'de ve Şekil 1 ve 2'de gösterilmektedir. Tablo 2Çalışma 1'e İlişkin Klinik Bulgular ve MRG Bulguları
Şekil 1 24. Aya varan ilk doğrulanmış atağa kadar geçen zaman için Kaplan-Meiergrafiği- Çalışma D2301 (ITT Popülasyonu)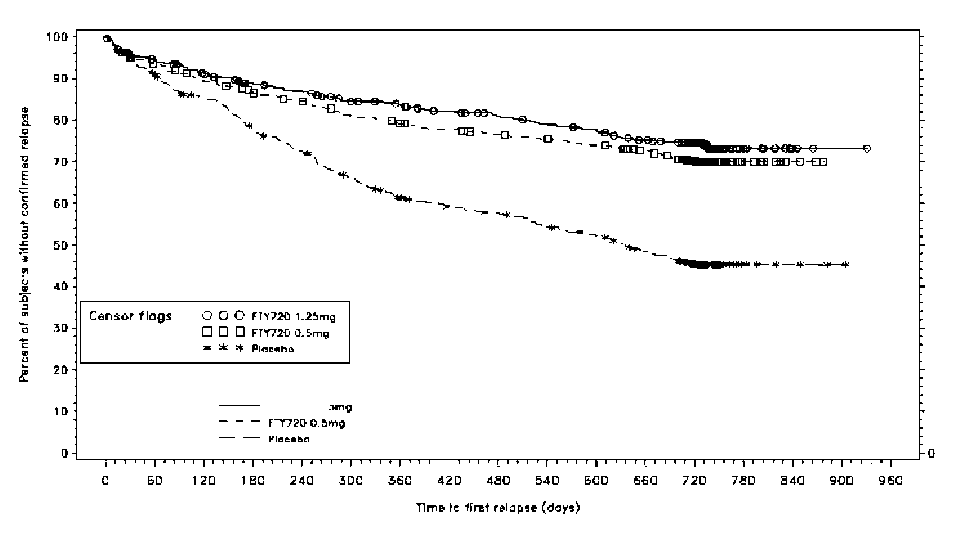
Şekil 2 3 aylık doğrulanmış özürlülük ilerlemesine kadar geçen zamanın kümülatifgrafiği - Çalışma D2301 (ITT Popülasyonu)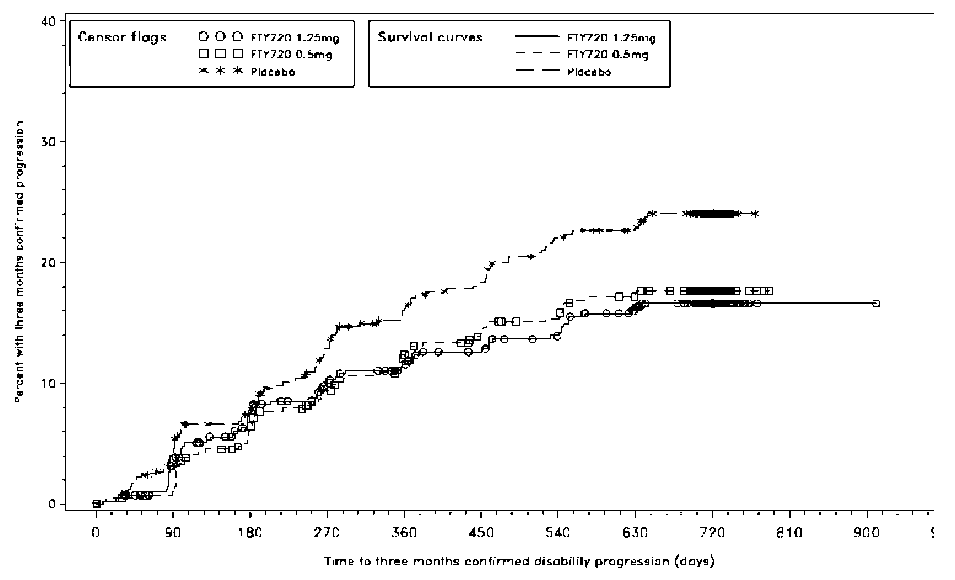 Çalışma D2302 (TRANSFORMS) önceki 6 ayda natalizumab kullanmamış RRMS'li hastalarda 1 yıllık, randomize, çift kör, çift plasebo, aktif (interferon beta-1a) kontrollü bir Faz III çalışma olarak tasarlanmıştır. Önceki interferon beta veya glatiramer asetat tedavisine randomizasyona kadar izin verilmiştir.
Çalışma D2302 (TRANSFORMS) önceki 6 ayda natalizumab kullanmamış RRMS'li hastalarda 1 yıllık, randomize, çift kör, çift plasebo, aktif (interferon beta-1a) kontrollü bir Faz III çalışma olarak tasarlanmıştır. Önceki interferon beta veya glatiramer asetat tedavisine randomizasyona kadar izin verilmiştir.Nörolojik değerlendirmeler Taramada, her 3 ayda bir ve şüpheli atak durumunda yapılmıştır. MRG değerlendirmeleri Taramada ve 12. ayda yürütülmüştür. Birincil sonlanım noktası yıllık atak oranı olarak belirlenmiştir. Ortalama yaş 36, ortalama hastalık süresi 5.9 yıl ve başlangıçtaki ortalama EDSS skoru 2.0 olarak belirlenmiştir. Hastalar 12 hafta boyunca haftada bir kez intramüsküler yolla interferon beta-1a (n=435) veya GILENYA 0.5 mg (n=431) veya 1.25 mg (n=426) kullanan gruplara randomize edilmiştir. Çalışma ilacını kullanmadaki ortalama süre 0.5 mg'da 365 gün, 1.25 mg'da 354 gün ve interferon beta-1a'da 361 gün olarak belirlenmiştir. Yıllık atak oranı GILENYA ile tedavi edilen hastalarda interferon beta-1a kullananlardan anlamlı olarak daha düşük bulunmuştur. GILENYA 0.5 mg ve 1.25 mg arasında anlamlı bir farklılık görülmemiştir. Kilit ikincil sonlanım noktaları yeni veya yeni büyüyen T2 lezyonları ve EDDS'de başlangıçtan itibaren en az 1 puanlık bir artış (başlangıç EDSS'si 5.5 olanlar için 0.5 puan) meydana gelen ve 3 ay boyunca kalıcı olan 3 aylık doğrulanmış dizabilite progresyonunun başlamasına kadar geçen zaman olmuştur. Yeni ve yeni büyüyen T2 lezyonlar GILENYA ile tedavi edilen hastalarda interferon beta1-a kullananlardan anlamlı olarak daha düşük bulunmuştur. 1. yılda 3 aylık doğrulanmış dizabilite progresyonuna kadar geçen zaman ve GILENYA ve interferon beta-1a ile tedavi edilen hastalar arasında anlamlı bir farklılık bulunmamıştır. Tablo 3 Çalışma 2'ye İlişkin Klinik Bulgular ve MRG Bulguları
(p<0.001*)Klinik sonlanım noktalarına ilişkin tüm analizler tedavi amaçlı düzende yapılmıştır. MRG analizleri değerlendirilebilir veri setini kullanmıştır. (p<0.001*)*İki taraflı 0.05 düzeyinde plaseboya karşı istatistiksel anlamlılığı belirtmektedir. p-değerlerinin belirlenmesi: tedavi, ülke, önceki 2 yıldaki atak sayısı ve başlangıç EDSS'sine göre düzeltilmiş negatif binominal regresyon ile agregat ARR; tedavi, ülke, önceki 2 yıldaki atak sayısı ve başlangıç EDSS'sine göre düzeltilmiş lojistik regresyon ile ataksız kalan hasta yüzdesi; tedavi, birleştirilmiş ülke, başlangıç EDSS'si ve yaşa göre düzeltilmiş Cox's oransal tehlikeler modeli ile özürlülük ilerlemesi riski; tedavi, ülke, önceki 2 yıldaki atak sayısı ve başlangıç EDSS'sine göre düzeltilmiş negatif binominal regresyon ile yeni/yeni büyüyen T2 lezyonları; tedavi, ülke ve Gd-tutan lezyonların başlangıç sayısına göre düzeltilmiş dereceli ANCOVA ile Gd-tutan lezyonlar ve Wilcoxon sıra toplamı sınaması ile beyin hacmindeki % değişiklik._Şekil 3 12 aya varan ilk doğrulanmış atağa kadar geçen zaman için Kaplan-Meiergrafiği - Çalışma D2302 (ITT popülasyonu)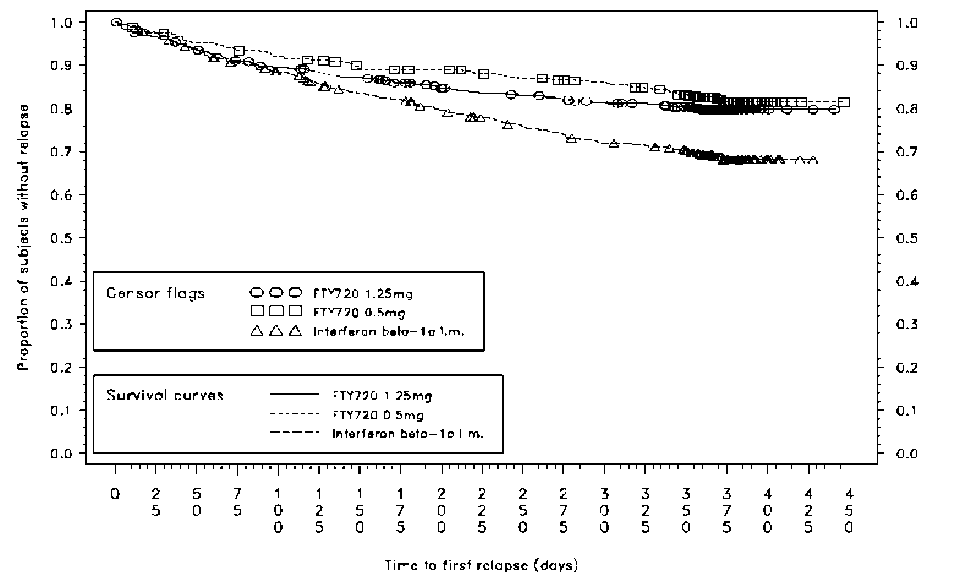 Çalışma D2301 ve D2302'ye ilişkin toplanmış bulgular cinsiyet, yaş, önceki multipl skleroz tedavisi, başlangıçtaki hastalık etkinliği veya özürlülük düzeyleri ile tanımlanan alt gruplarda karşılaştırma ajanına kıyasla yıllık atakoranına ilişkin tutarlı bir azalmayı göstermiştir.
Çalışma D2301 ve D2302'ye ilişkin toplanmış bulgular cinsiyet, yaş, önceki multipl skleroz tedavisi, başlangıçtaki hastalık etkinliği veya özürlülük düzeyleri ile tanımlanan alt gruplarda karşılaştırma ajanına kıyasla yıllık atakoranına ilişkin tutarlı bir azalmayı göstermiştir.5.2. Farmakokinetik özellikler Genel ÖzelliklerEmilim:Fingolimod emilimi yavaş (tmax 12-16 saat) ve kapsamlıdır (>% 85, idrara çıkan radyoaktivite miktarı ve feçesteki metabolit miktarına dayalı olarak). Görünür mutlak oral biyoyararlanım yüksektir (% 93). Besin alımı fingolimod veya fingolimod-fosfatın Cmax veya maruziyetini (EAA) değiştirmemektedir. Bu nedenle GILENYA öğünlerden bağımsız olarak alınabilir (Bkz. Bölüm 4.2 Pozoloji ve uygulama şekli). Kararlı durum kan konsantrasyonlarına günde bir kez uygulamayı takiben 1 ila 2 ay içinde erişilir ve kararlı durum düzeyleri başlangıç dozundan yaklaşık 10 kat daha büyüktür. Dağılım:Fingolimod kırmızı kan hücrelerinde, kan hücrelerinin % 86'lık fraksiyonu ile yüksek derecede dağılır. Fingolimod-fosfat kan hücrelerinde <% 17'lik daha küçük bir alıma sahiptir. Fingolimod ve fingolimod-fosfat yüksek derecede proteine bağlıdır (>% 99.7). Fingolimod ve fingolimod-fosfatın proteine bağlanması renal veya hepatik bozuklukla değişmemektedir. Fingolimod yaklaşık 1200±260 L'lik bir dağılım hacmi ile vücut dokularına geniş ölçüde dağılır. Metabolizma:İnsanlarda fingolimodun biyotransformasyonu üç ana yolla meydana gelir; fingolimod-fosfatın farmakolojik olarak aktif (^)-enantiomerine geri dönüşümlü stereoseçici fosforilasyonu ile, başlıca sitokrom P450 4F2 izoenzimi ve aracılığıyla oksidatif biyotransformasyon ve inaktif metabolitlere ardışık yağ asidi benzeri bozunma ile ve fingolimodun farmakolojik olarak inaktif polar olmayan seramid analoglarının oluşumu ile. Toplam radyolojik olarak işaretli bileşenlerin doz ertesi 816. saate kadar EAA'sına katkıları ile belirlendiği üzere [14C] fingolimodun tekli oral uygulamasını takiben kandaki majör fingolimod ilişkili bileşenler fingolimodun kendisi (% 23.3), fingolimod-fosfat (% 10.3) ve inaktif metabolitlerdir (M3 karboksilik asit metaboliti (% 8.3), M29 seramid metaboliti (% 8.9) ve M30 metaboliti seramid metaboliti (% 7.3)). Eliminasyon:Fingolimodun kan klerensi 6.3±2.3 L/s olup, ortalama görünür terminal yarılanma ömrü (t1/2) 6-9 gündür. Fingolimod-fosfatın kan düzeyleri terminal fazdaki fingolimod ile paralel olarak azalıp, her ikisi için de benzer yarılanma ömürleri oluşturur. Bir oral uygulamadan sonra dozun yaklaşık % 81'i belirteç metabolitler olarak yavaşça idrara çıkar. Fingolimod ve fingolimod-fosfat idrara bozulmadan çıkmamakla birlikte her bir dozun % 2.5'inden daha azını temsil eden miktarlarla feçesteki başlıca bileşenlerdir. Doğrusallık / doğrusal olmayan durum:Fingolimod ve fingolimod-fosfat konsantrasyonları fingolimod 0.5 mg veya 1.25 mg'ın günde bir kez uygulanan çoklu dozlarından sonra görünür, doz orantılı bir şekilde artar. Hastalardaki karakteristik özelliklerBöbrek yetmezliği:Şiddetli böbrek yetmezliği fingolimod Cmax'ı ve EAA'sını sırasıyla % 32 ve % 43 ve fingolimod-fosfat Cmax'ı ve EAA'sını sırasıyla % 25 ve % 14 artırır. Görünür eliminasyon yarılanma ömrü iki analit için de değişmez. Böbrek yetmezliği olan hastalarda GILENYA'ya ilişkin herhangi bir doz ayarlaması gerekli değildir. Karaciğer yetmezliği:Hafif, orta şiddetli veya şiddetli karaciğer yetmezliği olan gönüllülerde değerlendirildiğinde tekli doz fingolimodun farmakokinetiği (1 veya 5 mg) fingolimod Cmax'ı üzerinde herhangi bir değişiklik göstermezken EAA'da sırasıyla % 12, % 44 ve % 103'lük bir artış göstermiştir. Görünür eliminasyon yarılanma ömrü hafif karaciğer yetmezliğinde değişmezken, orta şiddetli ve şiddetli karaciğer yetmezliğinde % 49-50 uzamaktadır. Fingolimod-fosfat sadece şiddetli yetmezliği olanlarda ölçülmüş ve Cmax ve EAA sırasıyla % 22 ve % 29 artmıştır. Karaciğer yetmezliği fingolimod ve fingolimod-fosfatın dispozisyonunda değişikliklere yol açmış olsa da, bu değişikliklerin boyutu fingolimod dozunun hafif ila orta şiddetli karaciğer yetmezliği olan hastalarda ayarlanmasına gerek olmadığını düşündürmektedir. Fingolimod şiddetli karaciğer yetmezliği (Child-Pugh sınıf C) olan hastalarda kullanılmamalıdır. Pediatrik popülasyon:18 yaşın altındaki pediatrik hastalarda GILENYA'nın güvenlilik ve etkililiği çalışılmamıştır. GILENYA pediatrik hastalarda kullanım için önerilmemektedir. Geriatrik popülasyon:Popülasyon farmakokinetiğinden elde edilen bulgular ve eliminasyon mekanizması yaşlı hastalarda doz ayarlamasının gerekli olmayacağını düşündürmektedir. Ancak 65 yaş üzerindeki hastalarda klinik deneyimler kısıtlıdır. Irk:Etnik kökenin fingolimod ve fingolimod fosfat farmakokinetiği üzerindeki etkileri klinik olarak ilgili değildir. Cinsiyet:Cinsiyet fingolimod ve fingolimod-fosfat farmakokinetiği üzerinde herhangi bir etkiye sahip değildir. 5.3. Klinik öncesi güvenlilik verileriFingolimodun klinik öncesi güvenlilik profili farelerde, sıçanlarda, köpeklerde ve maymunlarda değerlendirilmiştir. Majör hedef organlar çeşitli türlerde lenf sistemi (lenfopeni ve lenfoid atrofi), akciğerler (artmış vücut ağırlığı, bronko-alveolar bağlantıda düz kas hipertrofisi) ve kalp (negatif kronotropik etki, kan basıncında artış, perivasküler değişiklikler ve miyokard dejenerasyonu); sadece sıçanlarda kan damarları (vaskülopati) ve çeşitli türlerde sadece yüksek dozlarda hipofiz bezi, midenin ön bölümü, karaciğer, böbrek üstü bezleri, gastrointestinal sistem ve sinir sistemi (sıklıkla genel toksisite belirtileri ile ilişkili) olmuştur.Sıçanlarda 0.5 mg dozda insan sistemik maruziyetine (EAA) dayalı olarak sınırın yaklaşık 50 katını temsil eden, 2.5 mg/kg'lık maksimum tolere edilebilir doza kadar oral fingolimod dozlarında yapılan 2 yıllık bir biyoanalizde karsinojenisiteye ilişkin herhangi bir kanıt gözlenmemiştir. Ancak 2 yıllık bir fare çalışmasında 0.5 mg günlük dozdaki insan sistemik maruziyetine dayalı olarak (EAA) sınırın yaklaşık 6 katını temsil eden 0.25 mg/kg ve daha yüksek dozlarda artmış bir malign lenfoma insidansı görülmüştür. Fingolimodun bir Ames testinde ve bir L5178Y fare lenfoma hücre hattında in vitroin vitroin vivomikronukleus testinde klastojenik bulunmamıştır.Fingolimod erkek ve dişi sıçanlarda 0.5 mg'lık günlük dozdaki insan sistemik maruziyetine (EAA) dayalı olarak sınırın yaklaşık 150 katını temsil eden test edilen en yüksek dozlara kadar (10 mg/kg) sperm sayımı/motilitesi ve fertilite üzerinde herhangi bir etkiye sahip bulunmamıştır. Fingolimod 0.1 mg/kg veya daha yüksek dozlarda verildiğinde teratojenik bulunmamıştır. En yaygın görülen fetal iç organ malformasyonları persistan trunkus arteriosus ve ventriküler septum kusurunu içermiştir. Sıçanlarda 1 mg/kg ve daha yüksek dozlarda implantasyon sonrası kayıpta bir artış ve 3 mg/kg'da canlı fetüslerde bir azalma gözlenmiştir. Fingolimod 1.5 mg/kg ve daha yüksek dozlarda artmış bir embriyo-fetal mortalite ve 5 mg/kg'da canlı fetüsün yanı sıra fetal büyümede bir azalmanın meydana geldiği tavşanlarda teratojenik bulunmamıştır. Sıçanlarda F1 nesil yavru sağkalımı erken doğum sonrası periyotta maternal toksisiteye neden olmayan dozlarda azalmıştır. Ancak F1 vücut ağırlığı, gelişimi, davranışı ve fertilitesi fingolimod ile tedaviden etkilenmemiştir. Genç sıçanlarda yapılan bir toksisite çalışmasında yetişkin sıçanlara kıyasla ilave bir hedef organ toksisitesi gözlenmemiştir. Keyhole Limpet Hemosiyanin (KLH) ile tekrar eden uyarılar tedavi periyodu sırasında orta derecede azalmış bir yanıtı ancak 8 haftalık düzelme periyodunun sonunda tam olarak fonksiyonel immün reaksiyonları göstermiştir. Fingolimod emzirme sırasında tedavi edilen hayvanların sütüne geçmiştir. Fingolimod ve metabolitleri gebe tavşanlarda plasental bariyerden geçmiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiMannitolMagnezyum stearat Titanyum dioksit (E171) Jelatin. 6.2. GeçimsizliklerYoktur.6.3. Raf ömrü24 ay6.4. Saklamaya yönelik özel tedbirler30°C'nin altındaki oda sıcaklığında saklayınız. Nemden koruyunuz.6.5. Ambalajın niteliği ve içeriğiPVC/PVDC-Alu blister.7 ve 28 kapsül içeren blister ambalaj. 6.6. Tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Ürünlerin Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir.7. RUHSAT SAHİBİNovartis Ürünleri 34912 Kurtköy - İstanbul Tel: 0 216 560 10 00 Faks: 0 216 482 64 088. RUHSAT NUMARASI131/289. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ |
İlaç BilgileriGilenya 0.5 mg kapsülEtken Maddesi: Fingolimod HCl Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.