İmplanon NXT 68 mg implant Kısa Ürün BilgisiÜrogenital Sistem ve Cinsiyet Hormonları » Cinsiyet Hormonları ve Genital Sistem » Sistemik Hormonal Gebeliği Önleyici İlaçlar » Progestojenler » Etonogestrel KISA URUN BILGISI1. BEŞERI TIBBI ÜRÜNÜN ADIIMPLANON NXT 68 mg Implant2. KALITATIF VE KANTİTATIF BILEŞIMIMPLANON NXT, radyoopak, biyolojik olarak parçalanmayan, yalnızca progestagen içeren, steril olarak esnek implanta yüklenmiş, kullanıma hazır, tek kullanımlık bir aplikatördür.Her radyoopak implant 68 mg etonogestrel içerir; salım hızı 5-6 hafta boyunca yaklaşık 60-70 mikrogram/gün'dür ve ilk yılın sonunda yaklaşık 35-45 mikrogram/gün, ikinci yılın sonunda yaklaşık 30-40 mikrogram/gün ve üçüncü yılın sonunda yaklaşık 25-30 mikrogram/ gün düzeyine düşer. Yeni geliştirilmiş aplikatör tek elle kullanılmak ve implantın deri-altına doğru bir şekilde yerleştirilmesini kolaylaştırmak için tasarlanmıştır. Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTIK FORMSubdermal kullanım için implant.Radyoopak, biyolojik degredasyona uğramayan, beyaz-kirli beyaz, yumuşak, 4 cm uzunlukta ve 2 mm çapında esnek çubuk. 4. KLİNIK ÖZELLIKLER4.1. Terapötik endikasyonlarKontrasepsiyon4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresiIMPLANON NXT yerleştirilmeden önce gebelik olasılığı dışlanmalıdırİmplantı yerleştirecek doktorların IMPLANON NXT aplikatörünün ve implantının yerleştirme-çıkarılma tekniklerine hakim olabilmek için bir eğitim almaları ve uygun koşullarda implantı yerleştirmek ve çıkarmadan önce danışmanlık istemeleri şiddetle önerilir. İmplantın yerleştirilme ve çıkarılması ile ilgili ek bilgi ve daha ayrıntılı yönergeler istendiği taktirde ücretsiz olarak gönderilecektir (Merck Sharp Dohme İlaçları Ltd. Şti.Esentepe / İstanbul Telefon no: 0 212 336 10 00 ya da www.implanonlocalization.com'u ziyaret ediniz). İmplant yerleştirilmeden önce, 'IMPLANON NXT nasıl yerleştirilir' ve 'IMPLANON NXT nasıl çıkarılır' bölümlerindeki yerleştirme ve çıkarma talimatlarını dikkatlice okuyunuz ve uygulayınız. IMPLANON NXT nasıl kullanılır:IMPLANON NXT uzun etkili bir hormonal kontraseptiftir. Derialtına tek bir implant yerleştirilir ve üç yıl boyunca orada bırakılabilir. Yerleştirildiği tarihten sonra, en fazla üç yıl içinde implantı çıkarınız. Kullanıcı, herhangi bir zamanda IMPLANON NXT'yi çıkarmak isteyebileceği veimplantın üç yıldan daha uzun süre kullanılamayacağı konusunda bilgilendirilmelidir. Hekimler kilolu kadınlarda implantı daha erken değiştirmeyi düşünebilir (bkz. '4.4 Özel kullanım uyarıları ve önlemleri 'Uyarılar' bölümü). İmplant çıkarıldıktan hemen sonra yeni bir implantın yerleştirilmesi kontrasepsiyonu sürdürecektir. Eğer kadın IMPLANON NXT kullanımına devam etmek istemez fakat gebelikten korunmaya devam etmek isterse, başka bir kontraseptif yöntem önerilmelidir. IMPLANON NXT implantının başarılı bir şekilde kullanılabilmesi ve daha sonra da çıkarılabilmesi için, implant deri altına, talimatlara uygun şekilde, dikkatlice ve doğru olarak yerleştirilmelidir. IMPLANON NXT implantı, biseps ve triseps kasları arasındaki bağ dokusunun derinliklerinde yer alan büyük damarların ve sinirlerin zarar görmemesi için, kolun üst bölümünün iç tarafına subdermal olarak, derinin hemen altına yerleştirilmelidir. Yerleştirilme tamamlandıktan hemen sonra, implantın varlığı palpasyonla doğrulanmalıdır. İmplantın palpe edilemediği durumlarda ya da implantın varlığından kuşku duyulduğu zaman, doğrulama için diğer yöntemlere başvurulmalıdır (bkz. bölüm 'IMPLANON NXT nasıl yerleştirilir'). İmplantın varlığı doğrulanıncaya kadar kadına, hormonal olmayan bir kontraseptif yöntem kullanılması önerilmelidir. IMPLANON NXT'nin ambalajında kadının, implantın seri numarasını yazacağı bir Kullanıcı Kartı vardır. Doktorlardan da Kullanıcı Kartı'na implantın yerleştirilme tarihini, hangi kola yerleştirildiğini ve çıkarılması amaçlanan tarihi kaydetmeleri istenmektedir. Ambalajda ayrıca doktorların seri numarasını kaydetmeleri için yapışkanlı etiketler de vardır. IMPLANON NXT ne zaman yerleştirilir:Yerleştirilme işleminin ne zaman yapılacağı, aşağıda belirtildiği üzere kadının yakın zamandaki kontrasepsiyon hikayesine bağlıdır: Öncesinde hormonal kontrasepsiyon kullanılmadığındaİmplant menstrüal siklusun 1. günü (menstrüasyon kanamasının ilk günü) ve 5. günü arasında yerleştirilmelidir. Kombine hormonal kontraseptif yönteminden geçiş yapılırsa(kombine oral kontraseptif (KOK), vajinal halka ya da transdermal flaster)İmplant tercihen, önceki KOK tedavisinin son etkin tablet (etkin madde içeren son tablet) kullanım gününden sonraki gün, fakat en geç olarak tabletsiz dönem veya önceki kombine oral kontraseptifin en son plasebo tabletini takiben yerleştirilmelidir. Vajinal halka ya da transdermal flaster kullanıldığı durumlarda, tercihen flasterin çıkarıldığı gün içinde olmak üzere,en geç sonraki uygulama gününe kadar istenilen zamanda implant yerleştirilmelidir. Yalnızca-progestagen yönteminden geçiş yapılırsa(örn: minipil, enjekte edilebilen kontraseptif, implant ya da rahim içi sistem (RİS))Yalnızca-progestagen yöntemlerinin birçok çeşidi olduğundan, implant aşağıdaki şekilde yerleştirilmelidir. Enjekte edilebilen kontraseptifler: Planlanmış bulunan bir sonraki enjeksiyon gününde, enjeksiyon yerine implant yerleştirilmelidir. Minipil: Kadın herhangi bir gün minipilden IMPLANON NXT kullanımına geçiş yapabilir. İmplant, minipil kullanımının kesilmesinden sonraki gün yerleştirilebilir. İmplant/ Rahim içi sistem (RİS): Önceki implantın veya RİS'in çıkarıldığı gün implant yerleştirilebilir. Düşük veya kürtaj sonrasındaİlk trimester: İlk trimesterdeki düşük ve kürtaj sonrası hemen implant yerleştirilebilir. Eğer ilk trimesterdeki düşük ve kürtaj sonrası beş gün içinde implant yerleştirilmezse, 'Öncesinde hormonal kontrasepsiyon kullanılmadığında' başlığı altındaki talimatlarauyulmalıdır.. İkinci trimester: İkinci trimesterdeki düşük ve kürtaj sonrası implant 21 ila 28. günler arasında yerleştirilmelidir. Doğum sonrasındaEmzirme durumunda: İmplant doğum sonrası dördüncü haftadan sonra yerleştirilmelidir (bkz.Bölüm 4.6 Gebelik ve laktasyon). Emzirmeme durumunda: İmplant doğum sonrası 21 ila 28. günler arasında yerleştirilmelidir. Not: IMPLANON NXT implantın doğru zamanda yerleştirilmesini içeren yukarıdaki talimatların uygulanması önemlidir. Eğer yukarıdaki talimatlardan sapılırsa, gebelik olasılığı dışlanmalıdır ve kadına implantın yerleştirilmesi sonrası 7 güne kadar, kondom gibi hormonal olmayan kontraseptif bir yöntem kullanması da tavsiye edilmelidir. Uygulama şekliIMPLANON NXT nasıl yerleştirilir:IMPLANON NXT implantının başarılı bir şekilde kullanılabilmesi ve daha sonra da çıkarılabilmesi için, talimatlara göre dikkatlice ve doğru olarak subdermal yerleştirilmesi gerekir. Yerleştirilme sonrası gerek doktor gerekse kadın implantı palpasyonla, yerleştirildiği yerde hissedebilmelidir. İmplant çok derine yerleştirilirse, sinirler veya damarlar zarar görebilir. İmplant çok derine veya hatalı olarak yerleştirilirse, parestezi (sinir hasarına bağlı) veya yerleştirildiği yerden uzaklaşma (kas içerisine veya fasyaya yerleştirilmesine bağlı) ve seyrek olarak damar içerisine yerleştirilme görülebilir. Dahası implant çok derine yerleştirildiğinde, palpe edilemeyebilir ve implantın nerede bulunduğunun anlaşılması ve/veya çıkarılması zor olabilir. IMPLANON NXT'nin yerleştirilmesi, aseptik koşullar altında ve yalnızca, prosedürü bilen bir doktor tarafından gerçekleştirilmelidir. İmplantın yerleştirilmesi yalnızca, implantın önceden yüklenmiş olduğu aplikatör ile gerçekleşmelidir. İğnenin yerinin ve hareketlerinin net bir şekilde görülebilmesi için doktorun, tüm yerleştirilme işlemini oturduğu yerde yapması önerilir. Kadının, genellikle kullanmadığı kolu dirsekten bükülmüş ve dışa doğru dönmüş durumda muayene masasına yatırılmalı ve el bileği kulağına paralel olarak ya da eli başına yakın olacak şekilde durmalıdır (Şekil 1).  Şekil 1
Şekil 1Kadının kullanmadığı kolunun üst bölümünün iç tarafında, humerus medial epikondilinin yaklaşık 8-10 cm yukarısında olan yerleştirilme yeri belirlenmelidir. Steril bir işaret kalemiyle birincisi implantın yerleştirileceği yere, ikincisi bunun birkaç santimetre proksimaline olmak üzere iki işaret koyulmalıdır (Şekil 2). İkinci işaret daha sonra, yerleştirilme işlemi sırasında yön gösteren bir kılavuz olarak kullanılacaktır.
Yön gösteren işaret 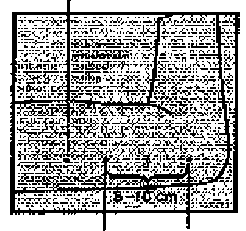 Yerleştirme yeri Şekil 2
Yerleştirme yeri Şekil 2
Medial epikondil Yerleştirme yeri antiseptik bir solüsyon ile temizlenmelidir. Yerleştirme yerine anestezi uygulanmaldır. (örneğin; hemen deri altına, planlanan yerleştirme kanalı boyunca % 1'lik 2 ml lidokain enjekte edilerek veya anestezik spreyle). Steril tek kullanımlık IMPLANON NXT aplikatör içeren implant blisterinden çıkarılmalıdır. Aplikatör, iğnenin hemen yukarısında olmak üzere, yüzey bölgesinden tutulmalı ve implantı içeren iğnenin üzerindeki koruyucu saydam kapak çıkarılmalıdır (Şekil 3). Eğer kapak aplikatörden kolayca ayrılmıyorsa, aplikatör kullanılmamalıdır. İğnenin ucundaniçeriye bakıldığında, beyaz renkli implant görülebilmelidir. Iğne geri çekilip implantın aplikatörden serbest kalması sağlandığından, iğneyi deri altına tümüyle sokuncaya kadar mor renkli sürgüye dokunulmamalıdır. Şekil 3
Şekil 3Yerleştirme yeri çevresindeki deri, boşta olan elin baş ve işaret parmağı ile gerilir (Şekil 4).
İğne, ucu deriyle yaklaşık 30°C açı yapacak şekilde deriye batırılır. (Şekil 5).  Şekil 4
Şekil 4 Şekil 5
Şekil 5Aplikatör aşağıya doğru indirilip yatay konuma getirilir. Deri iğnenin ucuyla kaldırılırken, iğne tüm uzunluğu boyunca ileriye doğru kaydırılmalıdır. Hafif bir direnç hissedilebilirir ama aşırı güç kullanılmamalıdır. (Şekil 6). İğne deri altına tamamen girmezse, implant gereken şekilde yerleştirilemeyecektir.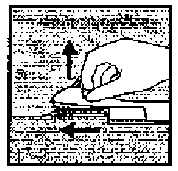 Şekil 6
Şekil 6Aplikatör aynı pozisyonda tutulurken ve iğne tam olarak deri altına girmiş durumdayken mor renkli sürgünün kilidi, hafifçe aşağıya doğru bastırılarak açılır. Sürgü duruncaya kadar arkaya doğru çekilip, implantın deri altındaki en son pozisyonunda kalması sağlanmalı, iğne aplikatörün gövdesi içerisinde kilitlenmelidir. (Şekil 7). Eğer sürgü arkayadoğru tamamen çekilemezse, iğne de tam olarak geriye çekilemez ve implant, gereken şekilde yerleştirilememiş olur.Aplikatör artık çıkarılabilir. Şekil 7
Şekil 7Kadının koluna implantın yerleştirilmesinden hemen sonra her zaman implantın varlığı palpasyon ile kontrol edilmelidir.İmplantın her iki ucu da palpe edilerek, 4 cm uzunluğundaki çubuğun varlığı doğrulanabilir. (Şekil 8). Şekil 8
Şekil 8Eğer implant palpasyonla hissedilemezse veya varlığından şüphe duyulursa, Aplikatör kontrol edilir. İğne tamamen geri çekilmeli ve sadece obturatörün mor ucu görünmelidir. İmplantın varlığını teyit etmek için diğer yöntemler kullanılmalıdır. Uygun yöntemler: iki boyutlu röntgen, bilgisayarlı tomografi (BT), doğrusal-dizilimli, yüksek frekanslı (10 MHz veya daha yüksek) bir transduserle ultrason taraması (US) veya manyetik rezonans (MR). İmplantın lokalizasyonu amacıyla BT, US veya MR kullanmadan önce, talimat almak üzere lokal IMPLANON NXT tedarikçisine danışılması önerilir. Bu görüntüleme yöntemleriyle bir sonuç alınamazsa, implantın deri altında durduğunun, hastadan alınan kan örneğindeki etonogestrel düzeyi ölçülerek doğrulanması önerilir. Merck Sharp Dohme bu durumda, uygulanacak uygun prosedür konusunda bilgi sağlayacaktır. implantın yerinde durduğu doğrulanana kadar, hormonal olmayan bir kontraseptif yöntem kullanılmalıdır. Yerleştirme yerinin üzeri, küçük bir yapışkan bandajla kapatılır. Kadından, implantı palpe etmesi istenir. Ekimoz ları önlemek için sıkı bir biçimde steril bandaj yapılır. Kadın sıkı bandajı 24 saat sonra ve küçük bandajı 3-5 gün sonra yerleştirme yerinden çıkarabilir. Kullanıcı Kartı doldurulmalıve saklaması için kadına verilmelidir. Aynı zamanda yapışkanlı etiketler de doldurulmalı ve kadının tıbbi kayıdına eklenmelidir. Aplikatör sadece tek kullanımlıktır ve biyolojik atıkların yok edilmesine ilişkin yerel düzenlemelere uygun olarak atılmalıdır. IMPLANON NXT nasıl çıkarılır:İmplantın çıkarılmasına başlanmadan önce doktor, IMPLANON NXT'nin yerini öğrenmek için Kullanıcı Kartı'na bakmalıdır. İmplantın koldaki yeri, palpasyonla tam olarak doğrulanmalıdır. İmplant palpe edilemiyorsa, varlığını doğrulamak için iki-boyutlu röntgen kullanılabilir. Palpe edilemeyen bir implantın yeri, çıkarma işlemi öncesinde mutlaka belirlenmelidir. Bilgisayarlı tomografi (BT), doğrusal-dizilimli, yüksek frekanslı (10 MHz veya daha yüksek) bir transduserle ultrason taraması (US) ya da manyetik rezonans görüntülemesi (MR), uygun yöntemlerdir. Eğer bu görüntüleme yöntemleriyle sonuç alınamazsa, implantın doğrulanması amacıyla etonogestrel tayini yapılabilir. Daha fazla yol gösterici bilgi için Merck Sharp Dohme ile iletişim kurulabilir. Palpe edilemeyen bir implantın yeri saptandıktan sonra çıkarma işlemi, ultrason kılavuzluğu altında yapılabilir. Seyrek de olsa, implantın yerleştirildiği yerden başka bir yere göç ettiğibildirilmektedir; implant çok derinlere yerleştirilmediği sürece bu yer değiştirme genellikle, orijinal pozisyonuyla karşılaştırıldığında pek azdır (bkz. bölüm 4.4.Özel kullanım uyarıları ve önlemleri Uyarılar). Çok derine yerleştirilmiş bir implantın palpasyonla, US ve/veya MR ile lokalizasyonu zor olabilir ve daha büyük bir insizyon ve daha fazla zaman gerektirebilir. Implant, yalnızca aseptik koşullar altında ve çıkarma tekniğini bilen bir doktor tarafından çıkarılmalıdır. İmplantın lokalizasyonu tam olarak bilinmeksizin, eksplorasyon amacıyla cerrahi girişimlere başvurulması kesinlikle düşünülmemelidir.Derine yerleştirilmiş implantlar, koldaki derin sinirlere ve damarlara zarar verilmemesi için dikkatlice ve kol anatomisini bilen doktorlar tarafından çıkarılmalıdır.İmplant çıkarılamıyorsa, daha fazla yol gösterici bilgi için Merck Sharp Dohme ile iletişime geçilmelidir. İnsizyon alanı temizlenir ve antiseptik uygulanır. Palpasyonla implantın yeri saptanır ve distal ucu (dirseğe en yakın uç) örneğin steril bir kalemle işaretlenir (Şekil 9).
Koldaki, insizyon yapılacak işaretli bölgeye (örneğin 0.5-1 ml % 1'lik lidokain ile) anestezi uygulanır (Şekil 10). Deri yüzeyine yakın durmasını sağlamak için lokal anestetik ajanın implantın altına enjekte edildiğinden emin olunmalıdır.  Şekil 9
Şekil 9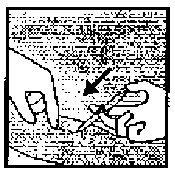 Şekil 10
Şekil 10İmplantı sabitlemek için proksimal uca bastırılır (Şekil 11); implantın distal ucunu gösteren çıkıntı ortaya çıkabilir. İmplantın distal ucundan başlayarak, dirseğe kadar 2 mm.'lik longitudinal insizyon yapılır.  Şekil 11
Şekil 11İmplant insizyona doğru ucu görününceye dek yavaşça itilir. İmplant forseps (tercihen eğri mosquito forseps) ile tutulur ve implant çıkarılır (Şekil 12).  Şekil 12
Şekil 12İmplantın çevresi bir doku kılıfıyla kuşatılmışsa, bu kılıfta bir insizyon yapılır ve implant bir forsepsle tutularak çıkartılır(Şekil 13 ve 14).  Şekil 14
Şekil 14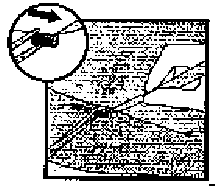 Şekil 13
Şekil 13Eğer insizyonda implantın ucu görünmez ise, insizyon içine yavaşça bir forseps yerleştirilir (Şekil 15). Forseps diğer ele doğru çevrilir (Şekil 16). İkinci bir forseps ile implant çevresindeki doku dikkatlice ayrılır ve implant tutulur (Şekil 17). Daha sonra implant çıkarılabilir.  Şekil 15
Şekil 15Şekil 16 Şekil 17 Uzunluğu 4 cm olan implant çubuğunun tamamen çıkarılmış olduğunu teyit etmek için, uzunluğu ölçülerek doğrulanır. Eğer kadın IMPLANON NXT kullanımına devam etmek isterse, eski implant çıkarıldıktan sonra aynı insizyon yeri kullanılarak derhal yeni bir implant yerleştirilebilir (Bölüm 4.2 IMPLANON NXT nasıl değiştirilir) İmplant çıkarıldıktan sonra, insizyon yeri steri-strip ile kapatılır ve yapışkanlı bir bandaj uygulanır. Morlukları önlemek için sıkı bir biçimde steril bandaj yapılır. Kadın sıkı bandajı 24 saat sonra ve küçük bandajı 3-5 gün sonra çıkarabilir. IMPLANON NXTyenisiyle nasıl değiştirilebilir:Önceki implant çıkarıldıktan sonra hemen yenisi yerleştirilebilir. Bu işlem bölüm 4.2 IMPLANON NXT nasıl yerleştirilir kısmında anlatılan yerleştirme prosedürüyle aynıdır. Yeni implant aynı kola ve önceki implantın çıkarıldığı aynı insizyon yeri boyunca yerleştirilebilir. Yeni bir implant aynı insizyonla yerleştirilecekse, yerleştirileceği yer bir anestetik ajan (örneğin 2 ml %1 lidokain), insizyon başlangıcında itibaren yerleştirilme kanalı boyunca enjekte edilerek anestezi uygulanır ve yerleştirme talimatındaki bundan sonra gelen basamaklar izlenir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Böbrek/Karaciğer yetmezliği olan hastalar ile ilgili herhangi bir çalışma yoktur.Pediyatrik popülasyon:Adölesanlardaki pozoloji, yetişkinleriyle aynıdır. IMPLANON NXT'nin etkililiği ve güvenliliği, üreme dönemindeki kadınlarda kanıtlanmıştır. Etkililik ve güvenliliğin, puberte dönemi sonrası adolesanlar için aynı olması beklenmektedir. IMPLANON NXT'nin menarş dönemi öncesi kullanımı endike değildir.Geriyatrik popülasyon:Bu popülasyonda herhangi bir kullanımı yoktur.4.3. KontrendikasyonlarYalnızca progestagen içeren kontraseptifler aşağıdaki koşulların herhangi birinin varlığında kullanılmamalıdır. IMPLANON NXT kullanımı sırasında bu durumlardan herhangi biri ortaya çıkarsa, ürünün kullanımı hemen durdurulmalıdır. Bilinen veya şüphelenilen gebelik. Aktif venöz tromboembolik bozukluk. Bilinen veya şüphe edilen, cinsel steroidlere duyarlı kötü huylu hastalıklar (maligniteler). Uzun süre karaciğer fonksiyon değerlerinin normale dönmediği ciddi karaciğer hastalığı ya da öyküsü. Tanı konmamış vajinal kanama. IMPLANON NXT içindeki etkin maddeye ya da yardımcı maddelerden herhangi birine karşı aşırı duyarlılık. 4.4. Özel kullanım uyarıları ve önlemleriUyarılar:Aşağıdaki durum / risklerden herhangi biri ortaya çıktığında, her kadın için progestagen kullanımın yararları ile olası riskleri değerlendirilmeli ve IMPLANON NXT kullanımına başlamadan önce kadın ile konuşulmalıdır. Bu durumlardan herhangi birinin artması, şiddetlenmesi ya da ilk kez ortaya çıkması halinde kadın, doktora başvurmalıdır. Daha sonra doktor IMPLANON NXT kullanımına devam edilip edilmeyeceğine karar vermelidir. Meme kanseri riski genel olarak yaş ile artmaktadır. (Kombine) oral kontraseptiflerin (OK) kullanımı sırasında meme kanseri tanısı riski hafif düzeyde artmaktadır. Bu risk artışı OK kullanımının kesilmesinden sonraki 10 yıl içinde yavaşça ortadan kalkar ve kullanım süresi ile ilişkili değildir, fakat OK kullanılan yaş ile ilişkilidir. Kombine OK kullanan 10.000 kadında tanı konulması beklenen olgu sayısı (kesildikten sonra 10 yıla dek), aynı yaşlarda hiç kullanmamış yaş gruplarına göre hesaplanmıştır: 4.5/4 (16-19 yaş ), 17.5/16 (20-24 yaş), 48.7/44 (25-29 yaş), 110/100 (30-34 yaş), 180/160 (35-39 yaş) ve 260/230 (40-44 yaş). Yalnızca progestagen içeren kontraseptif yöntem kullanıcılarının riski, muhtemelen kombine OK kullananların riski ile benzer büyüklüktedir. Bununla birlikte, bu yöntemler için elde edilen kanıtlar ile sağlıklı bir sonuca varılmamıştır. Tüm yaşam boyu meme kanseri riski ile karşılaştırıldığında, OK ile ilişkili olan risk artışı düşüktür. OK kullanıcıları arasında meme kanseri tanısı konulmuş olguların, OK kullanmamış olgulara kıyasla daha az ilerlemiş olgular olması eğilimi söz konusudur. OK kullanıcılarında gözlenen risk artışının daha erken tanı ve OK biyolojik etkilerinden ya da her ikisinden kaynaklanması olasıdır. Progestagenlerin karaciğer kanseri üzerindeki biyolojik etkileri dışlanamayacağından, karaciğer kanseri olan kadınlarda kişisel yarar ve risk değerlendirilmesi yapılmalıdır. Akut veya kronik karaciğer fonksiyonu bozuklukları meydana geldiğinde, kadın muayene olmak ve danışmak için doktoruna başvurmalıdır. Epidemiyolojik çalışmalar kombine OK kullanımı ile venöz tromboembolizm (VTE, derin ven trombozu ve pulmoner emboli) insidansı artışını ilişkilendirmiştir. Östrojenik bileşeni olmayan etonogestrelin (desogestrelin biyolojik olarak aktif metaboliti) kontraseptif olarak kullanımı için bu bulgunun klinik ilişkisi bilinmemekle birlikte, tromboz olgusunda implant çıkarılmalıdır. Cerrahi ya da hastalık nedeniyle uzun süre hareketsizlik durumunda da implantın çıkarılması düşünülmelidir. IMPLANON NXT'nin yalnızca progestagen içeren bir kontraseptif olmasına rağmen, venöz ve arteryel tromboembolizm riskini artırdığı bilinen risk faktörlerinin değerlendirilmesi önerilir. Tromboembolik bozukluk öyküsü olan kadınlar rekürrens olasılığı konusunda bilgilendirilmelidir. IMPLANON NXT kullanımı sırasında sürekli hipertansiyon ortaya çıktığında ya da kan basıncında anlamlı bir artış antihipertansif tedaviye yeterli yanıt vermediğinde, IMPLANON NXT kullanımının kesilmesi düşünülmelidir. Progestagenler periferik insülin direnci ve glukoz toleransını etkileyebilmekle birlikte, yalnız progestagen içeren kontraseptifleri kullanan diyabet hastalarında tedavi rejiminin değişmesini gerektirecek bir kanıt yoktur. Bununla birlikte, diyabet hastası kadınlar yalnız progestagen içeren kontraseptif kullanırken yakından izlenmelidirler. Özellikle kloasma gravidarum öyküsü olan kadınlarda, seyrek olarak kloasma ortaya çıkabilir. Kloasmaya yatkınlığı olan kadınlar, IMPLANON NXT kullanırken güneş ya da UV ışınlarına maruz kalmaktan kaçınmalıdır. IMPLANON NXT'nin kontraseptif etkisi, etonogestrelin plazma düzeyleri ile ilişkilidir. Plazma düzeyleri vücut ağırlığı ile ters orantılıdır ve yerleştirildikten sonra zaman geçtikçe azalır. Kilolu kadınlarda klinik deneyim 3 yıl kullanım ile sınırlıdır. Bu nedenle bu kadınlarda üçüncü yıldaki kontraseptif etkinin normal ağırlıktaki kadınlardakinden daha düşük olabileceği düşünülmelidir. Doktorlar kilolu kadınlarda implantın daha erken değiştirilmesini düşünebilirler. Özellikle 'IMPLANON NXT nasıl yerleştirilir' bölümündeki yönergelere göre yerleştirilmediğinde ya da lokal inflamasyonun sonucu, implant yerinden çıkabilir. Bazı nadir durumlarda, ya çok derin ilk yerleştirmeye (aynı zamanda bkz. 4.2. 'IMPLANON NXT nasıl yerleştirilir') ve/veya dış etkilere (örn: implantın manipule edilmesi ya da temas içeren sporlar) bağlı olarak yerleştirme alanından başka bir yere hareket edebilir. Bu tür durumlarda implantın lokalizasyonu çok zor olabilir ve çıkarma işlemi için daha geniş bir insizyon gerekebilir (aynı zamanda bkz. 4.2. 'IMPLANON NXT nasıl çıkarılır'). Eğer implant çıkarılmazsa, kontrasepsiyon ve progestagenle ilgili istenmeyen etkilerin riski, kadının istediği zaman aralığından daha uzun süreli etkili olabilirler. Tüm düşük doz hormonal kontraseptiflerle, foliküler gelişim görülebilir ve seyrek olarak folikül normal döngüdeki boyuta kadar büyümeye devam edebilir. Genel olarak büyüyen foliküller kendiliğinden ortadan kalkar. Sıklıkla asemptomatiktirler; bazı olgularda hafif karın ağrısına neden olabilirler. Nadiren cerrahi girişim gerektirirler. Yalnız progestagen içeren geleneksel kontraseptiflerin ektopik gebeliği önlemedeki etkileri, bu yöntemlerin kullanımı süresince ovülasyonların sıklığı ile ilişkili olduğundan, kombine OK tedavisi kadar iyi değildir. NXT ovulasyonu sürekli olarak baskılamakla birlikte, amenore ya da karın ağrısı olan kadınlarda ayırıcı tanıda ektopik gebelik de dikkate alınmalıdır. Aşağıdaki durumlar gebelik ve cinsiyet steroidleri kullanımında bildirilmiştir, fakat progestagenlerle ilişkisi saptanamamıştır; kolestaz ile ilişkili sarılık ve/veya kaşıntı, safra kesesi taşı oluşumu; porfiri; sistemik lupus eritematozus, hemolitik üremik sendrom; Sydenham koresi, gestasyonal herpes , otoskleroza bağlı duyma kaybı ve (kalıtımsal) anjiyoödem. Pediyatrik popülasyon:Adölesanlarda uyarılar ve önlemlerin, yetişkinlerinkiyle aynı olması beklenmektedir.İki yıllık bir çalışmada, 44 IMPLANON NXT kullanıcısında kemik mineral yoğunluğu, RİA kullanıcısı 29 kadından oluşan kontrol grubu ile karşılaştırıldığında, kemik kütlesi üzerinde herhangi bir advers etki gözlenmemiştir. Etonogestrel implantlar, östradiol seviyelerini uzun süre etkilemediğinden, adölesanların kemik mineral yoğunluğu üzerine herhangi bir etkisi beklenmemektedir. Tıbbi muayene/danışmanlık: IMPLANON NXT ilk olarak yerleştirilmeden ya da değiştirilmeden önce tam bir tıbbi öykü alınmalıdır (tıbbi soygeçmiş) ve gebelik olmadığından emin olunmalıdır. Kontrendikasyonlar (Bölüm 4.3 ) ve uyarılar (Bölüm 4.4.Özel kullanım uyarıları ve önlemleri 'Uyarılar')kılavuzluğunda, kan basıncı ölçülmeli ve fiziki muayene yapılmalıdır. IMPLANON NXT yerleştirilmesinden üç ay sonra da bir muayene yapılması önerilir. Bu muayenede, kan basıncı ölçülmeli, sorular ve yakınmalar dinlenmeli ve istenmeyen etkiler sorulmalıdır. Daha sonraki periyodik muayenelerin sıklığı ve tarzı, klinik karar kılavuzluğunda kişiye göre ayarlanmalıdır.Kadınlara IMPLANON NXT kullanımının HIV (AIDS) ya da diğer cinsel yolla bulaşan hastalıklara karşı korumadığı açıklanmalıdır. Etkililiğin azalması: IMPLANON NXT'nin etkililiği, eşzamanlı kullanılan ilaçlarla azalabilir (bkz. 4.5. 'Diğer ilaçlarla etkileşim ve diğer etkileşim biçimleri'). Vajinal kanama düzeninde değişiklikler: IMPLANON NXT kullanımı sırasında, muhtemelen kadınların vajinal kanama düzeninde değişiklikler olabilir. Bu değişiklikler şunları içerebilir; kanama sıklıklarında değişiklikler (kanama olmaması, az olması, çok sık veya devamlı olması), yoğunluğunda değişiklikler (azalması veya artması) veya süresinde değişiklikler. 5 kadından 1'inde amonere bildirilirken, yine5 kadından 1'inde sık ve/veya uzun süreli kanama bildirilmiştir. IMPLANON NXT kullanımı sırasında dismenore yakınmasında düzelme eğilimi saptanmıştır. İlk üç aydaki kanama profili birçok kadında, daha sonraki kanama profillerin yaklaşık olarak tahmin edilmesini sağlar. Bilgi, danışmanlık ve kanama günlüğü kullanımı gibi destekler, kadının kanama düzenini kabul etmesini kolaylaştırabilir. Vajinal kanama değerlendirmesi, kişiye özel olarak yapılmalıdır ve jinekolojik patoloji ya da gebeliği dışlamak için muayeneyi içerebilir. 4.5. Diğer ilaçlarla etkileşim ve diğer etkileşim biçimleriEtkileşimler:Hormonal kontraseptiflerle diğer tıbbı ürünlerin etkileşimleri, menstrüel kanama ve /veya kontraseptif yetmezliğe neden olabilir. IMPLANON NXT ile özel etkileşim çalışmaları yapılmamıştır. Aşağıdaki etkileşimler literatürde bildirilmiştir (esas olarak kombine kontraseptiflerle olmakla birlikte seyrek olarak yalnız progestagen içerenlerle). Hepatik metabolizma:Mikrozomal enzimleri, özellikle sitokrom P 450 enzimlerini uyaran tıbbi ürünlerle (örn; fenitoin, fenobarbital, primidon, karbamazepin, rifampisin ve muhtemelen okskarbazepin, topiramat, felbamat, griseofulvin ve St. John bitkisi) cinsiyet hormonlarının klerensinin artmasıyla sonuçlanabilen, etkileşim ortaya çıkabilir.Aynı zamanda HIV proteaz (örn; ritonavir, nelfinavir) ve non-nükleozid ters transkriptaz inhibitörleri (örn; nevirapin) ve bunların kombinasyonlarının potansiyel olarak hepatik metabolizmayı etkilediği bildirilmiştir. Yukarıda bahsedilen bu ilaçlardan herhangi biri ile tedavi görmekte olan kadınlar, IMPLANON NXT'ye ek olarak hormonal olmayan kontraseptif bir yöntem kullanmalıdır. Mikrozomal enzimleri uyaran( indükleyen) ilaçlarla birlikte kullanım söz konusu ise, ilaç kullanımı süresince ve ilaç kesildikten 28 gün sonraya dek hormonal olmayan kontraseptif yöntem kullanılmalıdır. Hepatik enzim uyarıcı ilaçlarla uzun süreli tedavi görmekte olan kadınlarda, implantın çıkarılması ve hormonal olmayan bir yöntem kullanılması önerilir. Birlikte kullanılan ilaçlarla ilişkili plazma hormon seviyelerinde artış:CYP3A4 gibi mikrozomal enzimleri inhibe eden(örn; ketokonazol), plazma hormon seviyelerini artırabilir.Hormonal kontraseptifler diğer ilaçların metabolizmaları ile etkileşebilir. Dolayısıyla, plazma ve doku konsantrasyonları artırabilir(örn; siklosporin) veya azaltabilir (örn; lamotrijin). Not: Potansiyel etkileşimlerin saptanması için eşzamanlı kullanılacak ilaçların prospektüsleri incelenmelidir. Özel popülasyonlara ilişkin ek bilgiler:Özel popülasyonlar ile yapılmış herhangi bir etkileşim çalışması yoktur.Pediyatrik popülasyon:Pediyatrik popülasyon ile yapılmış herhangi bir etkileşim çalışması yoktur.Laboratuvar testleri: Kombine OK ile elde edilen veriler, kontraseptif steroidlerin, karaciğer, tiroid, adrenal bez ve renal işlevlerle ilgili biyokimyasal testler, taşıyıcı proteinlerin serum düzeyleri örn; kortikosteroid bağlayan protein ve lipid/ lipoprotein fraksiyonları, karbonhidrat metabolizması parametreleri ve pıhtılaşma ve fibrinoliz parametreleri gibi belli laboratuar testlerinin sonuçlarını etkileyebileceğini göstermiştir. Değişiklikler genellikle normal sınırlar içinde kalmaktadır. Yalnızca progestagen içeren kontraseptiflerin etki derecesi bilinmemektedir. 4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi X'tir.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)IMPLANON NXT gebelik döneminde uygulandığı taktirde ciddi doğum kusurlarına yol açmaktadır/yol açtığından şüphelenilmektedir.Gebelik dönemiIMPLANON NXT gebelik sırasında endike değildir. IMPLANON NXT kullanımı sırasında gebelik ortaya çıkarsa, IMPLANON NXT çıkarılmalıdır. Hayvan çalışmaları çok yüksek doz progestagenik maddelerin dişi fötuslarda maskulanizasyona yol açabildiğini göstermiştir. Yaygın epidemiyolojik çalışmalar, gebelik öncesinde OK kullanan kadınların çocuklarında doğum defekti artışı ya da gebelik sırasında istenmeden kullanıldığında teratojenik etki saptamamıştır. Olasılıkla bütün OK'ler ile ilgili olmasına karşın, bu durumun IMPLANON NXT için de geçerli olup olmadığı belli değildir.Etonogestrel- ve desogestrel- içeren çeşitli ürünler (etonogestrel, desogestrelin bir metabolitidir) ile ilişkili farmakovijilans verileri de risk artışı göstermemiştir. Laktasyon dönemiKlinik veriler, IMPLANON NXT anne sütünün üretimini ve niteliğini (protein, laktoz ya da yağ konsantrasyonu) etkilemediğini bildirir. Bununla birlikte, etonogestrel anne sütüne az miktarda geçer. Günlük ortalama 150 ml/kg süt tüketimi temelinde, etonogestrel salımından bir ay sonra bebekte saptanan etonogestrel dozu günlük ortalama yaklaşık 27 nanogram/kg/gün olmuştur. Yaklaşık olarak bu, vücut ağırlığına göre düzeltilmiş maternal günlük dozun yaklaşık %2.2'sine ve hesaplanan mutlak maternal günlük dozun yaklaşık %0.2'sine eşittir. Sütteki etonogestrel konsantrasyonu laktasyon periyodu sırasında zaman geçtikçe azalır.Doğumdan sonraki 4-8 haftalık dönemde implant kullanmaya başlamış annelerin 38 çocuğuna ilişkin uzun dönemli veri mevcuttur. 38 çocuk ortalama 14 ay boyunca anne sütü almışlar ve 36 aylık olana dek izlenmişlerdir. Büyüme değerlendirmeleri, fiziksel ve psikomotor gelişimleri, anneleri RİA kullanan bebeklere (n=33) kıyasla fark göstermemiştir. Bununla birlikte çocuğun gelişimi ve büyümesi dikkatle izlenmelidir. Var olan veriler temelinde, IMPLANON NXT laktasyon sırasında kullanılabilir ve doğumdan 4 hafta sonra yerleştirilebilir. Üreme yeteneği/FertiliteBu tıbbi ürünün endikasyonu kontrasepsiyon olduğu için bu başlık geçerli değildir.4.7. Araç ve makine kullanımı üzerindeki etkilerEtkisi gözlenmemiştir.4.8. İstenmeyen etkilerKlinik çalışmalarda saptanan olası ilişkili istenmeyen etkiler MedDRA sistemnine göre1 aşağıda belirtilmektedir.Çok yaygın (^1/10); yaygın (^1/100 ila <1/10); yaygın olmayan (^1/1.000 ila <1/100); seyrek (^1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Enfeksiyonlar ve enfestasyonlarÇok yaygın: Vajinal enfeksiyonYaygın olmayan: Farenjit, rinit, idrar yolu enfeksiyonu Bağışıklık sistemi hastalıklarıYaygın olmayan: Aşırı duyarlılıkMetobolizma ve beslenme bozukluklarıYaygın: İştah artmasıPsikiyatrik hastalıklarıYaygın:Duygulanımda değişkenlik, depresif duygudurum, sinirlilik, libido azalması Yaygın olmayan: Anksiyete, uykusuzlukSinir sistemi hastalıklarıÇok yaygın: Baş ağrısıYaygın: Baş dönmesi (sersemlik hali) Yaygın olmayan: Migren, somnolans Vasküler hastalıklarıYaygın: Sıcak basmasıGastrointestinal hastalıklarıYaygın: Karın ağrısı,bulantı, midede şişkinlik (gaz)Yaygın olmayan: Kusma, kabızlık,ishal Deri ve derialtı doku hastalıklarıÇok yaygın:Akne Yaygın: Saç dökülmesiYaygın olmayan: Hipertrikoz, kaşıntı, döküntü Kas-iskelet bozukluklar, bağ doku ve kemik hastalıklarıYaygın olmayan: Sırt ağrısı, artralji, miyalji, iskelet kas ağrısıBöbrek ve idrar hastalıklarıYaygın olmayan: DizüriGebelik, pueperiyum durumları ve perinatal hastalıklarıÇok yaygın: Memede hassasiyet; memede ağrı, düzensiz mensturasyon Yaygın: Dismenore, over kistiYaygın olmayan: Genital akıntı, vulvovajinal rahatsızlık, galaktore, meme hipertrofisi, genital kaşıntı Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıYaygın: İmplant yerinde ağrı, implant yerinde reaksiyon, halsizlik, grip benzeri hastalık, ağrı Yaygın olmayan: Pireksia, ödemAraştırmalarÇok yaygın: Vücut ağırlığında artış Yaygın: Vücut ağırlığında azalma1 Belirli bir advers reaksiyonu tanımlamak için en sık geçen uygun MedDRA terimleri (versiyon 10.1) listelenmiştir. Anlamdaşlar ya da ilişkili koşullar listelenmemiştir, fakat dikkate alınmalıdırlar. Pazarlama sonrası gözlemler sırasında, seyrek durumlarda klinik olarak anlamlı kan basıncı yükselmesi gözlenmiştir. Sebore de bildirilmiştir. Ürtiker ve anjioödem (agrevasyonu) ve/veya herediter anjioödem agrevasyonu ortaya çıkabilir. İmplantın yerleştirilmesi ya da çıkarılması morarma, hafif lokal iritasyon, ağrı ya da kaşınmaya neden olabilir. İmplant bölgesinde fibroz meydana gelebilir, skar ya da apse oluşabilir. Parestezi ya da parestezi benzeri olaylar oluşabilir. İmplantın çıkması ya da yer değiştirmesi olasıdır (aynı zamanda bkz. 4.4. Özel kullanım uyarıları ve önlemleri'Uyarılar' bölümü). İmplant çıkarılırken cerrahi girişim gerekebilir. Seyrek olarak ektopik gebelik bildirilmiştir (bkz. 4.4. Özel kullanım uyarıları ve önlemleri'Uyarılar' bölümü). Kombine oral (kontraseptif )kullanan kadınlarda birkaç (ciddi) istenmeyen etki bildirilmiştir. Bunlar, venöz tromboembolik hastalıklar, arteroyel tromboembolik hastalıklar, hormon-bağımlı tümörler (örn; karaciğer tümörleri, meme kanseri) ve kloasma, bölüm 4.4 Özel kullanım uyarıları ve önlemlerinde daha detaylı olarak tartışılmıştır. 4.9. Dozaşımı ve tedavisiİmplant(lar) her zaman yenisi yerleştirilmeden önce çıkarılmalıdır. Etonogestrel ile ilişkili doz aşımı verisi bulunmamaktadır. Genel olarak kontraseptif doz aşımının ciddi zararlı etkilerini bildiren rapor bulunmamaktadır.5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özellikler(Farmakoterapötik grup: Progestagenler, ATC sınıflandırılması G03AC08)IMPLANON NXT implant biyolojik olarak parçalanmayan, radyoopak, etonogestrel içeren subdermal kullanılan, steril olarak yüklenmiş implant içeren, inovatif (yeni geliştirilen), tek kullanımlık bir aplikatördür. Etonogestrel, OK olarak yaygın kullanılan bir progestagen olan desogestrelin biyolojik olarak aktif metobolitidir. Yapısal olarak 19-nortestosterondan türemiştir ve hedef organlarda progesteron reseptörlerine yüksek affinite ile bağlanır. Etonogestrelin kontraseptif etkisi esas olarak ovulasyonu baskılaması yoluyla olmaktadır. Ovulasyonlar implant kullanımın ilk iki yılında görülmez ve üçüncü yılda ise sadece seyrek olarak görülür. Ovulasyonun baskılaması yanında, etonogestrel spermatozoa geçişine engel olacak biçimde, servikal mukus değişikliklerine de yol açar. 18-40 yaş arasındaki kadınlarda yürütülen klinik çalışmalarda y doğrudan karşılaştırma yapılmamış olmakla birlikte, kontraseptif etkililiği bilinen kombine oral kontraseptiflerin (%99'un üzerinde) etkileri ile en azından karşılaştırılabilir görünmektedir. Gebeliğe karşı korumada yüksek derecede etki elde edilir, çünkü IMPLANON NXT'nin kontraseptif etkililiği kadının günlük, haftalık veya haftalık bir doz rejimine uyumuna bağlı değildir. Etonogestrelin kontraseptif etkililiği geri dönüşlüdür, implant çıkarıldıktan sonra normal menstural döngü hızla geri döner. Etonogestrel ovulasyonu baskılamakla birlikte, over aktivitesi tamamen baskılanmaz. Ortalama östradiol konsantrasyonu erken foliküler evrede görülen düzeyin üzerinde kalır. İki yıllık bir çalışmada, 44 kullanıcıda kemik mineral yoğunluğu, RİA kullanıcısı 29 kadından oluşan kontrol grubu ile karşılaştırıldığında, kemik kütlesi üzerinde herhangi bir advers etki gözlenmemiştir. Lipid metabolizmasında klinik olarak anlamlı etkiler gözlenmemiştir. Progestagen içeren kontraseptiflerin kullanımı, insülin direnci ve glukoz toleransı üzerinde etki gösterebilir. Ayrıca klinik çalışmalarda IMPLANON NXT kullananlarda daha az ağrılı menstural kanama (dismenore) gözlenmiştir. 5.2. Farmakokinetik özellikler:Genel özelliklerEmilim:İmplant yerleştirilmesinden sonra, ciltaltı dokudan etonogestrel hızla dolaşıma geçer. Ovulasyonu baskılayan konsantrasyonlara 1 gün içinde ulaşılır. Maksimum serum konsantrasyonlarına (472 ve 1270 pikogram/ml arasında) 1-13 gün arasında ulaşılır. İmplantın salım hızı zaman içinde azalır. Sonuç olarak ilk birkaç aydan sonra serum konsantrasyonları hızla azalır. İlk yılın sonunda ortalama konsantrasyon yaklaşık 200 pikogram/ml (150-261 pikogram/ml) ölçülür, üçüncü yılın sonunda yavaşca 156 pikogram/ml (111-202 pikogram/ml) düzeye iner. Serum konsantrasyonlarında gözlenen farklıklarkısmen vücut ağırlığı farklılığına atfedilebilir. Dağılım:Etonogestrel, ağırlıklı olarak albümine ve daha az oranda cinsiyet hormonu bağlayan globüline olmak üzere %95.5-99 oranında serum proteinlerine bağlanır. Merkezi ve toplam dağılım hacmi sırasıyla 27 l ve 220 l'dir ve IMPLANON NXT kullanımı sırasında nadiren değişir. Biyotransformayon:Etonogestrel hidroksilasyona ve redüksiyona uğrar. Metabolitleri, sülfatlar ve glukronidlerle konjuge olur. Hayvan çalışmaları, enterohepatik dolaşımın etonogestrelin progestagenik aktivitesine olasılıkla katkıda bulunmadığını göstermiştir. Eliminasyon:Etonogestrelin intravenöz uygulanmasının ardından, ortalama eliminasyon yarılanma ömrü yaklaşık 25 saattir ve serum klerensi yaklaşık 7.5 l/saattir. Klerens ve eliminasyon yarı ömrü, tedavi periyodu boyunca sabit kalır. Etonogestrelin ve serbest steroid ya da konjugat olarak metabolitlerinin atılması, idrar ve feçesle (1.5:1 oranında) olmaktadır. Emziren kadınlarda yerleştirildikten sonra, etonogestrelin ilk dört ay boyunca anne sütündeki süt/ serum oranı 0.44-0.50'dir. Emziren kadınlarda, bebeğe geçen ortalama etonogestrel miktarı annenin günlük etonogestrel dozunun yaklaşık %0.2'sidir (vücut ağırlığına göre uyarlandığında %2.2). Konsantrasyonlar, zamanla istatistiksel olarak anlamlı ve kademeli olarak azalır. 5.3. Klinik öncesi güvenlilik verileriToksikolojik çalışmalar, uygulamayolundan bağımsız olarak, etonogestrelin hormonal özellikleri temelinde açıklanabilecek olanlar dışında, herhangi bir etki ortaya çıkarmamıştır.6. FARMASÖTIK ÖZELLIKLER6.1. Yardımcı maddelerin listesiEtilen vinilasetat kopolimer (%28 vinil asetat), baryum sülfat Etilen vinilasetat kopolimer (%14 vinil asetat)6.2. GeçimsizliklerGeçerli değildir.6.3. Raf ömrüBölüm 6.4'te belirtildiği gibi saklandığında, IMPLANON NXT raf ömrü 60 aydır. IMPLANON NXT ambalajın üzerindeki son kullanma tarihinden sonra yerleştirilmemelidir.6.4. Saklamaya yönelik özel tedbirler30°C'nin altında, oda sıcaklığında, ışık ve rutubetten koruyarak, orijinal ambalajındasaklanmalıdır.6.5. Ambalajın niteliği ve içeriğiAmbalaj, kullanıma hazır paslanmaz çelik iğne, tek kullanımlık, steril aplikatör içeren bir implant (4 cm uzunluğunda ve 2 mm çapında) içerir. İmplantı içeren aplikatör, şeffaf polietilen tereftalat glikolden (PETG) yapılmış ve kaplama kağıdı ile mühürlenmiş blister ambalajdadır. Blister ambalaj kullanma talimatı ile birlikte bir kutuda paketlenmiştir.6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerBkz. Bölüm 4.2 (Pozoloji ve kullanım şekli)Aplikatör yalnızca tek kullanım içindir. 7. RUHSAT SAHİBİMerck Sharp Dohme İlaçları Ltd. Şti.Esentepe / İstanbul Telefon no: 0 212 336 10 00 Faks no: 0 212 215 27 33 8. RUHSAT NUMARASI112/999. İLK RUHSAT TARİHİ/RUHSAT YENİLENME TARİHİİlk ruhsat tarihi: 13.09.2002 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİı9 |
İlaç Bilgileriİmplanon NXT 68 mg implantEtken Maddesi: Etonogestrel Atc Kodu: G03AC08 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.