Momecon %0.05 Burun Spreyi Kısa Ürün BilgisiSolunum Sistemi » Burunla İlgili İlaçlar » Topikal Dekonjestanlar ve Diğer Nazal İlaçlar » Kortikosteroidler » MometazonNazal KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIMOMECON % 0.05 burun spreyi2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Mometazon ftıroat monohidrat 0.5175 mg/gYardımcı maddeler:Benzalkonyum klorür 2.00 mg/gYardımcı maddeler için 6.I.' e bakınız. Bir püskürtme 50 mikrogram mometazon fiıroata eşdeğer 100 mg süspansiyon verir. 3. FARMASOTİK FORMÖlçülü sprey pompası ile kullanılan nazal sprey,Beyaz renkli, çalkalandığmda homojen görünümlü süspansiyon 4. KLİNİK ÖZELLİKLER4.L Terapötik endikasyonlarMOMECON erişkinler, adolesanlar ve 6-11 yaş arasındaki çocuklarda mevsimsel ve yıl boyu süren aleıjik rinit semptomlarının tedavisinde endikedir.MOMECON, erişkinler ve 12 yaş ve üzerindeki adolesanlarda mevsimsel aleıjik rinitin profılaksisinde endikedir. MOMECON, 3-6 yaş arasında aleıjik rinit tamsı almış olan çocuklarda kullamlabilir. Profilaktik tedaviye polen mevsiminin beklenen başlangıcından 2-4 hafta önce başlanmalıdır. MOMECON, aynca, 18 yaş veya üzerindeki erişkinlerde nazal poliplerin, konjesyon ve koku duyusu kaybı dahil ilgili semptomlann tedavisinde kullamlır. 4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:ilk kullammda veya sprey pompası 14 gün veya daha uzun süre bir süre kullamhnamışsa, kullanımdan önce sprey pompasını ayarlamak için, ilaç, düzgün bir şekilde püskürdüğü görülünceye kadar, genellikle 10 kez püskürtülmelidir. Her püskürtme 50 mikrogram mometazon ftıroata eşdeğer mometazon fiıroat monohidrat içeren yaklaşık 100 mg mometazon furoat süspansiyonu içerir. Eğer sprey pompası 14 gün veya daha uzun süreyle kullamimamış ise, bir sonraki kullanımdan önce, 2 kez püskürtülerek, ilaç, düzgün bir şekilde püskürdüğü görülünceye kadar yeniden ayarlanmalıdır.Mevsimsel alerjik va da vıl bovu sûren rinit;Erişkinler (yaslı hastalar dahiD ve adolesanlar:Profilaksi ve tedavi için genellikle önerilen günlük doz her burun deliğine günde bir kez iki püskürtme (50 mikrogram/1 püskürtme) olmak üzere toplam 200 mikrogram'dır. Semptomların kontrol altına alınmasından sonra idame dozu her burun deliğine bir püskürtme olmak üzere günde toplam 100 mikrogram'a düşürülebilir.Semptomlar yeterince kontrol altına alınamamışsa, günlük maksimum doz her burun deliğine dört püskürtme olmak üzere toplam 400 mikrogram'a çıkarılabilir. Semptomların kontrol altına alınmasından sonra dozun düşürülmesi önerilir. 3-11 yas arasındaki çocuklar:Önerilen günlük doz her burun deliğine günde bir kez bir püskürme (50 mikrogram/1 püskürtme) olmak üzere toplam 100 mikrogram'dır.MOMECON, mevsimsel alerjik rinitli bazı hastalarda ilk dozdan sonra 12 saat içerisinde klinik etkinlik başlangıcı göstermektedir. Tam tedavi faydası ilk 48 saat içerisinde sağlanamayabilir. Bundan dolayı hasta tam tedavi faydası sağlayabilmek için tedaviye devam etmelidir. Nazal polipozis tedavisi:Erişkinler (yaslı hastalar dahil) ve 18 yasında veva daha büvük adolesanlar:Önerilen günlük doz her burun deliğine günde iki kez iki püskürtme (50 mikrogram/1 püskürtme) olmak üzere toplam 200 mikrogram'dır. Semptomlar 5-6 hafta içinde yeterince kontrol altına alınamamışsa, günlük maksimum doz her burun deliğine günde iki kez iki püskürtme ile toplam 400 mikrogram'a çıkarılabilir. Doz, semptomların etkin kontrolünü sağlayan en düşük doza ayarlanmalıdır. Günde iki kez uygulamayla 5-6 hafta içinde semptomlarda hiçbir iyileşme görülmezse, alternatif tedaviler düşünülmelidir. MOMECON'un nazal polipozis tedavisi için çalışmaları 4 ay sürelidir. İlk dozu uygulamadan önce, pompayı iyice çalkalayımz ve ilaç, düzgün bir şekilde püskürdüğü görülünceye kadar 10 kez püskürtünüz. Pompa 14 gün veya daha uzım süre kullanılmamışsa, pompayı ilaç, düzgün bir şekilde püskürdüğü görülünceye kadar 2 kez püskürtünüz. Her kullammdan önce sprey pompasını çalkalayımz. İlk kullanımdan sonra 2 ay içerisinde ya da belirlenen sayıdaki püskürtmeden sonra sprey pompasını atabilirsiniz. Uygulama sıklığı ve süresi:Uygulama şekli:MOMECON burun deliklerine püskürtülerek kullamlır.Kullanım talimatı 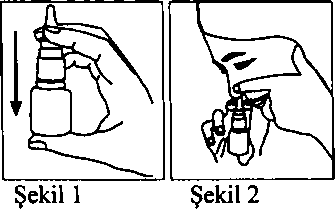 1. Şişe yavaşça çalkalanır ve plastik kapak çıkartılır. İlacın nasıl tutulması gerektiği Şekil l'de yer almaktadır.
1. Şişe yavaşça çalkalanır ve plastik kapak çıkartılır. İlacın nasıl tutulması gerektiği Şekil l'de yer almaktadır.2. Hastamn burun deliklerinin açılması için, hastadan burnunu nazikçe sümkürmesi ya da nefesini burnundan dışanya doğru vermesi istenir. 3. Hastanın burun deliklerinden biri kapatılarak burun aplikatörünün ucu diğer burun deliğine yerleştirilir. Hastanın başı hafifçe öne eğilirken şişe dik tutulur (Şekil 2). 4. Hastamn nefes alım ritmine göre, hasta nefesini içeri çekerken, burun aplikatörüne bir kere bastırarak hastamn burnuna püskürtülür. Uygulamamn burun septumuna yapılmamasına dikkat edilmelidir. 5. Şişe hastamn burun deliğinden uzaklaştmlır ve hastaya nefesini ağızdan vermesi için talimat verilir. 6. Diğer burun deliği için 3'ten 5'inci basamağa kadar olan işlemler tekrarlamr. Spreyi kullandıktan sonra temiz bir mendil veya kağıt mendil ile ağzım siliniz ve kapağmı kapatınız. özel popülasyonlara ilişkin ek bilgiler: Böbrek^araciğer yetmezliği: Böbrek ya da karaciğer yetmezliği olan hastalar için veri bulunmamaktadır. Pediyatrik popülasyon: Nazal kortikosteroidlerin sistemik etkileri, özellikle uzun sürelerle yüksek dozlarda kullanımda görülebilir. Ruhsatlı dozlarda nazal kortikosteroidler alan çocuklarda büyümede yavaşlama bildirilmiştir. Nazal kortikosteroidler ile uzun süre tedavi edilen çocuklarda boy uzunluğunım düzenli olarak takip edilmesi önerilir. Büyüme yavaşlarsa, nazal kortikosteroid dozunun mümkünse, etkin semptom kontrolü sağlayan en düşük doza indirilmesi amacıyla tedavi gözden geçirilmelidir. Aynca hastamn bir çocuk hastalıkları uzmanına şevki düşünülmelidir. Geriyatrik popülasyon: Geriyatrik popülasyon için nazal polipozis tedavisi erişkinler gibidir. 4.3. Kontrendikasyonlar MOMECON'un bileşenlerinden herhangi birine karşı aşın duyarlılık durumunda kullamimamalıdır. MOMECON nazal mukoza ile ilişkili tedavi edilmemiş lokalize enfeksiyonların varlığmda kullanılmamalıdır. Kortikosteroidlerin yara iyileşmesine olan inhibitör etkisinden dolayı yakın geçmişte burun ameliyatı veya travması geçirmiş olan hastalarda yara iyileşmeden önce nazal kortikosteroidler kullamimamalıdır. 4.4. Özel kullanım uyanlan ve önlemleriMOMECON, aktif veya latent solunum yolu tüberküloz enfeksiyonları, tedavi edilmemiş mantar, bakteri veya sistemik virüs enfeksiyonları veya okülerherpes simpleksenfeksiyonu olan hastalarda dikkatle kullamimalıdır.MOMECON ile 12 aylık bir tedaviden sonra nazal mukozada herhangi bir atrofi belirtisi gözlenmemiştir; aym zamanda mometazon furoat nazal mukozayı normal histolojik fenotipine döndürme eğilimi göstermiştir. Her uzun süreli tedavide olduğu gibi birkaç ay veya daha uzun süre MOMECON kullanan hastalar muhtemel nazal mukoza değişikliği yönünden kontrol edilmelidir. Eğer burun veya farenkste lokalize mantar enfeksiyonu gelişirse, MOMECON ile tedavinin kesilmesi veya uygun tedavi uygulaması gerekebilir. Nazofarenkste inatçı iritasyon MOMECON ile tedavinin kesilmesini gerektirebilir. MOMECON hastaların çoğunda burun semptomları üzerinde kontrol sağlayacaktır; bununla birlikte uygun başka bir tedavinin eş zamanlı kullanımı diğer semptomlarda da (özellikle göz semptomlan) ilave iyileşme sağlayabilir. MOMECON'un uzun süre kullamiması ile hipotalamo-hipofızeal-adrenal (HPA) aksın süpresyonuna ilişkin hiç bir delil yoktur. Bununla beraber uzım süren sistemik kortikosteroid kullammından MOMECON kullammına geçen hastalar için dikkatli bir ilgi gerekir. Bu hastalarda sistemik kortikosteroidin kesilmesi, HPA aksın fonksiyonlan düzelinceye kadar bir kaç ay adrenal yetmezlik belirtileri ile sonuçlanabilir. Bu hastalar adrenal yetmezlik belirtileri gösterirlerse sistemik kortikosteroid tedavisine devam edilmeli ve diğer tedavi usulleri ve gerekli önlemler uygulanmalıdır. Sistemik kortikosteroidlerden MOMECON'a geçişte bazı hastalarda nazal semptomlarda hafifleme görülmesine karşın sistemik kortikosteroid kesilme semptomlarından (örn. eklem ve/veya adale ağnsı, yorgımluk, ve başlangıçta depresyon) şikayetçi olabilirler. Bu durumda MOMECON ile tedaviye devam etmeleri önerilmelidir. Böyle bir geçiş aym zamanda aleijik konjunktivit veya egzama gibi önceden var olan ve sistemik kortikosteroid tedavisi ile süprese olmuş aleijik durumlann açığa çıkmasına da neden olabilir. Tek taraflı polipler, kistik fıbrozla ilişkili polipler veya burun boşluklannı tamamen bloke eden poliplerin tedavisinde MOMECON'un güvenlilik ve etkililiği çalışılmamıştır. Görünümleri olağandışı veya düzensiz olan tek taraflı polipler, özellikle de ülserleşme veya kanama olanlar daha ileri düzeyde tetkik edilmelidir. Nazal kortikosteroidlerin sistemik etkileri, özellikle uzun sürelerle yüksek dozlarda kullanımda görülebilir. Ruhsatlı dozlarda nazal kortikosteroidler alan çocuklarda büyümede yavaşlama bildirilmiştir. Kortikosteroid kullanan potansiyel olarak immünosüprese olmuş hastalar bazı enfeksiyonlara (örn. suçiçeği, kızamık gibi) yakalanma riskine karşı uyanimalı ve böyle bir durumla karşılaşıldığında tıbbi yardım alınmasımn önemi belirtilmelidir. intranazal kortikosteroid kullammmı takiben nazal septum perforasyonu veya intraoküler basınçta artış çok nadir olarak bildirilmiştir. MOMECON'un, 18 yasından küçük çocuklarda ve adolesanlarda nazal poliplerin tedavisindeki güvenlilik ve etkinliği üzerinde çalışma yapılmamıştır. Nazal kortikosteroidler ile uzun süre tedavi edilen çocuklarda boy uzunluğımım düzenli olarak takip edilmesi önerilir. Büyüme yavaşlarsa, nazal kortikosteroid dozunvm mümkünse, etkin semptom kontrolü sağlayan en düşük doza indirilmesi amacıyla tedavi gözden geçirilmelidir. Ayrıca hastanın bir çocuk hastalıkları uzmanına şevki düşünülmelidir. Tavsiye edilenden daha yüksek dozlarla tedavi klinik yönden anlamlı adrenal süpresyona yol açabilir. Önerilenden daha yüksek dozlarm kullamidığma dair kanıtlar varsa, stres veya cerrahi dönemlerinde ilave sistemik kortikosteroid kullammı düşünülmelidir. Yardımcı madde: Benzalkonyum klorür: MOMECON, benzalkonyum klorür içermektedir. 1 püskürtmede 0,2 mg'a eşdeğer benzalkonyum klorür bulunur. Bu miktann bronkospazma neden olması beklenmemektedir. Nazal Spreyin TemizlenmesiKullamlan burun aplikatörünün düzenli olarak temizlenmesi önemlidir. Aksi takdirde aplikatör düzgün püskürtme sağlayamayabilir. Burun aplikatörünü temizlemek için aşağıdaki talimatlar uygulanmalıdır.
1. Plastik kapağı çıkanmz ve musluk suyu ile çalkalayımz. 2. Yavaşça burun aplikatörünü yukan doğru çekiniz (Şekil 3) 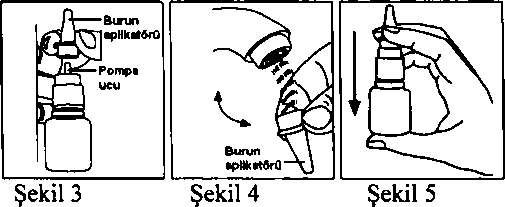 3. Burun aplikatörünü musluk suyu ile çalkalayınız (Şekil 4). Kesici delici materyal ya da iğne ile deliği kurcalamayımz.
3. Burun aplikatörünü musluk suyu ile çalkalayınız (Şekil 4). Kesici delici materyal ya da iğne ile deliği kurcalamayımz.4. Burun aplikatörünü pompa ucuna oturacak şekilde yeniden yerleştiriniz. 5. Şekil 5'te olduğu gibi, şişeyi başparmağınızla alttan destekleyiniz. İşaret ve orta parmaklanmzi beyaz aplikatöre yerleştiriniz ve aşağıya doğru bastırarak, ilacmızm dışan doğru püskürmesini sağlayımz. Düzgün püskürtme elde edinceye kadar, bu işlemi tekrarlaymız. 6. Yine musluk suyu ile temizlenmiş olduğunuz plastik kapağı kapatımz. 4.5. Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriMometazon furoat, loratadin ile birlikte klinik etkileşim çalışması yapılmıştır. Bu çalışmalarda, mometazon furoatm plazma konsantrasyonlan düşük ölçüm limiti 50 pg/mL olan hassas analizlerle ölçülemez düzeydedir.özel popülasyonlara ilişkin ek bilgilerözel popülasyonlara ait hiçbir etkileşim çalışması yapılmamıştır.Pediyatrik popülasyon:Pediyatrik popülasyona ait hiçbir etkileşim çalışması yapılmamıştır.4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi C'dir.Çocuk doğurma potansiyeli bulunan kadmlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlarda kullammma ilişkin yeterli veri mevcut değildir.Gebelik dönemiGebe kadınlarda yeterli ve kontrollü çalışma yapılmamıştır. Klinik olarak önerilen maksimum dozun intranazal uygulamasından sonra mometazon plazma konsantrasyonlan ölçülememektedir; bu nedenle fetüsün maruz kaldığı mometazonun ihmal edilebilir ve üreme toksisitesi potansiyelinin çok düşük olması beklenir.Laktasyon dönemiDiğer nazal kortikosteroid preparatlan ile olduğu gibi MOMECON'un gebe, emziren veya gebelik riski taşıyan kadınlarda kullanımına karar verilirken anne, fetüs ve bebeğe verilebilecek olası zararlar, beklenen yararlarla karşılaştınimalıdır. Gebeliği sırasında kortikosteroid tedavisi gören annelerin doğan bebekleri hipoadrenalizm yönünden dikkatle izlenmelidir.Üreme yeteneği/FertiliteMOMECON'un insanlar üzerindeki üreme yeteneğine ilişkin yeterli veri mevcut değildir.4.7. Araç ve makine kullanma yeteneği üzerindeki etkilerAraç ve makine kullammı üzerine etkisi bilinmemektedir.4.8. İstenmeyen etkiler\Klinik çalışmalarda aletjik rinitli yetişkin ve adolesan hastalarda rapor edilen tedaviye bağlı istenmeyen olaylar aşağıda belirtilmiştir: Çok yaygm (>1/10), yaygm (>1/100 ila <1/10), yaygın olmayan (>1/1.000 ila <1/100), seyrek (>1/10.000 ila <1/1.000), çok seyrek (<1/10.000), bilinmiyor (eldeW verilerden hareketle tahmin edilemiyor). Göz Hastalıklan:Bilinmiyor:Göz basıncında artışa (glokom) bağlı olarak görme bozuklukları Solunum, göğüs bozuklukları ve mediastinal hastalıklar:Yaygm:Epistaksis, farenjit, nazal yanma, nazal iritasyon, nazal ülserasyon Kas-iskelet bozuklukları ve bağ doku ve kemik hastalıkları:Bilinmiyor:Çocuklarda uzun süreli kullammda büyüme hızında yavaşlama Nazal kortikosteroidler ile uzun süreli tedavi alan çocukların boy uzunluğımun düzenli takip edilmesi önerilir. Genel bozukluklar ve uygulama bölgesine ilişkin bozukluklar:Yaygın:Baş ağrısı Epistaksis genelde hafif şiddette olup kendiliğinden geçmiştir. İnsidansı plaseboya kıyasla daha yüksek (% 5) olmakla birlikte karşılaştmlan aktif kontrol nazal kortikosteroidlerle (% 15'e kadar) kıyaslanabilir veya daha düşüktür. Diğer tüm etkilerin insidansı plasebo ile karşılaştmlabilir oranlardadır. Pediyatrik hastalarda, advers etki insidansı, ör. baş ağnsı (% 3), epistaksis (% 6), burunda iritasyon (% 2) ve hapşırma (% 2) plasebo ile kıyaslanabilir düzeydedir. Mometazon furoat monohidratın intranazal uygulamasından sonra nadiren ani aşın duyarlılık reaksiyonu (bronkospazm, dispne gibi) meydana gelebilir. Çok nadiren anaflaksi ve anjiyoödem bildirilmiştir. Çok nadir olarak tat ve koku alma bozukluğu bildirilmiştir. Nazal Polipozis:Nazal polipozis için tedavi edilen hastalarda, advers olaylann genel insidansı, plaseboyla kıyaslanabilir nitelikte olup aleıjik rinitli hastalarda gözlemlenenlere benzerdir. Polipozis için yürütülen klinik çalışmalarda hastaların % 1 veya daha fazlasında bildirilen tedaviye bağlı advers olaylar şunlardır:Solunum, göğüs bozuklukları ve mediastinal hastahklar:Çok yaygın:Burun kanaması günde iki kez 200 mikrogram ile çok yaygın Yaygın: Üst solunum yolu enfeksiyonu günde bir kez 200 mikrogram ile, burun kanaması günde bir kez 200 mcg ile Yaygın olmayan: Üst solunum yolu enfeksiyonu günde iki kez 200 mikrogram ile Gastrointestinal bozukluklar:Yaygın:Boğaz iritasyonu: günde iki kez 200 mikrogram ile Genel bozukluklar ve uygulama bölgesine ilişkin bozukluklar:Yaygın:Günde bir kez 200 mcg ile, günde iki kez 200 mikrogram ile Nazal kortikosteroidlerin sistemik etkileri özellikle uzun dönemlerde yüksek dozlarla reçetelendiğinde görülmektedir. 4.9. Doz aşımı ve tedavisiMOMECON'un sistemik biyoyararlanımı (0,25 pg/mL gibi düşük ölçü limiti olan hassas aletlerle) <% 1 olduğımdan, MOMECON'un aşın doz alımı hastanın gözlenmesi ve sonra reçete edilen uygun dozun başlatılmasından başka bir önlemi gerektirmez.5.FARMAKOLOJİK ÖZELLİKLER5.L Farmakodinamik özelliklerFarmakoterapötik grubu: Dekonjestanlar ve Topikal Kullamlan Diğer Nazal Preparatlar-Kortikosteroidler ATC kodu: ROl AD09 Mometazon fiıroat sistemik olarak etkin olmayan dozlarda lokal olarak antiinflamatuvar özellikleri olan bir topikal glikokortikosteroiddir. Muhtemelen mometazon furoatm antialeıjik ve antiinflamatuvar etkilerinin mekanizması aleijik reaksiyonların medyatörlerini inhibe etmesine dayamr. Mometazon aleijik hastalann lökositlerinden lökotrienlerin salgılanmasını belirgin olarak inhibe eder. Hücre kültüründe, IL-1, IL-6 ve TNFa sentez ve salınımmm inhibisyonunda mometazon fiıroat yüksek etkinlik göstermiştir, aynca lökotrien üretiminin potent inhibitörüdür. Ek olarak, sitokinlerden Th2, insan CD+4 hücrelerinden IL-4 ve IL-5 üretiminin etkin mhibitörüdür. Nazal antijen yükleme testlerinde mometazon fiıroat hem erken hem de geç dönem aleijik cevapta antiinflamatuvar etki göstermiştir. Bu durum histamin ve eozinofıl aktivitesinin düşmesi (plaseboya karşı) ve eozinofıl, nötrofıl ve epitel hücre adezyon proteinlerinde (başlangıca göre) azalma ile gösterilmiştir. Mevsimsel aleıjik rinitli hastalann % 28'inde klinik olarak anlamlı etki, ilk dozdan 12 saat kadar kısa bir süre sonra başlar. Ortalama iyileşme başlangıç zamam (% 50) 35.9 saattir. 1954 hastada yürütülen iki araştırmada, günde iki kez mometazon furoat 200 mikrogram, 15 günlük tedavi dönemi boyunca rinosinüzit semptomlarının plaseboya kıyasla anlamlı derecede iyileşmesinde etkili olmuştur (P02683, p <0.001; P02692, p= 0.038). Bu çalışmada değerlendirme, semptomlann (yüzde ağn^asmç hissi/hassasiyet, sinüzal baş ağrısı, burun akıntısı, geniz akıntısı ve nasal konjesyon/dolgunluk) Majör Semptom Skoru (MSS) bileşkesi incelenerek yapıhmştı. Günde üç kez 500 mg şeklindeki amoksisilin kolu, semptomlann azaltılmasında, MSS ile değerlendirildiğinde plasebodan anlamlı derecede farklılık göstermemekteydi. SNOT-20 HRQL, mometazon fvıroatla plaseboya göre (p=0.047) günde iki kez 200 mikrogram, dozlarda anlamlı düzeyde iyileşme göstermiştir. Aynca tedavi sonrası izleme döneminde, mometazon furoat ile görülen nüks sayısı düşüktü ve amoksisilin ve plasebo gruplarıyla kıyaslanabilir nitelikteydi. Akut rinosinüzitte 15 günden daha uzun süreli tedavi incelenmemiştir. Pediyatrik hastalarla yürütülen bir plasebo-kontrollü klinik çalışmada (her grupta 49 hasta) mometazon furoat 100 mikrogram, bir yıl süreyle günde bir kez uygulanmış ve büyüme hızında azalma gözlenmemiştir. 3-5 yaş arası pediyatrik popülasyonda momatazon furoatın güvenlilik ve etkililiğine dair veriler sımrlıdır ve uygun dozaj aralığı saptanamaz. intranazal mometazon furoat 50, 100 veya 200 mikrogram/gün ile 14 gün tedavi edilen 3-5 yaş arası 48 çocukta yürütülen bir çalışmada, tetrakosaktrin stimülasyon testine yamt olarak plazma kortizol düzeyinde ortalama değişim bakımından plaseboya göre anlamlı fark saptanmamıştır. 5.2. Farmakokinetik özellikleri Genel özelliklerEmilim:Nazal yoldan uygulanan mometazon furoatın plazmadaki sistemik biyoyararlammı, 0.25 pg/mL gibi düşük ölçüm limiti olan hassas analizler kullamidığmda <1 'dir. DaSılım:Mometazon furoat süspansiyonun gastrointestinal kanaldan absorbsiyonu çok azdır. Bivotransformasvon:Yutulabilecek ve absorbe olabilecek az miktar ise idrar ve safra ile atılmadan önce karaciğerde önemli ölçüde ilk geçiş etkisine uğrar. Eliminasvon:Veri bulunmamaktadır. DoSrusallık/DoSrusal olmavan durum:Veri bulunmamaktadır. S.3. Klinik öncesi güvenlUik verileriKlinik öncesi çalışmalar mometazon furoatm androjenik, antiandrojenik, estrojenik veya antiestrojenik aktivitesinin olmadığı fakat diğer glukokortikoidler gibi bir miktar antiuterotrofik etki gösterdiği ve hayvan modellerinde 56 mg/kg/gün ve 280 mg/kg/gün gibi ytiksek oral dozlarda vajina açılmasını geciktirdiği gözlenmiştir.Diğer kortikosteroidler gibi, mometazon ftıroat in vitroĞa.yüksek konsantrasyonlarda klastojenik potansiyel göstermiştir. Bununla birlikte, terapötik olarak eşdeğer dozlarda mutajenik etkiler gözlemlenmemiştir.15 mikrogram/kg dozda gestasyonda uzama ile doğumun uzaması ve güçleşmesi ile yaşayan yavru sayısı ile vücut ağırlığı ve ağırlık artışında azalma meydana gelmiştir. Fertiliteye bir etkisi olmamıştır. Diğer glukokortikoidler gibi mometazon furoat kemirgenler ve tavşanlarda teratojendir. Teratoloji çalışmalan sıçanlarda, farelerde ve tavşanlarda, oral, topikal (dermal) ve/veya subkutan yoldan ilaç verilerek çalışılmıştır. Gözlenen etkiler >600 mikrogram/kg uygulanan sıçanda umblikal hemi, 180 mikrogram/kg uygulanan farede yank damak ve >150 mikrogram/kg uygulanan tavşanda safra kesesi agenizi, umblikal hemi ve bükük ön peçelerdir. Aym zamanda sıçan, tavşan ve farede matemel vücut artışında azalma, fetüs gelişmesine etki (düşük fetal ağırlık ve/veya osifikasyon gecikmesi) ve farede hayatta kalan yavrulann sayısında azalma olmuştur. Mometazon furoata maruz kalmaya özgün herhangi bir toksikolojik etki görülmemiştir. Görülen tüm etkiler kortikostreoid sınıfı ilaçlara özgü olup, kortikosteroidin aşın farmakolojik etkileri ile ilişkilidir. İnhalasyon ile verilen mometazon furoatm (CFG propellan ve yüzey aktifli aerosol) karsinojenik potansiyeli 0.25 ile 2.0 mikrogram/L konsantrasyonlarda fare ve sıçanda 24 ay süreli çalışmalar ile araştınlmıştır. Glukokortikoidlerle ilgili tipik etkiler, birkaç nonneoplastik lezyon dahil, gözlenmiştir. Tümör tiplerinin hiç birinde istatistiksel olarak anlamlı doz-cevap ilişkisi saptanmamıştır. 6. FARMASÖTİK ÖZELLİKLERİ6.1. Yardımcı maddelerin listesiMikrokristalin selüloz - Karboksimetil selüloz sodyımı kanşımıGliserin Polisorbat 80 Sodyum sitrat dihidrat Sitrik asit monohidrat Benzalkonyum klorür Saf su 6.2. GeçimsizliklerGeçerli değil.6.3. Raf ömrü24 aytik kullanımdan sonra iki ay içinde kullanılmalıdır. 6.4. Saklamaya yönelik özel tedbirler25 °C'nin altmdald oda sıcaklığmda, orijinal ambalajında saklayımz.Direkt gün ışığına maruz bırakmayımz. Dondurmayımz. 6.5. Ambalajm niteliği ve içeriğiMOMECON % 0.05 Burun Spreyi, 140 püskürtme için 18 g süspansiyon içeren manuel doz ayarlı, nazal aplikatörlü polietilen plastik şişede6.5. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerözel bir gereklilik yoktur.Kullamimamış olan ürün ya da atık materyaller, Tıbbi Atıklann Kontrolü ve Ambalaj ve Ambalaj Atıklannın Kontrolü yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİBİLİM İLAÇ SAN. ve TİC. A.Ş.34398 Şişli-İSTANBUL 8. RUHSAT NUMARASI240/299. RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİilk ruhsat tarihi: 16.02.2012 Ruhsat yenileme tarihi;10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriMomecon %0.05 Burun SpreyiEtken Maddesi: Mometazon furoat Atc Kodu: R01AD09 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.