Kan ve Kan Yapıcı Organlar » Kanama Durdurucu İlaçlar » K Vitamini ve Diğer Hemostatikler » Kan Koagülasyon (pıhtılaşma) Faktörleri » İnsan Faktör IX Konsantresi
KISA ÜRÜN BİLGİSİ
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
AIMAFIX 500 IU/ 10 mİ IV infuzyon için liyofilize toz içeren flakon Steril, apirojen
2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:
insan plazma kaynaklı yüksek saflıkta, pıhtılaşma Faktör IX 500 IU'dir.
10 mİ enjeksiyonluk su ile çözündürülür.
Yardımcı madde(ler):
^ Sodyum klorür 76.0 mg
Heparin sodyum <100.0 IU Sodyum sitrat 29.4 mg
Yardımcı maddeler için bölüm 6.1'e bakınız.
3. FARMASÖTİK FORM
İnfüzyonluk solüsyon için toz ve çözücü.
Tıbbi ürün beyaz veya açık sarı, toz veya ufalanabilen katı.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik Endikasyoniar
Aşağıdaki kanamaların profılaksisi ve tedavisinde:
® Hemofili B hastaları (Konjenital Faktör IX yetmezliği)
Edinilmiş Faktör IX yetmezliği
4.2. Pozoloji ve uygulama şekİi Pozoloji / uygulama sıklığı ve süresi:
Tedaviye hemofili tedavisinde deneyimli bir doktorun gözetiminde başlanmalıdır.
Yerine koyma tedavisinin dozu ve süresi hemostatik fonksiyondaki bozukluğun derecesine, kanamanın yerine, önemine ve klinik durumuna bağlıdır. Uygulanan Faktör EX ünitelerinin sayısı Faktör IX ürünleri için güncel Dünya Sağlık Örgütü standardına ilişkin uluslararası ünite (IU) olarak gösterilir. Plazmadaki Faktör IX aktivitesi ya bir yüzde (normal insan
plazması ile bağlantılı) ya da uluslararası üniteler (plazmadaki Faktör IX için uluslararası bir standart ilişkin) olarak gösterilir.
Bir ünite (IU) Faktör IX aktivitesi 1 mL normal insan plazmasında bulunan Faktör IX miktarına eşdeğerdir.
ı/ıı
Gerekli Faktör IX dozu, 1 IU/kg Faktör IX'un plazma Faktör IX aktivitesini % 0.8 yükselttiği şeklindeki ampirik bulgu esas alınarak hesaplanır.
Gerekli doz aşağıdaki formül kullanılarak hesaplanır.
Gerekli Ünite = Vücut ağırlığı (kg) x İstenen Faktör IX artışı (%) x (karşılıklı gözlenen geri kazanım)
Uygulanacak miktar ve uygulama sıklığı her vakada daima klinik etkinliğe göre izlenmelidir. Faktör IX ürünleri seyrek olarak günde bir kez uygulamadan daha fazla uygulama gerektirebilir.
Aşağıdaki kanama şekillerinde Faktör IX aktivitesi ilgili dönem süresince belirtilen plazma aktivite seviyelerinin (normalin yüzdesi olarak) altına düşmemelidir. Aşağıdaki tablo kanama episodlan ve müdahalelerde doz için kılavuz olarak kullanılabilir.

Kanama Derecesi/ Cerrahi Prosedür Türü |
Gerekli plazma Faktör IX seviyesi (%) |
Dozların Sıklığı (saat)/ Tedavinin Süresi (gün) |
Kanama |
Erken hemartrozis,
Kas kanaması ya da oral kanama
|
20-40
|
Her 24 saatte bir tekrarlanır, ağrı ile oluşan kanama çözülünceye ya da iyileşme sağlanıncaya kadar en az 1 gün
|
Daha büyük hemartrozis Kas kanaması ya da hematom
|
30-60
|
Infüzyon 3-4 gün ya da daha fazla süreyle, ağrı ve akut yetersizlik çözülünceye kadar her 24 saatte tekrarlanmalı
|
Hayatı tehdit eden kanamalar
|
60-100
|
Infüzyon her 8-24 saatte bir tehlike geçinceye kadar tekrarlanmalıdır.
|
Ameliyat |
Minör
Diş çekimi dahil
|
30-60
|
Her 24 saatte bir, iyileşme gerçekleşinceye kadar en az 1 gün süresince.
|
Majör
|
80-100 (pre ve post operatif)
|
İnfuzyon, yeterli yara iyileşmesi oluncaya kadar her 8-24 saatte bir tekrarlanmalıdır, daha sonra faktör IX aktivitesini % 30 -% 60 (IU/dL) arasında sürdürmek için en az 7 gün süresince tedaviye devam edilir.
|
Tedavi süresince, yeterli Faktör IX seviyelerinin belirlenmesi, uygulanacak dozun ve tekrarlanan infiizyonlann sıklığına yol göstermek için önerilir. Özellikle büyük ameliyat durumlarında, koagülasyon analizi (plazma Faktör IX aktivitesi) yoluyla yerine koyma tedavisinin yeterli takibi gereklidir. Her hastanın bireysel olarak farklı
in vivo
geri kazanım ve farklı yarı ömür gösterdiği
2/11
Faktör IX'a cevabı farklıdır.
Profılaksi
Şiddetli Hemofili B hastalarında kanamaya karşı uzun dönem profılaksi için, alışılmış dozlar
3-4 günlük aralıklarla vücut ağırlığının kg başına 20-40 IU Faktör IX*dur. Bazı vakalarda, özellikle genç hastalarda, daha kısa doz aralıkları ya da daha yüksek dozlar gerekebilir.
AIMAFIX'in 6 yaşından küçük çocuklarda kullanımına dair yeterli veri mevcut değildir.
Hastalar Faktör IX inhibitörlerinin gelişimi açısından takip edilmelidir. Eğer beklenen Faktör IX aktivite plazma seviyelerine ulaşılamazsa, ya da kanama uygun bir doz ile kontrol edilemezse, Faktör IX inhibitörü olup olmadığı bir tahlil yapılarak belirlenmelidir. Yüksek seviyelerde inhibitörlü hastalarda Faktör IX tedavisi etkili olmayabilir ve diğer terapötik seçenekler dikkate alınmalıdır. Bu gibi hastaların tedavisi hemofili hastaların tedavisi konusunda uzman kişiler tarafından yapılmalıdır (bkz.Bölüm 4.4).
Uygulama şekli:
Flakon içeriğindeki toz haldeki etken madde aşağıda anlatıldığı şekilde çözündürülür.
Ürün, intravenöz yoldan enjeksiyon veya yavaş infüzyon şeklinde uygulanır. Günde 100 IU/kg'dan fazla dozda uygulanmaması tavsiye edilir. Uygulamanın hızı her bir hasta için değerlendirilmelidir.
Tozun çözücü ile rekonstitüe edilmesi
1. Toz halde etken madde içeren flakon ve çözücüyü oda sıcaklığına getiriniz;
2. Toz etken madde içeren flakon ve çözücü flakonun kabım çıkarınız;
3. İki flakon tıpasının yüzeyini alkol İle temizleyiniz;
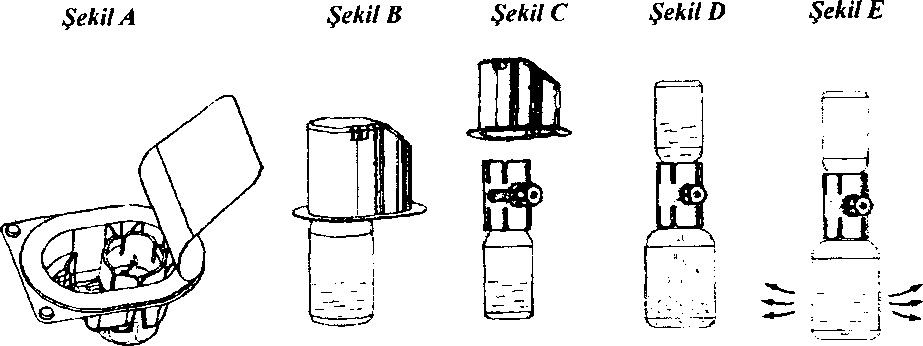
4. Başlığı sıyırarak aparatın ambalajını açınız; iç kısma dokunmamaya dikkat ediniz (Şekil A);
5. Aparatı ambalajından çıkarmayınız;
6. Aparat kutusunu baş aşağı çevirin ve çözücü flakon tıpasına doğru plastik sivri ucu yerleştiriniz (Şekil B);
7. Aparatı serbest bırakmak için aparat kutusunun kenarını tutunuz ve çekiniz (Şekil C);
8. Aparatı çözücü flakonuna bağlı bırakınız; sistemi ters çeviriniz böylece çözücü flakonu aparatın üstünde olur;
9. Toz flakon tıpasına doğru diğer sivri uçlu plastiği yerleştiriniz; toz flakondaki vakum, çözücüyü toz flakonun içine çekecektir (Şekil D);
10. Çözünme tamamlanıncaya kadar yavaşça çalkalayınız (Şekil E); ürünün tamamen çözündüğünden emin olunuz, diğer türlü etkin madde aparatın filtresinden geçmeyecektir.
Çözücü sıcak su banyosu içinde ısıtılarak, flakonu sulandırdıktan sonra 37 Cnin üstünde olmamak kaydıyla ısıtmaya devam ederek liyofilize maddenin daha çabuk çözülmesi sağlanabilir.
Eğer toz tamamen çözülmezse filtrasyon sırasında aktivite kaybı olur. Flakonun iç yüzeylerine çözücünün yavaşça akması sağlanarak köpük oluşumu önlenir. Sulandırma süresi 3 dakikadan daha kısadır.
Çözeltinin uygulanması
Çözelti berrak veya hafif opelesandır.
Çözeltide katı parçacık olup olmadığını veya uygulamadan önce renginin değişip değişmediğini inceleyiniz. Bulanık veya tortu olan çözeltileri kullanmayınız.
1. Rekonstitüe çözeltiyi içeren toz flakona doğru aparat kapağını çekin ve onu kaplayan kabı uzaklaştırınız (Şekil F);
2. Şırıngayı hava ile doldurun, pistonu geri çekin, aparata tutturun ve havayı rekonstitüe çözeltiyi içeren toz flakonun içine enjekte ediniz (Şekil G);
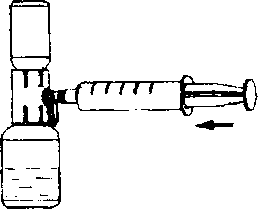
3. Pistonu bırakın, sistemi ters çevirin böylece toz flakonu aparatın üstündedir ve yavaşça piston geri çekilerek konsantre şırınganın içine çekilir (Şekil H);
4. Kapağı yavaşça orijinal durumuna çevirin ve şırıngayı çıkarınız.
5. Şırıngaya kelebek iğnesini yerleştiriniz ve intravenöz olarak infuze veya yavaşça enjekte ediniz.
4/11
Şekil H
Şekil G
Şekil F
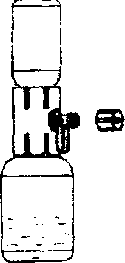
Ürün çözüldüğü taktirde derhal kullanılmalıdır.
Arta kalan kullanılmamış çözelti uygun bir şekilde yok edilmelidir. Flakon içeriği tek bir kullanım içindir.
Etiket üzerinde belirtilmiş olan son kullanma tarihinden sonra kullanılmamalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
Böbrek/karaciğer yetmezliği olan hastalarda doz ayarlaması gerekliliği ile ilgili herhangi bir veri yoktur.
Pediyatrik popülasyon:
6 yaşından küçük çocuklarda AIMAFIX kullanımına ilişkin yeterli veri yoktur.
Geriyatrik popülasyon:
Geriyatrik popülasyonda doz ayarlaması gerekliliği ile ilgili herhangi bir veri yoktur.
4.3. Kontrendikasyonlar
Preparatın içinde bulunan etkin maddeye ya da yardımcı maddelerden herhangi birine aşırı duyarlılığı olan hastalarda kontrendikedir.
4.4. Özel kullanım uyarılan ve önlemleriVirüs güvenliği
İnsan kanı veya plazmasından hazırlanan tıbbi ürünlerin kullanımından kaynaklanan enfeksiyonların önlenmesi için standart önlemler; donörlerin seçimi, bireysel bağışçıların ve plazma havuzlarının taranması için spesifik enfeksiyon belirteçlerinin kullanılması ve virüslerin inaktivasyonu/uzaklaştırılması için etkili üretim aşamalarını içermektedir.
İnsan kanı veya plazmasından elde edilen ürünler kullanılırken, enfeksiyöz ajanların geçişine bağlı enfeksiyon hastalıkları olasılığı tamamen devre dışı bırakılamaz. Buna bugüne kadar bilinmeyen patojenler de dahildir.
5/11
İnaktivasyonun etkinliği HIV ve HAV için ve BVDV (Bovine viral diarrhoea virüs) ve PRV için gösterilmiştir, HCV ve HBV için virüs modelleri olarak tanınmıştır. Kendine özgü özellikleri sebebiyle, Parvovirüs B19 bulaşma riski tamamen devre dışı bırakılamamaktadır.
Alınan önlemlerin HIV, HBC, HCV gibi zarflı virüsler ile HAV gibi zarflı olmayan virüsler için etkili olduğu düşünülmektedir.
Zarfsız olan Parvovirüs B19'a karşı alınan önlemlerle ilgili veriler sınırlı olabilir.
Ayrıca, Creutzfeldt-Jacob hastalığı'nın teorik olarak geçiş riski minimumdur. Alınan bu önlemlere rağmen, bu tür ürünler (plazma kaynaklı) halen potansiyel olarak bulaşıcı hastalıkları bulaştırabilir. Bu ürün insan kanından üretildiği için, virüslerin ve teorik olarak Creutzfeldt-Jacob (CJD) hastalığının yol açtığı bulaşıcı hastalıkları bulaştırma riski taşıyabilir.
Plazma kaynaklı Faktör IX alan tüm hastalar için uygun aşılama Önerilir (Hepatit A ve B)
Parvovirüs B19 enfeksiyonu, gebelikte (fetal infeksiyon) ve immün yetmezlik ya da kırmızı kan hücre üretiminde artış olan hastalarda tehlikeli olabilir (hemolitik anemi gibi).
Tüm bu önlemlere rağmen insan plazmasından elde edilen ürünler enfeksiyon bulaştırma riski taşıyabilmektedir. Bu nedenle ileride oluşabilecek bir hastalıkta kullanılmış ürün ile aradaki bağlantıyı kurabilmek için, kullandığınız ürünün adı ve seri numarasını kaydederek bu kayıtları saklayınız.
İnsan plazma pıhtılaşma Faktör IX ürünleri ile tekrarlanan tedaviden sonra, hastalar uygun biyolojik testler kullanılarak Bethesda Unit (BU) olarak belirlenen nötralize edici antikorların (inhibitörleri) gelişimi açısından izlenmelidir.
Herhangi bir intravenöz protein ürününe karşı alerjik türde aşırı duyarlılık reaksiyonları mümkündür.
Ürün, Faktör IX dışında eser miktarda insan proteinleri içerir. Hastalar, ürtiker, genel ürtiker, göğüs sıkışması, hırıltı, hipotansiyon ve anafılaksi gibi aşırı duyarlılık reaksiyonlarının erken belirtileri konusunda bilgilendirilmelidir. Eğer bu semptomlar olursa, ürünün kullanımının derhal durdurulması ve hekime danışılması önerilir.
Şok durumunda, şok tedavisinin mevcut spesifik kurallarına uyulmalıdır.
Bir faktör IX inhibitörü oluşumu ve alerjik reaksiyonlar arasında bir korelasyon gösteren literatürler rapor edilmiştir. Bu sebeple, aleıjik reaksiyon geçirmiş hastalar bir inhibitör varlığı açısından değerlendirilmelidir. Faktör IX inhibitörlü hastalarda, Faktör IX ile sonradan ortaya çıkan bir anafılaksi riskinin artabileceği dikkate alınmalıdır.
Faktör IX konsantratı ile alerjik reaksiyon riski sebebiyle, tedaviyi yapan uzmanın görüşüne göre, alerjik reaksiyonlar açısından Faktör IX'un başlangıç uygulamaları kusursuz tıbbi bakımın yapılabileceği merkezlerde, tıbbi gözlem altında yapılmalıdır.
Protrombin kompleks konsantratlarının kullanımı, geçmişte tromboembolik komplikasyonların gelişimine bağlı olduğundan, düşük saflıktaki preparatlarda daha yüksek olan bu risk, Faktör IX içeren ürünlerin kullanımı, yaygın intravasküler koagülasyonlu hastalar ve fıbrinoliz belirtileri olan hastalarda potansiyel olarak riski olabilir. Potansiyel trombotik komplikasyon riski sebebiyle, karaciğer hastalığı, ameliyat sonrası hastalara, ya da trombotik fenomen ya da yaygın damar içi pıhtılaşması riski olan hastalara uygulandığında, trombotik ve tüketim koagülapatisinin erken belirtilerinin klinik araştırması uygun biyolojik test yapılmalıdır. Bu durumların her birinde, Al M AF IX ile tedavinin yararı bu komplikasyonların riskine karşı değerlendirilmelidir.
Faktör IX inhibitörlü ve bir aleıjik reaksiyon hikayesi olan hemofili B hastalarında immün tolerans indüksiyonunu takiben nefrotik sendrom rapor edilmiştir.
Hemofili B hastaları Faktör IX'a karşı nötralize edici antikorlar (inhibitörler) geliştirebilir. Bu inhibitörler oluşursa, bu durum klinik cevap yetersizliği olarak değerlendirilir. Bu gibi vakalarda, özel bir hemofili merkezine danışılmalıdır.
AIMAFIX ile tedavi edilen hastalarda inhibitörlerin varlığı hakkında hiçbir veri yoktur.
Faktör IX ürünlerinin uygulamasını takiben, düşük saflıkta preparatlar için daha yüksek olan, potansiyel bir tromboembolik episod riski vardır. Düşük saflıkta Faktör IX ürünlerinin kullanımı miyokardiyal enfaktüsü, yaygın damar içi pıhtılaşması, venöz trombozis ve pulmoner embolizm örnekleri ile bağlantılıdır. Bu gibi yan etkiler yüksek saflıkta Faktör IX kullanımı ile nadiren görülür.
Bu tıbbi ürün her 500 IU/10 mL'de 1,6 mmol (36,8 mg) sodyum ihtiva eder. Bu durum kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır.
AIMAFIX, 50 IU heparin sodyum içermektedir. Alerjik reaksiyonlara ve kanın pıhtılaşma sistemini etkileyebilecek olan kan hücre sayısında düşmelere neden olabilir. Geçmişinde heparinle indüklenmiş alerjik reaksiyonu olan hastaların heparin ihtiva eden ilaçları kullanmaktan kaçınmaları gerekir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
AIMAFIX'in diğer ilaçlarla herhangi bir etkileşimi bugüne kadar bilinmemektedir.
Özel popülasyonlara ilişkin ek bilgiler:
Mevcut değildir.
Pediyatrik popülasyon:
6 yaşından küçük çocuklarda AIMAFIX kullanımına ilişkin yeterli veri yoktur.
4.6. Gebelik ve laktasyon Genel tavsiye
Gebelik Kategorisi C'dir.
Çocuk doğurma potansiyeli bulunan kadmlar/Doğum kontrolü (Kontrasepsiyon)
AIMAFIX'in, çocuk doğurma potansiyeli bulunan kadınlarda kullanımına ilişkin özel bir öneri veya tedavi sırasında veya sonrasında doğum kontrolünün gerekli olduğuna dair herhangi bir bilgi söz konusu değildir.
Gebelik dönemi
AIMAFIX'in gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir.
Hayvanlar üzerinde yapılan çalışmalar, gebelik/ve-veya/embriyonal/fetal gelişim/ve veya/ doğum/ve-veya/doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
AIMAFIX gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
AIMAFIX 'in anne sütüyle atılıp atılmadığı bilinmemektedir. AIMAFIX'in süt ile atılımı hayvanlar üzerinde araştırılmamıştır. Emzirmenin durdurulup durdurulmayacağına ya da AIMAFIX tedavisinin durdurulup durdurulmayacağına/tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken, emzirmenin çocuk açısından faydası ve AIMAFIX tedavisinin emziren anne açısından faydası dikkate alınmalıdır.
Üreme yeteneği/ Fertilite
Hayvan üreme çalışmaları yürütülmemiştir. İnsanlardaki üreme yeteneği/fertiliteyi etkileyip etkilemediği bilinmemektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
AIMAFIX'in araç ve makine kullanımına hiçbir etkisi gözlenmemiştir.
4.8. İstenmeyen etkiler
Rapor edilen istenmeyen etkiler aşağıdaki sıklık derecesine göre listelenmiştir.
Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Kan ve lenf sistemi hastalıkları
Bilinmiyor: Yaygın intravasküler koagülasyon, Faktör IX inhibitörlerin gelişimi (Faktör IX inhibisyonu)
Bağışıklık sistemi hastalıkları
Bilinmiyor: Hipersensitivite veya alerjik reaksiyonlar, şiddetli anafılaksi
Psikiyatrik hastalıkları
Bilinmiyor: Huzursuzluk
Sinir sistemi hastalıkları
Bilinmiyor: Letarji, karıncalanma, baş ağrısı
Kardiyak hastalıkları
Bilinmiyor: Miyokard enfarktüs, taşikardi
Vasküler hastalıkları
Bilinmiyor: Cildin kızarması, hipotansiyon, venöz tromboz, tromboembolik olaylar (emboli ve tromboz)
Solunum, göğüs bozuklukları ve mediastinal hastalıkları
Bilinmiyor: Pulmoner emboli, hırıltılı solunum
Gastrointestinal hastalıkları
Bilinmiyor: Bulantı, kusma
Deri ve deri altı doku hastalıkları
Bilinmiyor: Anjiyoödem, yaygın ürtiker
Böbrek ve idrar hastalıkları
Bilinmiyor: Nefrotik sendrom
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıkları
Bilinmiyor: İnfıizyon yerinde yanma ve kaşıntı (infıizyon yerinde ağrı), soğuk algınlığı nöbeti, göğüs sıkışması (göğüs ağrısı), ateş (yüksek ateş)
4.9. Doz aşımı ve tedavisi
AIMAFIX ile hiçbir doz aşımı rapor edilmemiştir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik Özellikler
Farmakoterapötik grubu: Antihemorajikler: kan koagülasyon Faktör IX.
ATC kodu: B02BD04
Faktör IX moleküler ağırlığı 68.000 Dalton civannda olan tek zincirli bir glikoproteindir. Karaciğerde K vitaminine bağlı olarak sentezlenen koagülasyon faktörüdür. Faktör IX, intrensek koagülasyon sisteminde Faktör XI tarafından, ve ekstrinsik sistemde Faktör VII / doku Faktör kompleksi tarafından aktif hale getirilir.
Aktif Faktör IX'un aktif Faktör VIII ile kombinasyonunda, Faktör X aktif hale gelir. Aktif Faktör X protrombini trombine dönüştürür. Trombin daha sonra fibrinojeni fibrine dönüştürür ve pıhtı oluşur. Hemofili B, azalan Faktör IX seviyesi sebebiyle, cinsiyete bağlı kalıtsal bir kan pıhtılaşma hastalığıdır ve eklemlerde, kaslarda, ya da iç organlarda ya kendiliğinden ya da kaza ya da cerrahi travmanın sonucu olarak şiddetli kanama ile sonuçlanır. Yerine koyma tedavisi ile Faktör IX plazma seviyesi artırılarak kanama eğilimlerinde düzelme ve faktör yetersizliğinde geçici bir düzelme sağlar.
5.2. Farmakokinetik Özellikler Genel Özellikler
Hemofili B hastalarında, insan plazma koagülasyon Faktör IX infiizyonu, plazma Faktör IX aktivitesini % 30-% 60 düzeltir.
Emilim:
İntravenöz uygulandığından tamamı emilir.
Dağılım:
Mevcut veri bulunmamaktadır.
Bivotransformasvon:
Plazma yanlanma ömrü 16-30 saat arasında, ortalama 24 saattir.
Eliminasyon:
Mevcut veri bulunmamaktadır.
Doğrusallık/doğrusal olmayan durum:
Mevcut veri bulunmamaktadır.
5.3. Klinik öncesi güvenlilik verileri
İnsan plazma koagülasyon Faktör IX (konsantrattan elde edilen) insan plazmasının normal bir bileşenidir ve endojen Faktör IX gibi hareket eder.
Daha yüksek dozlar aşırı yükleme ile sonuçlandığı için, tek doz toksisite testi ile ilgisi yoktur. Hayvanlarda tekrarlanan doz toksisite testi, heterolog proteinlere karşı gelişen antikorların engellemesi sebebiyle uygulanabilir değildir.
Vücut ağırlığının kg'ı başına önerilen insan dozajı birkaç kere laboratuar hayvanları üzerinde uygulansa bile hiçbir toksik etki göstermemiştir.
Klinik çalışmalar, insan koagülasyon Faktör IX'un tümorojenik ve mutajenik etkileri için hiçbir endikasyon sağlamadığından, deneysel çalışmaların, özellikle heterolog türlerde, gerekli olduğu düşünülmemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sodyum klorür Sodyum sitrat Glisin
Heparin sodyum Antitrombin III Enjeksiyonluk su
6.2. Geçimsizlikler
AIMAFIX diğer ilaçlarla karıştırılmamalıdır.
İnsan plazma koagülasyon Faktör IX'un bazı infüzyon ekipmanlarının iç yüzeyleri üzerine adsorbsiyonuna bağlı olarak tedavinin başarısız olması mümkün olabildiğinden, sadece onaylanmış enj eksi yon/i nflizyon setleri kullanılabilir.
6.3. Raf ömrü
36 ay.
6.4. Saklamaya yönelik Özel tedbirler
2-8°C'de (buzdolabında) orijinal ambalajında saklanmalı, ışıktan korunmalıdır. Dondurulmamalıdır. Dondurulmuş ürünler çözündürülüp tekrar kullanılmamalıdır.
Ürün hazırlandığı takdirde derhal kullanılmalıdır.
6.5. Ambalajın niteliği ve içeriği
AIMAFIX, toz içeren kauçuk tip I elastomer tıpa ile beraber tip I cam flakon ; çözücü içeren tip I elastomer tıpa ile beraber tip I cam flakon ; rekonstitüsyon için pirojenik olmayan, steril, imha edilebilir üç yollu tıbbi cihaz, enjeksiyon için şırınga ve PVC tüp ile beraber kelebek iğnesi.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Gerekli olduğu takdirde kullanılmamış olan ürünler ya da atık materyaller "Tıbbi atıkların kontrolü yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri ne uygun olarak imha edilmelidir.
7. RUHSAT SAHİBİ
Onko İlaç San. ve Tic. A.Ş.
Koşuyolu Cad. No: 34, 34718 Kadıköy/İSTANBUL Tel: (0216) 544 90 00 Faks: (0216) 545 59 92 E-mail:
8. RUHSAT NUMARASI(LARI)
43
9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ
İlk ruhsat tarihi: 15.12.2008 Ruhsat yenileme tarihi:
10. KÜB'ÜN YENİLENME TARİHİ
11/11

 Çözücü sıcak su banyosu içinde ısıtılarak, flakonu sulandırdıktan sonra 37 Cnin üstünde olmamak kaydıyla ısıtmaya devam ederek liyofilize maddenin daha çabuk çözülmesi sağlanabilir.
Çözücü sıcak su banyosu içinde ısıtılarak, flakonu sulandırdıktan sonra 37 Cnin üstünde olmamak kaydıyla ısıtmaya devam ederek liyofilize maddenin daha çabuk çözülmesi sağlanabilir.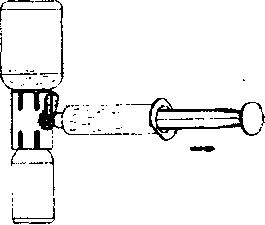
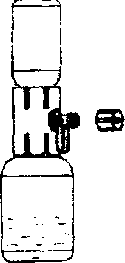 Ürün çözüldüğü taktirde derhal kullanılmalıdır.
Ürün çözüldüğü taktirde derhal kullanılmalıdır.