Tegeline 2.5 G/50ml Kısa Ürün BilgisiEnfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar » İmmün Serum ve İmmünoglobülinler » İmmünoglobülinler » Damara Enjekte Edilen İmmünglobulinler » İmmunglobulin KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADITEGELINE 2.5 g/50 mL I.V. infüzyon için liyofilize toz içeren flakon 2. KALİTATİF VE KANTİTATİF BİLEŞİM Steril Toz içeren her flakonda: Etkin madde: 50 mL'de 2.5 g normal insan immunoglobulini1 * Toz, maksimum 17 mg/g proteinlik IgA ve az miktarda hayvan kaynaklı pepsin içerir. Yardımcı maddeler: Sodyum klorür 0.1 g Sukroz 5 g Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORM IV infüzyon çözeltisi hazırlamak için liyofilize toz ve çözücü Çözelti berrak ya da hafif opaktır. 4. KLİNİK ÖZELLİKLER 4.1. Terapötik endikasyonlar - Primer immün yetmezlik sendromları, - Ciddi enfeksiyonlarla seyreden ve sekonder hipogamaglobulinemi gelişmiş multipl miyelom ve kronik lenfositik lösemi, - Allojenik kemik iliği nakli sürecinde gelişen immün yetmezlik tedavisinde, - AIDS'li çocuklarda tekrarlayan enfeksiyon durumlarında (Pediatrik HIV enfeksiyonunda), - Guillain Barre sendromunda, - Steroid tedavisine dirençli ve klinik kanamalarla giden immün trombositopenik purpura'da, - İTP hastalarında trombositopenik dönemde yapılacak cerrahi veya splenektomiye hazırlık amacıyla, - Bulber tutulumu olan Myastenia Gravis'te, - Kawasaki hastalığı, - Gebeliğe sekonder immün trombositopeni veya gebelik ve ITP beraberliğinde, -Birdshot retinokoroidopatinin tedavisinde, - Multifokal Motor Nöropati (MMN)'de, - Kronik İnflamatuvar Demiyelinizan Poliradikülonöropati (dDP)'de kullanılabilir. 4.2. Pozoloji ve uygulama şekli Pozoloji: Uygulama sıklığı ve süresi: Doz ve dozlar arasındaki süre tedavinin amacına ( replasman ya da modülatör tedavisi ) ve immun yetersizliği olan hastalarda intravenöz enjeksiyonu takiben normal insan immunoglobilinin in vivoyarılanma ömrüne bağlı olarak düzenlenir.Aşağıdaki dozlar genel bir tavsiye niteliğindedir: Primer immun yetmezlikte replasman tedavisi:Tedavinin amacı, en az 6 g / L rezidüel IgG seviyesi sağlamaktır (bir sonraki TEGELINE dozundan önce). İnatçı enfeksiyonlar durumunda, IgG seviyeleri 8 veya 10 g/L'ye çıkarılabilir. IV Ig ile tedaviye başlanmasını takiben hastalar 3 - 6 ay sonra stabilize olurlar. Koşullara göre (örn. Enfeksiyon) 0.4 - 0.8 g/ kg'lık yükleme dozu ve idame olarak her 3 haftada bir 0.2g/kg infüzyon uygulanması önerilir. 6 g/ L seviyelerinin sağlaması için yaklaşık 0.3 g/kg/ay IV Ig dozları (0.2 - 0.8 g/kg/ay doz aralığı ile) gereklidir. Stabil koşullara ulaşıldığında doz aralığı 2-4 hafta arasında değişir. Enfeksiyon gelişimi halinde daha sık infüzyon uygulanması gerekebilir. Primer immun yetmezliklerin replasman tedavisinde, her infüzyondan önce, tedavinin yararını tespit için serum Ig G analizi yapılır ve eğer gerekirse, doz ya da uygulama aralıkları yeniden düzenlenir. Ciddi enfeksiyonlarla seyreden ve sekonder hipogamaglobulinemi gelişmiş multiplmiyelom ve kronik lenfositik lösemi ve pediyatrik HIV enfeksiyonlarında replasmantedavisi:En az 4-6 g/L'lik IgG seviyelerini (bir sonraki IVIg infüzyonundan önce ölçülen) sağlamak için, her 3 -4 haftada bir 0.2 - 0.4 g/kg/gün doz önerilir. Primer ve sekonder immun yetmezliklerin replasman tedavisi, en az 6 ay hastanede TEGELINE ile tedavi edilen hastalarda yan etki görülmeksizin uygulanabilir. Uygulama, bir hemşire veya hastadan sorumlu hastane ekibinden özel eğitim almış kişiler tarafından başlatılmalı ve izlenmelidir. Steroid tedavisine dirençli ve klinik kanamalarla giden immün trombositopenik purpura;ITP hastalarında trombositopenik dönemde yapılacak cerrahi veya splenektomiye hazırlıkamacıyla; Gebeliğe sekonder immün trombositopeni veya gebelik ve ITP beraberliğinde;Bulber tutulumu olan Myastenia Gravis'de:Yükleme dozu : 1. gün 0.8 - 1 g/kg/gün ( gerekirse 3. gün tekrarlanabilir ) veya 2 - 5 gün süreyle 0.4 g/kg/gün. Eğer trombositopeni nüksederse tedavi tekrarlanmalıdır. Yetişkinlerde Guillain- Barre sendromu:5 gün için 0.4 g/kg/gün'dür. Kawasaki hastalığı:Doz, 2-5 gün içinde bölünmüş dozlar halinde 1.6-2.0 g/ kg veya 2.0 g/kg tek doz olarak ve asetilsalisilik asit ile kombine olarak verilmelidir. Birdshot retinokoroidopatinin tedavisinde:Başlangıç dozu, 6 ay süre ile her 4 haftada bir 2 - 4 gün, 1.6 g/kg' dır. İdame dozu, her 4 - 10 haftada bir 2 - 4 gün içinde verilen 1.2g/kg. Multifokal Motor Nöropati (MMN):Başlangıç tedavisi için pozoloji 6 ay boyunca her 4 haftada bir 2 ile 5 gün arasında uygulanan 2 g/kg'dır. İdame tedavisi için pozoloji 2 ile 5 gün boyunca uygulanan 2 g/kg'dır. TEGELINE uygulama sıklığı ve idame tedavisinin süresi her bir hastada semptomların yeniden ortaya çıkmasına kadar geçen süreye göre ayarlanmalıdır. Terapötik etkinin oluşmaması durumunda, TEGELINE tedavisi en az 3 ay ve en fazla 6 aydan sonra kesilebilir. Kronik İnflamatuvar Demiyelinizan Poliradikülonöropati (CIDP):5 gün boyunca 2 g/kg uygulanan ve her 4 haftada bir tekrar edilen pozoloji tedavi yanıtına bağlı olarak en fazla 4 ay boyunca idame ettirilir. Terapötik etkinin oluşup oluşmadığı her bir tedavi küründen sonra değerlendirilmelidir. Herhangi bir etki gözlenmemesi durumda tedavi 3 aydan sonra kesilebilir. Doz önerileri aşağıdaki tabloda özetlenmiştir:
TEGELINE, Kullanma Talimatında belirtildiği şekilde kullanılmadan önce enjeksiyonluk su ile hazırlanan toz formudur. IVIg, hazırlandıktan hemen sonra tek doz olarak sadece intravenöz infüzyon şeklinde uygulanmalıdır. Akış hızı, hastanın klinik toleransına göre ayarlanmalıdır ve ilk yarım saat sırasında 0.5 mL/ kg/ saati aşmamalıdır. Daha sonra kademeli olarak 4 mL/ kg/ saati aşmayacak şekilde artırılır. Bulanık veya çökeltisi olan çözeltiler kullanılmaz. Özel popülasyonlara ilişkin ek bilgiler Böbrek/Karaciğer yetmezliği: Ig IV tedavi alan hastalarda akut böbrek yetmezliği vakaları rapor edilmiştir. Birçok vakada, daha önceden var olan böbrek yetmezliği, diabetes mellitus hipovolemi, aşırı kilo, nefrotoksik ilaçların birlikte kullanımı veya 65 yaş üzerindeki hastalar gibi risk faktörleri belirlenmiştir. Böbrek ve karaciğer yetmezliği olan hastalarda minimum konsantrasyonda ve pratik olarak mümkün en yavaş infüzyon hızıyla uygulanmalıdır. Pediyatrik popülasyon: İlacın dozu vücut ağırlığına göre hesaplanmalı ve ilaç minimum infüzyon hızında uygulanmalıdır. Geriyatrik popülasyon: 65 yaşın üzerindeki hastalarda doz ayarlaması yapılarak ve minimum infüzyon hızında verilir. 4.3. Kontrendikasyonlar Özellikle Ig A eksikliği olan kişiler arasında insan immunoglobulinlerine aşırı duyarlığı olanlar ve anti-Ig A antikoru geliştiren, Etkin madde ve yardımcı maddelere karşı aşırı duyarlığı olan kişilerde kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleri Multifokal motor nöropati (MMN) ile kronik inflamatuvar demiyelinizan poliradikülonöropati (CIDP) teşhisleri ilgili uzman hekim tarafından konulmalı ve TEGELINE ile tedaviye ilgili uzman hekimin tavsiyesi üzerine başlanmalıdır. İstenmeyen etkiler, infüzyon hızına bağlı olabilir. 4.2 Pozoloji ve uygulama şekli bölümünde verilen sürelere mutlaka uymak gereklidir. Ayrıca, infüzyon sırasında hasta istenmeyen etkiler açısından yakından izlenmelidir. Bazı advers reaksiyonlar aşağıdaki durumlarda daha sık oluşabilir: Hızlı intravenöz infüzyon (4.2 Pozoloji ve uygulama şekli bölümüne bakınız) IgA yetmezliği olan ya da olmayan hipogamaglobulinemi ya da agamaglobulinemi İlk kez normal insan immunoglobulini uygulaması yapılacak hastalar ya da nadiren, kullanılan normal insan immunoglobulin preparatı değiştirildiğinde ya da en son uygulamadan sonra 8 hafta geçmişse. Gerçek aşırı duyarlılık reaksiyonları nadirdir ve çok seyrek olarak anti-IgA antikoru olan IgA yetmezlikli vakalarda görülmektedir. Nadiren normal insan immunoglobulini, daha önce insan immunoglobulin tedavisi uygulanmış ve tedaviyi tolere edebilmiş hastalarda bile anafilaktik reaksiyonla birlikte kan basıncında düşmeye neden olabilmektedir. Potansiyel komplikasyonları aşağıdaki önlemlere dikkat ederek, sıklıkla önlemek mümkündür: - İnfüzyon hızının dikkatle izlenmesi, -Yavaş infüzyon (1mL/kg/saat) yoluyla başlangıçta IV Ig' ye toleransının kontrolü. - Geçici glukozüri gelişebilen latent diabetes mellitus, diabetes mellitus ya da düşük yağlı diyette şeker miktarının ( 2 g/g Ig G ) hesaba katılması. -İnfüzyon boyunca yan etki olasılığına karşı hastanın yakından izlenmesi. Özellikle daha önce normal insan immunoglobulini infüzyonu uygulanmamış, farklı bir preparat uygulanmış ya da daha önceki infüzyondan sonra 8 hafta geçmiş olan hastalar, potansiyel istenmeyen etkilerin belirtisini tespit etmek için ilk infüzyon süresince ve infüzyondan sonraki ilk saat boyunca dikkatle izlenmelidir. Diğer tüm hastalar da uygulamadan sonra en az 20 dakika süreyle izlenmelidir. Özellikle vasküler komplikasyon riski olan hastalarda hızlı intravenöz infüzyonla ilişkili olarak arteriyel ve venöz tromboz riski daha büyüktür (bkz. Bölüm 4.2. Uygulama şekli). Ig IV tedavi alan hastalarda akut böbrek yetmezliği vakaları rapor edilmiştir. Birçok vakada, daha önceden varolan böbrek yetmezliği, diabetes mellitus, hipovolemi, aşırı kilo, nefrotoksik ilaçların birlikte kullanımı veya 65 yaş üzerindeki hastalar gibi risk faktörleri belirlenmiştir. Tüm hastalarda, IVIg uygulanması için şunlar gereklidir: - IV Ig infüzyonunun başlangıcından önce yeterli hidratasyon sağlamak, - İdrar miktarının izlenmesi, - Serum kreatinin seviyelerinin ölçülmesi, - Kıvrım diüretiklerinin beraber kullanımının engellenmesi. Böbrek fonksiyon bozukluğu ya da akut böbrek yetmezliğinin değişik IVIg preparatlarının kullanımıyla ilişkili olabileceği bildirilmiş olmasına rağmen, olguların çoğundan, stabilizatör olarak sukroz içeren preparatlar sorumlu tutulmaktadır. Risk altındaki hastalarda, sukroz içermeyen preparatların kullanımı düşünülmelidir. Alerjik ya da anafilaktik reaksiyon görülürse infüzyona hemen son verilmelidir. Şok durumunda, semptomatik tedavi hemen başlatılmalıdır. Kan ürünleri veya plazma kökenli tıbbi ürünler uygulandığında enfeksiyon etkenlerinin bulaşma riski kesin olarak dışlanamaz. Bu durum henüz bilinmeyen patojenler için de geçerlidir. Ancak, bu risk aşağıdaki önlemler ile azaltılmıştır: Donörler, ciddi bir tıbbi inceleme sonucunda seçilmekte ve her bağışta HIV, HCV ve HBV gibi major patojenik virüsleri de kapsayan tarama testleri yapılmaktadır. Plazma havuzları HCV ve parvovirüs B19 genomik materyali için test edilir. Viral eliminasyon ve/veya inaktivasyon evrelerini kapsayan ekstraksiyon/pürifikasyon işlemleri, HIV, HCV, HBV için valide edilmiştir. Ürünün hazırlandığı plazma, Creutzfeldt-Jacob hastalığı (CJD)'a ait hiçbir klinik belirti taşımayan ve CJD şüphesi bulunmayan, sağlıklı donörlerden toplanmıştır. Ancak bu ürün insan kanından üretilmiş olmasına rağmen, virüsler ve teorik olarak CJD ajanı taşıyabilme riski bulunmaktadır. TEGELINE uygulaması ile bugüne kadar virüs kontaminasyonu rapor edilmemiştir. Viral uzaklaştırma/ inaktivasyon prosedürlerinin etkisi, hepatit A veya parvovirüs B19 gibi zarfsız virüslere karşı sınırlı olabilir. Hasta ve ürünün arasındaki bağlantıyı korumak için, hastaya her TEGELINE uygulanmasında, hastanın ismi ve ürünün seri numarası kaydedilmelidir. TEGELINE 10 mL'de 8 mg sodyum içerir (50 mL=40 mg). Düşük tuz diyeti uygulayan hastalarda bu durum dikkate alınmalıdır. Bu tıbbi ürün 50 mL'de 5 g sukroz içerir. Eğer daha önceden doktorunuz tarafından bazı şekerlere karşı intoleransınız olduğu söylenmişse bu tıbbi ürünü almadan önce doktorunuzla temasa geçiniz. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri Canlı virüs aşıları ile etkileşim: IV Ig uygulaması, kızamık, kızamıkçık, kabakulak ve su çiçeği gibi canlı virüs aşılarının etkinliğini, en az 6 haftadan en çok 3 aya kadar bozabilir. Bu tip aşıların uygulanabilmesi için IV Ig infüzyonundan sonra 3 aylık bir süre geçmelidir. Kızamık hastalarında bu durum 1 yıla kadar sürebilir. Eğer hasta infüzyondan önceki 2 hafta içinde bu aşılardan birini olmuşsa, aşı tekrarı gerekip gerekmediğini tayin etmek için aşı sonrası koruyucu antikor düzeyinin kontrolü gerekebilir. Serolojik testler ile etkileşim: Normal insan immunoglobulin infüzyonundan sonra hastanın kanına pasif olarak transfer edilmiş antikorların hastanın kanında geçici olarak yükselmesi, serolojik testlerde yanıltıcı pozitif sonuçlara neden olabilir. Bu ürünün anti-eritrosit antikorlar içermesi nedeniyle antiglobulin (Coombs) testi, uygulama sonrasında geçici olarak pozitif sonuç verebilir. 4.6. Gebelik ve laktasyon Genel tavsiye Gebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon) Bilinen bir olumsuz etkisi bulunmamaktadır. Gebelik dönemi TEGELINE'nin gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik/ve-veya/embriyonal/fetal gelişim/ve-veya/doğum/ve-veya/doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir. Gebe kadınlara verilirken tedbirli olunmalıdır. Laktasyon dönemi TEGELINE'in hamilelerde güvenli kullanımı kontrollü klinik çalısmalarla degerlendirilmemistir. Bu nedenle emziren annelerde dikkatli kullanılmalıdır. İmmünoglobulinler anne sütü ile atılmaktadır (süte geçmektedir). Ancak immünoglobulinlerin emzirilen çocuk üzerinde herhangi bir olumsuz etkisi öngörülmemektedir. Aksine, anne sütüne geçerek yeni doğana koruyucu antikorların geçmesine katkıda bulunabilir. Üreme yeteneği /Fertilite Hayvan üreme çalışmaları yürütülmemiştir. Hamile kadına verildiğinde fötal hasara neden olup olmadığı ve üreme kapasitesini etkileyip etkilemediği bilinmemektedir. TEGELINE bu nedenle hamile kadınlara kullanımı gerekiyorsa verilmelidir. 4.7. Araç ve makine kullanımı üzerindeki etkiler IV Ig' nin araç veya diğer makinelerin kullanılması üzerine herhangi bir etkisi bulunmamaktadır. 4.8. İstenmeyen etkiler Primer immun yetmezliği olan hastalarda IV Ig uygulamasına bağlı yan etkiler daha yaygın görülür. Titreme, hipertermi, başağrısı, bulantı, kusma, alerjik belirtiler, kan basıncında düşme, hafif eklem ağrısı veya bel ağrısı görülebilir. Hiç immunoglobulin almamış veya 8 haftadan daha önce son IVIg tedavisi alan hipogamaglobulinemik hastalarda veya hızlı intravenöz infüzyon sırasında (Uygulama şekli bölümüne bakınız), anafilaktik reaksiyon riski daha yüksektir. Özellikle vasküler komplikasyon riski olan hastalarda, infüzyonun hızlı yapılması arteriyel ve venöz tromboza neden olabilir. Önceki enjeksiyonlarda aşırı duyarlılık reaksiyonları görülmeyen hastalarda arasıra hipotansiyon ( anormal düşük kan basıncı ) durumu ve anafilaktik şok bildirilmiştir. Özellikle idiopatik trombosistopenik purpurası olan hastalarda, insan immunoglobilini ile geriye dönüşümlü aseptik menenjit vakaları bildirilmiştir. Özellikle yüksek doz ile tedavi edilen hastalarda, hızlı reversibl asemptomatik lökonötropeninin erken başlangıcı görülebilir. İnsan normal immunoglobulininin intravenöz uygulamasında aşağıdaki yan etkiler bildirilmiştir: Şu terimler ve sıklık dereceleri kullanılmıştır: Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1,000 ila <1/100), seyrek (>1/10,000 ila <1/1,000); çok seyrek (<1/10,000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Kan ve lenfatik sistem hastalıkları: Seyrek: Geri dönüşümlü hemolitik anemi/hemoliz Vasküler hastalıklar : Seyrek: - İzole yüksek kan basıncı, - Özellikle yaşlı hastalarda ve serebral veya kardiyak iskemi riski olan hastalarda tromboz, aşırı kilo veya şiddetli hipovolemi Deri ve deri altı doku hastalıkları: Seyrek: Regresif kutanöz reaksiyonlar, bazen egzematiform Böbrek ve idrar hastalıkları : Seyrek: Akut böbrek yetmezliği Araştırmalar: Seyrek: Serum kreatinin seviyesinde artış Çok seyrek: Transaminazların miktarında geçici artış Bulaşıcı ajanlar açısından güvenlikle ilgili olarak 4.4 Özel kullanım uyarıları ve önlemleri bölümüne bakınız. 4.9. Doz aşımı ve tedavisi TEGELINE için bildirilmiş aşırı doz durumu olmamasına rağmen, doza bağlı bazı yan etkiler (istenmeyen etkiler bölümüne bakınız) olabilir: beyin zarı iltihabı (aseptik menenjit), böbrek yetmezliği, kanda viskozite artışı. 5. FARMAKOLOJİK ÖZELLİKLER 5.1. Farmakodinamik özellikler Farmakoterapötik grup: İmmun Sera ve İmmunoglobulinler: İmmunoglobulin, normal insan, intravenöz uygulama için ATC kodu: J06 BA02 Etki mekanizması: TEGELINE tüm immunoglobilin G (Ig G) tiplerini içermektedir. Maksimal sayı olarak 20.000 donörden alınan insan plazma havuzundan hazırlanır. Bu preparat ile uygun dozlarda yapılan tedavi, anormal derecede düşük immunoglobilin G seviyelerini normal değerlere yükseltir. Bu preparat, geniş bir antikor spektrumuna sahiptir ve çeşitli enfeksiyon ajanlarına ve toksinlere karşı opsoninleştirici ve nötralize edici potensi belgelenmiştir: Ig G seviyesi %%97.6'dır. İmmunoglobilin G' nin alt gruplarına göre dağılımı şöyledir:Ig G1 : % 58.8, Ig G2 : % 34.1, Ig G3 : % 5.4, Ig G4 : % 1.7 İmmunoglobilinlerin biyolojik fonksiyonlarının değişmediği Fc fonksiyon testi ile doğrulanmıştır. İmmunoglobulinlerin immunomodülatör şeklinde tanımlanan etki mekanizması hümoral ve hücresel bağışıklığı içeren multifaktöryel bir mekanizmadır. 5.2.Farmakokinetik özellikler Genel özellikler Emilim:İntravenöz uygulamadan sonra Ig IV hemen ve tümüyle kana geçer. Dağılım:Ig IV plazma, damar dışı sıvı, ayrıca damar içi ve dışı kompartmanlarda hızla dağılır ve 3 -5 gün içinde denge durumuna geçer. Biyotransformasyon:İmmunoglobulinler ve immunoglobulin kompleksler retiküloendoteliyal sistemin hücrelerinde yıkılırlar. Eliminasyon:TEGELINE'nin primer immun yetmezliği olan hastalarda hesaplanan yarı ömrü 36.4±16.5 gündür. Ig IV nin yarı ömrü hastanın immün durumuna göre değişir. 5.3.Klinik öncesi güvenlilik verileri Klinik öncesi güvenlilik verileri, TEGELINE'nin hiçbir mutajenik potansiyeli olmadığını doğrulamaktadır. 6. FARMASÖTİK ÖZELLİKLER 6.1.Yardımcı maddelerin listesi Sodyum klorür Sukroz Enjeksiyonluk su 6.2. Geçimsizlikler Normal insan immunoglobulini başka ilaçlarla karıştırılmamalıdır. 6.3.Raf ömrü 36 ay İlaç hazırlandıktan sonra hemen kullanılmalıdır (çözelti hazırlandıktan sonra 24 saatlik süre içinde uygulanabilir). 6.4. Saklamaya yönelik özel tedbirler Aşırı ışıktan korunarak 25°C'nin altında saklanır. Dondurmayınız. Donmuş ürünleri çözüp kullanmayınız. 6.5. Ambalajın niteliği ve içeriği 1 flakon (cam) toz + holobutil kauçuk tıpa ile kapatılmış flakon (cam) da 50 mL çözücü, dışında sterilizasyon filtresi tutturulmuş bir transfer sistemi ve filtre - iğne (10 mL) veya filtre (50 mL) eklenmiş infüzyon kiti. 6.6. Beşeri Tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler Kullanma TalimatıPreparatın Hazırlanması:TEGELINE , kullanım öncesinde enjeksiyonluk su ile hazırlanacak olan toz formundadır. Aseptik prosedür kuralları altında kullanınız. Eğer ambalaj bozulmuş ya da koruyucu kapaklar yerlerinde değilse sağlanan aksesuarları kullanmayınız. Her iki flakonu da (toz ve çözücü) oda sıcaklığına gelmesi için bekletiniz.   Çözücü ve toz flakonunun koruyucu kapaklarını çıkartınız. Kauçuk tıpaların yüzeyini alkollü bir pamukla silerek dezenfekte ediniz.  Transfer sisteminin buzlu cam görünümlü koruyucu başlığını çıkartıp, çözücü flakonunun tıpasından içeri döndürerek batırınız. Transfer sisteminin diğer ucundaki ikinci koruyucu kapağı da çıkartınız.  İki flakonu da yatay konuma getiriniz ve iğnenin serbest ucunu toz flakonunun kapağının ortasına hızla batırınız. Çözücü flakonunun içindeki iğnenin sürekli çözücü içinde kalmasına dikkat ediniz. 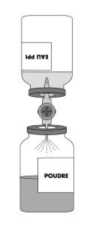 Transfer iğnesi takılı durumda iken, her iki flakonu da dikey konuma getiriniz. Çözücü toza gidecek şekilde, çözücü flakonu toz flakonunun üstünde olmalıdır. Transfer sırasında çözücü toz yüzeyinin her yanına püskürtülmelidir. Çözücünün tamamının gitmiş olduğundan emin olun. Boş flakonu (çözücü) ve transfer sistemini çıkartınız. Toz tamamen çözünene kadar ve köpürtmeden flakonu hafifçe döndürerek sallayınız.  Hazırlanan ürün çıplak gözle incelenerek partikül içerip içermediği kontrol edilir. Bu şekilde hazırlanan çözelti berrak ya da hafif opaktır. Bulanık veya çökeltisi olan çözeltiler kullanılmaz. Uygulama:50 mL için: *Hazırlanan çözeltiyi içeren şişeye, kutuda bulunan 15 pm'lik non sterilizan filtreli uygulama seti bağlanır. *İnfüzyon oranı ilk yarım saat için 0.5 mL/kg/saat' i aşmayacak şekilde hastanın klinik toleransına göre ayarlanır, daha sonra kademeli olarak 4mL/kg/saat' i aşmayacak şekilde artırılır. *TEGELINE hazırlandıktan hemen sonra intravenöz olarak tek doz halinde uygulanmalıdır. Arta kalan hazırlanmış çözelti atılmalıdır. Kullanılmamış olan ürünler ya da atık materyaller 'Tıbbi Atıkların Kontrolü Yönetmeliği' ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİ Er-Kim İlaç Sanayi ve Ticaret A.Ş. Gaziumurpaşa sok. Bimar Plaza No: 38 D: 4 Balmumcu 34349, Beşiktaş - İSTANBUL Tel: (0212) 275 39 69 Faks: (0212) 211 29 77 8. RUHSAT NUMARASI 113 9. İLK RUHSAT TARİHİ/ RUHSAT YENİLEME TA RİHİ22.08.2013 10. KÜB'ÜN YENİLENME TARİHİ 12/121Allojenik kemik iliği transplantasyonu:IV Ig, genellikle allotransplantasyondan önce ve sonra uygulanır. IV Ig, enfeksiyöz komplikasyonların gelişimini engeller ve allojenik transplantasyon alıcılarında graft-versus-host hastalığının şiddet ve sıklığının azaltılmasında etkilidir. Dozaj, tek tek kişilere göre saptanır ve genellikle (-) 7 günden (+) 90 güne kadar 0.5 g / kg/hafta dozu ile başlanır. Antikor üretimi yetersiz ise, 1 yıla kadar 0.5 g / kg / hafta doz önerilmektedir. |
İlaç BilgileriTegeline 2.5 G/50mlEtken Maddesi: Insan Immunoglobulini Atc Kodu: J06BA02 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.